FAR、NLR、PLR及其联合应用对慢性阻塞性肺疾病急性加重的预测价值
马晶晶,孙波,郭翔,王欣宇,张庆,庞桂芬,杨林瀛
承德医学院附属医院呼吸与危重症医学科,河北承德 067000
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是呼吸系统中以持续气流受限为特征的最常见的多发病之一[1]。世界卫生组织最新统计数据显示,中度或重度COPD影响全球约6500万人,到2030年COPD将成为全球第三大死亡原因[2]。与稳定期慢性阻塞性肺疾病(stable chronic obstructive pulmonary disease,SCO P D)相比,慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)与严重的呼吸道和全身性炎症反应有关,可导致更严重的临床症状及肺功能持续恶化,住院和重症监护病房入院率明显增高[3]。正确评估疾病严重程度并给予最佳治疗对于COPD患者获得更好的临床和社会经济效能至关重要[4]。目前临床上常用肺功能间接评估COPD的疾病严重程度,尤其是第1秒用力呼气容积(forced expiratory volume in one second,FEV1),但该指标仅与呼吸困难程度相关,与其他症状和疾病进展的其他指标之间的相关性较差,不能反映真实的病理生理反应和炎症状态,且肺功能检查通常不用于急性加重期,无法评估治疗干预效果,因此临床亟需寻找与COPD病理生理相关的评估指标。近年来研究发现,C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、白细胞介素-6(interleukin-6,IL-6)、IL-8、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症指标均与COPD的发生发展相关[5-8],不过这些指标各有其优缺点:CRP、PCT检测经济便捷,但易受多种因素的影响;IL-6、IL-8、TNF-α灵敏度高,但检测费用较高。作为新兴的炎症指标,中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)和血小板/淋巴细胞比值(platelet/lymphocyte ratio,PLR)是由全血细胞计数衍生而来的,且二者均与COPD的炎症程度和临床症状相关[9]。纤维蛋白原/白蛋白比值(fibrinogen/albumin ratio,FAR)是两种急性期蛋白的比值,其作为一种新型的炎症标志物,与各种肿瘤和心血管疾病的预后以及风湿免疫疾病的活动度相关[10-12]。然而,FAR在AECOPD中的应用鲜见报道。本研究探讨了FAR、NLR、PLR与COPD急性加重的关系及其对AECOPD的预测价值,以期早期识别和判断疾病的严重性,为后续的规范化治疗及管理提供参考。
1 资料与方法
1.1 研究对象 本研究为单中心病例对照研究。选择2019年9月-2021年7月在本院呼吸与危重症医学科住院的AECOPD患者96例(设为AECOPD组),其中男51例,女45例,年龄(62.4±9.1)岁;选择同期在门诊复诊近3个月来无急性加重的SCOPD患者103例(设为SCOPD组),其中男61例,女42例,年龄(65.5±9.2)岁。所有患者依据2019年慢性阻塞性肺疾病全球倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD)[13]确定为AECOPD和SCOPD。排除标准:(1)合并心、肝、肾功能不全;(2)合并结缔组织病;(3)合并肺部本身疾病,如支气管哮喘、间质性肺病、肺脓肿、肺结核等;(4)合并恶性肿瘤;(5)合并严重创伤;(6)近1周接受过抗生素治疗;(7)近2个月静脉注射或口服糖皮质激素;(8)临床资料不完整。AECOPD患者依据GOLD指南,结合临床表现、体征和血气分析等检查进行严重程度分级,分为Ⅰ-Ⅲ级,分别代表轻、中、重度,其中Ⅰ级20例,Ⅱ级33例,Ⅲ级43例。随机选择同期在本院体检的健康者80名(设为对照组),其中男39名,女41名,年龄(59.5±9.4)岁。本研究经承德医学院附属医院伦理委员会批准(第CYFYLL2022011号)。
1.2 方法 记录研究对象的性别、年龄、体重指数(body mass index,BMI)、吸烟史、COPD家族史、合并症等一般资料,以及AECOPD患者的病情严重程度、病程、好转时间等临床资料。采集AECOPD患者入院当日清晨空腹肘静脉血5 ml,检测血常规、CRP、PCT、血生化全项及凝血七项;抽取动脉血1 ml进行血气分析。SCOPD患者于就诊当天同条件下检测上述指标(除血气分析外);健康体检者于体检时同条件下检测上述指标(除血气分析外)。采用ABX Pentra60型全自动血细胞分析仪(法国HORIBA ABX公司)检测血常规,记录白细胞(white blood cells,WBC)、中性粒细胞(neutrophils,NEU)、淋巴细胞(lymphocytes,LYM)、血小板(platelets,PLT)计数,计算NLR、PLR;IMMAGE 800特定蛋白分析仪(美国贝克曼库尔特公司)及配套试剂检测CRP;Cobas e602全自动电化学发光免疫分析仪(德国罗氏诊断公司)及配套试剂检测PCT;HITACHI 7600型全自动生化分析仪(日本日立公司)检测血生化全项,记录白蛋白(albumin,ALB)水平;SysmexCS5100全自动凝血分析仪(日本Sysmex公司)检测凝血七项,记录纤维蛋白原(fibrinogen,FIB)水平,计算FAR;AVL COMPACT 3型血气分析机(瑞士AVL公司)进行血气分析,记录动脉血二氧化碳分压(arterial carbon dioxide partial pressure,PaCO2)和动脉血氧分压(arterial oxygen partial pressure,PaO2),计算氧合指数(oxygenation index,PaO2/FiO2)。
1.3 症状好转判断标准 所有AECOPD患者均接受氧疗、抗感染、祛痰、平喘等对症治疗。当患者自觉呼吸困难及咳嗽、咳痰表现较急性加重期明显减轻并保持24 h以上,查体肺部哮鸣音和(或)湿啰音减少判定为症状好转[14]。
1.4 AECOPD患者FAR、NLR、PLR与临床病理参数的相关性分析 将FAR、NLR、PLR分别与疾病严重程度、病程、好转时间,以及各临床病理参数(CRP、PCT、WBC、NEU、LYM、PLT、FIB、ALB、PaCO2、PaO2/FiO2)进行双变量相关性分析,其中符合正态分布的连续变量应用Pearson相关分析,非正态或等级资料变量应用Spearman相关分析。P<0.01为差异有统计学意义。
1.5 COPD急性加重的影响因素分析 采用二分类logistic回归模型分析COPD急性加重的影响因素,检验水准为0.05。
1.6 FAR、NLR、PLR单项及联合预测COPD急性加重的价值 采用受试者工作特征(receiver operating characteristic,ROC)曲线分析FAR、NLR、PLR单项及联合应用对COPD急性加重的预测价值。不同预测方法AUC的比较采用De-long检验,检验水准为0.05。
1.7 统计学处理 采用SPSS 26.0软件进行统计分析。符合正态分布的计量资料以±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用Bonferroni法;非正态分布的计量资料以M(IQR)表示,两组间比较采用Mann-WhitneyU检验,多组间比较采用Kruskal-WallisH检验,进一步两两比较采用Nemenyi检验。计数资料以例(%)表示,两组间比较采用Pearsonχ2检验,多组间比较采用R×C列联表χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 三组一般资料比较 AECOPD组、SCOPD组与对照组性别、年龄、BMI、吸烟史、COPD家族史、合并症差异无统计学意义(P>0.05,表1)。
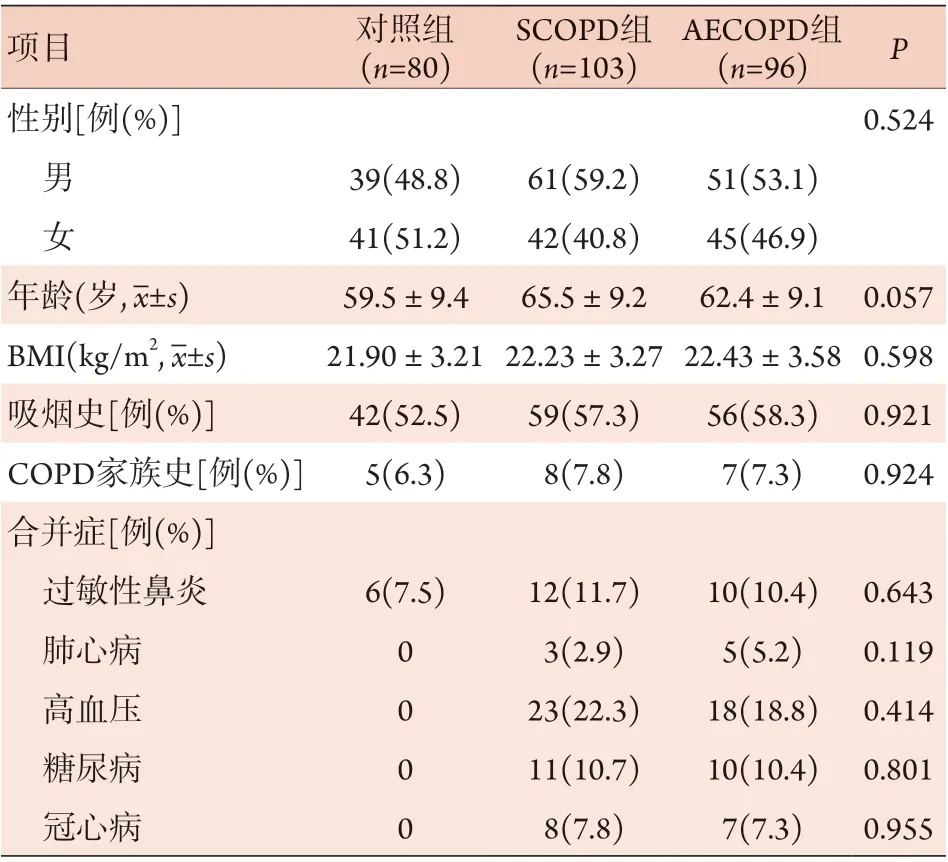
表1 AECOPD组、SCOPD组、对照组一般资料比较Tab.1 Comparison of the general data among AECOPD group, SCOPD group and control group
2.2 三组临床病理参数及FAR、NLR、PLR比较
与对照组比较,AECOPD组、SCOPD组CRP、PCT、WBC、NEU水平及NLR、PLR、FAR升高,差异有统计学意义(P<0.05);与AECOPD组比较,SCOPD组CRP、PCT、WBC、NEU、PLT、FIB水平及NLR、PLR、FAR降低,LYM、ALB水平升高,差异有统计学意义(P<0.05) (表2)。
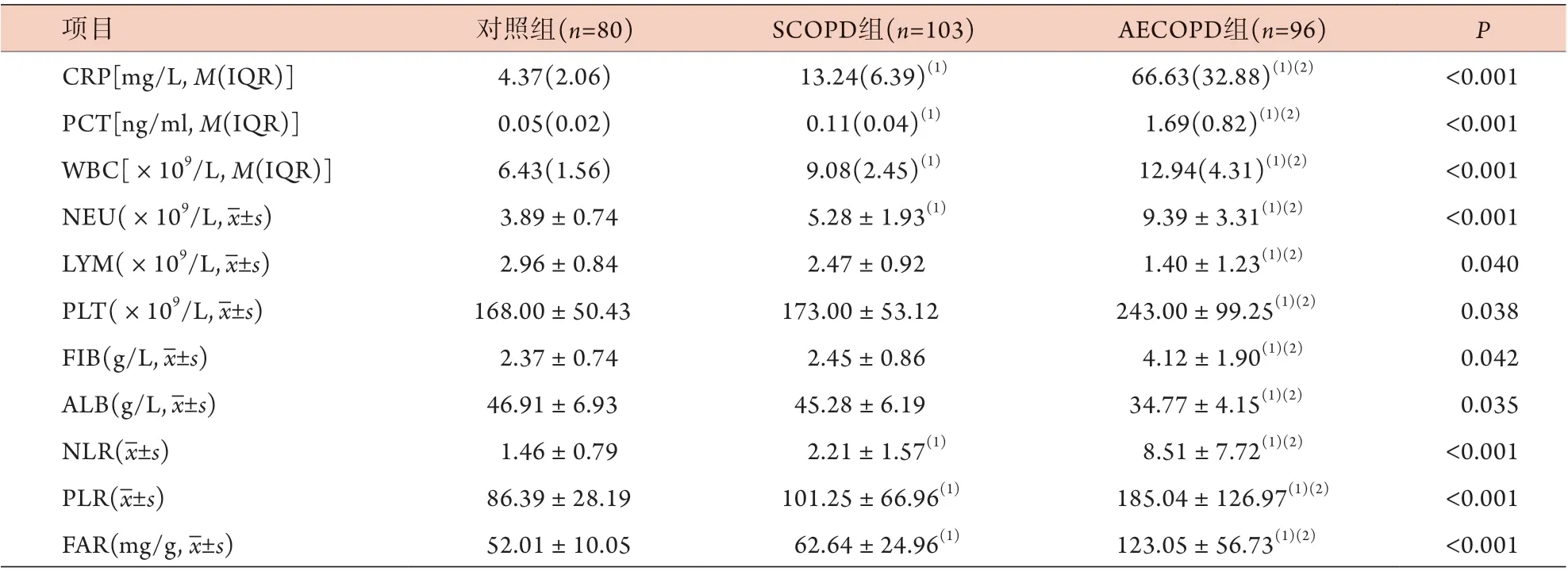
表2 AECOPD组、SCOPD组、对照组临床病理参数及FAR、NLR、PLR比较Tab.2 Comparison of the clinical pathological parameters, FAR, NLR and PLR among AECOPD group, SCOPD group and control group
2.3 AECOPD不同临床分级患者临床病理参数及FAR、NLR、PLR比较 AECOPD Ⅰ、Ⅱ、Ⅲ级患者的性别、年龄、病程差异无统计学意义(P>0.05)。随着AECOPD严重程度的增加,患者好转时间,CRP、PCT、WBC、NEU水平,以及NLR、PLR、FAR、PaCO2逐渐升高,PaO2/FiO2逐渐降低,差异有统计学意义(P<0.05) (表3)。
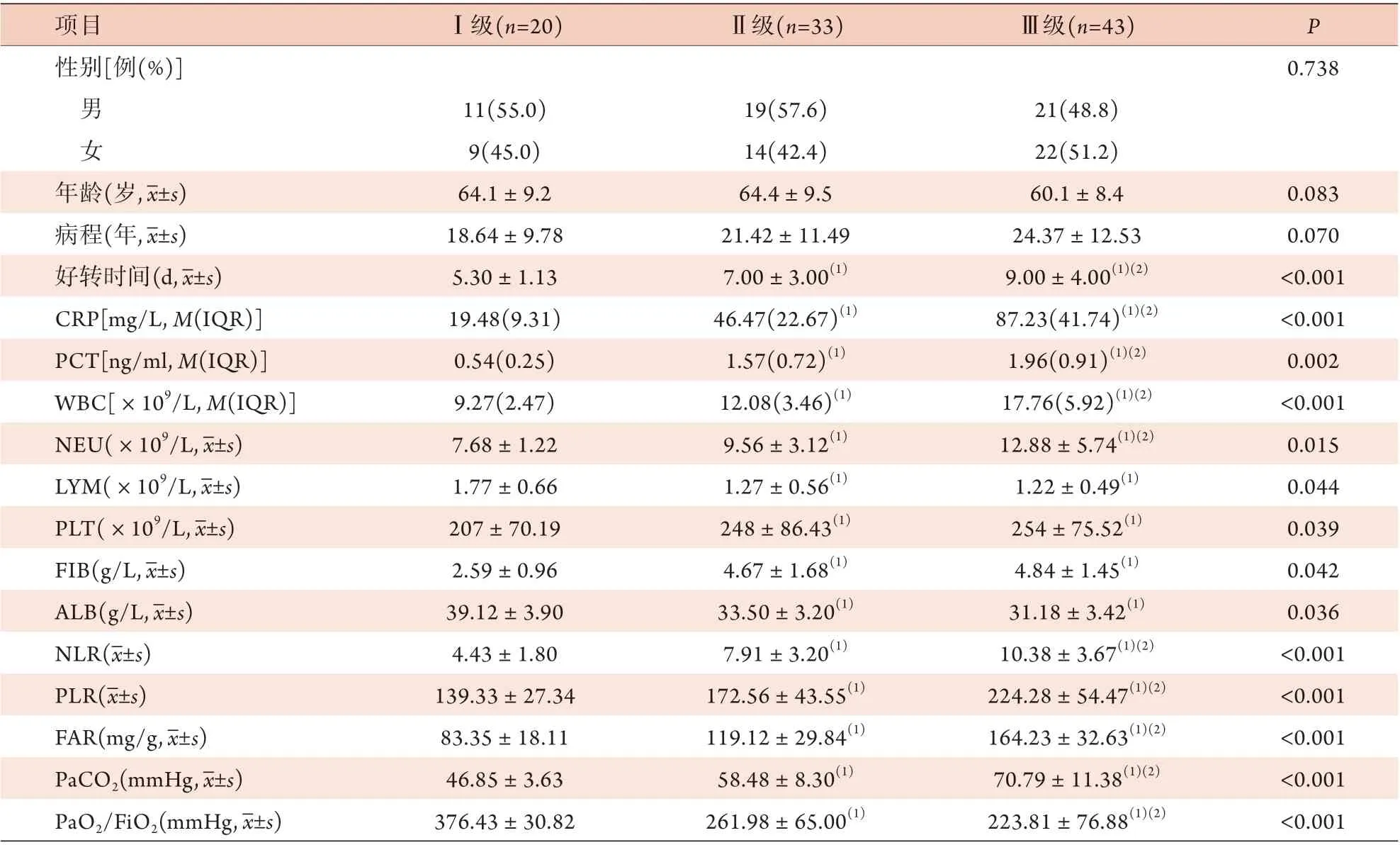
表3 AECOPD不同临床分级患者临床病理参数及FAR、NLR、PLR比较Tab.3 Comparison of the clinical pathological parameters, FAR, NLR and PLR in different clinical grades of AECOPD patients
2.4 AECOPD患者FAR、NLR、PLR与临床病理参数的相关性分析 Pearson或Spearman相关分析显示,FAR与疾病严重程度、好转时间、CRP、PCT、WBC、NEU、PaCO2呈正相关(P<0.01),与LYM、PaO2/FiO2呈负相关(P<0.01),与病程、PLT无相关性(P>0.01)。NLR与疾病严重程度、好转时间、CRP、PCT、WBC、FIB、PaCO2呈正相关(P<0.01),与ALB、PaO2/FiO2呈负相关(P<0.01),与病程、PLT无相关性(P>0.01)。PLR与疾病严重程度、好转时间、CRP、PCT、WBC、NEU、FIB、PaCO2呈正相关(P<0.01),与ALB、PaO2/FiO2呈负相关(P<0.01),与病程无相关性(P>0.01) (表4)。
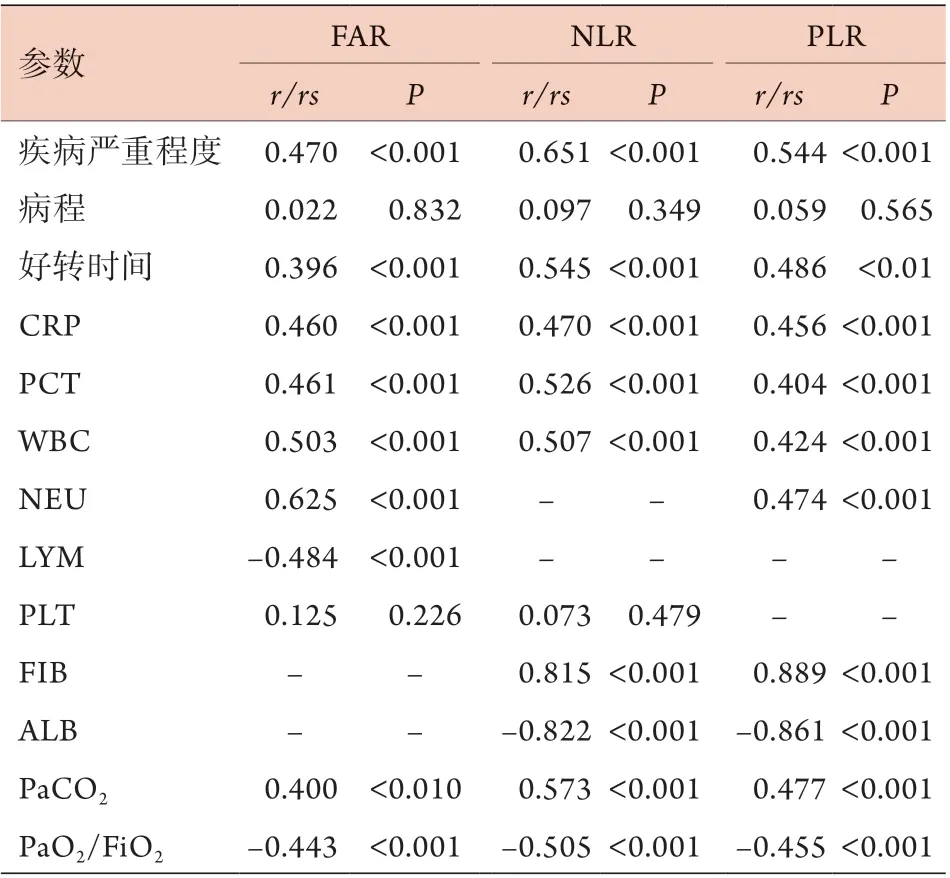
表4 AECOPD患者FAR、NLR、PLR与临床病理参数的相关性分析Tab.4 Correlation analysis of FAR, NLR and PLR with clinical pathological parameters in AECOPD patients
2.5 COPD急性加重的影响因素分析 以COPD患者是否发生急性加重作为因变量(0=否,1=是),经过共线性诊断,将可能影响COPD急性加重的因素(性别、年龄、BMI、吸烟史、COPD家族史、FAR、NLR、PLR)作为自变量纳入二元logistic回归分析,其中分类数据赋值如下:性别(0=女,1=男)、吸烟史(0=无,1=有)、COPD家族史(0=无,1=有)。结果显示,校正性别、年龄、BMI、吸烟史、COPD家族史后,FAR、NLR、PLR是COPD急性加重的独立危险因素(P<0.05)(表5)。
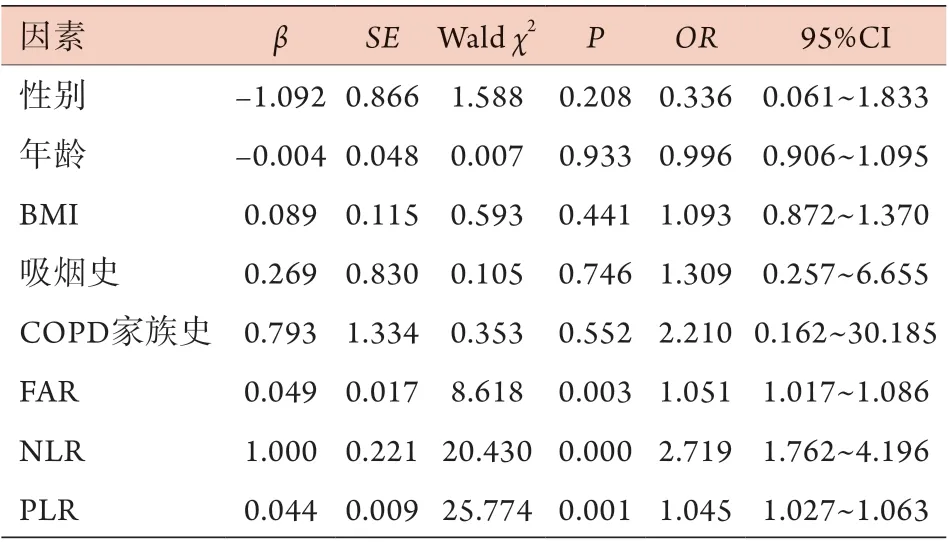
表5 COPD急性加重影响因素的二元logistic回归分析Tab.5 Binary logistic regression analysis of the influencing factors for acute exacerbation of COPD
2.6 FAR、NLR、PLR单项及联合应用对COPD急性加重的预测价值 以二元logistic回归模型建立FAR、NLR、PLR的联合预测因子,并绘制ROC曲线(图1)。结果显示,FAR、NLR、PLR单项及联合应用预测COPD急性加重的ROC曲线下面积(AUC)分别为0.867、0.846、0.738、0.989,敏感度分别为0.990、0.698、0.563、0.958,特异度分别为0.641、0.883、0.932、0.961。FAR、NLR、PLR联合应用对COPD急性加重的预测价值明显优于各指标单独应用(P<0.01,表6)。
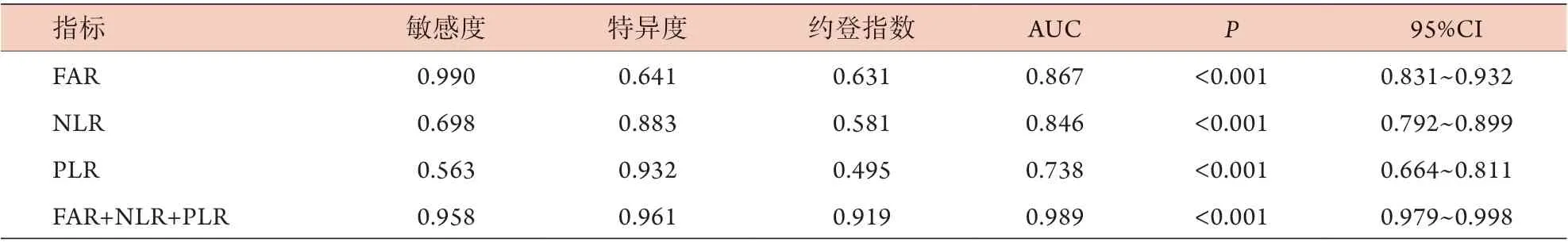
表6 FAR、NLR、PLR单项及联合应用对COPD急性加重的预测价值Tab.6 Predictive value of FAR, NLR, and PLR used alone and combined use in detection of acute exacerbation of COPD
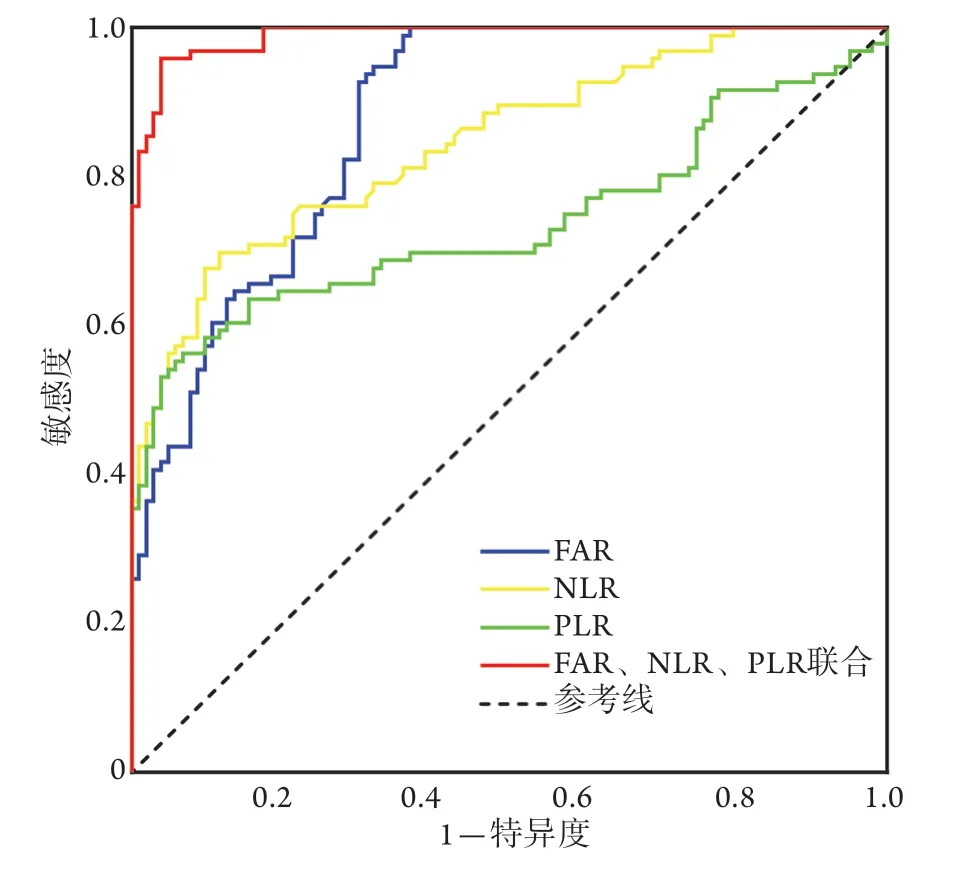
图1 FAR、NLR、PLR单项及联合检测预测COPD急性加重的ROC曲线Fig.1 ROC curve of FAR, NLR, and PLR used alone and combined use in prediction of acute exacerbation of COPD
3 讨 论
慢性炎症是COPD的重要发病机制,涉及各种免疫相关细胞(包括NEU和LYM)的复杂相互作用网络,可能导致持续的气道损伤和肺实质破坏,进而使肺功能及免疫功能降低,长此以往,COPD患者易在各种外在诱因作用下急性发作而导致病情恶化。
AECOPD被定义为患者短期内呼吸困难、咳嗽和(或)咳痰加重,是疾病自然病史的重要组成部分[3]。AECOPD与随后急性加重的风险增加、病理状况和肺功能恶化密切相关[15]。约50%的AECOPD是由细菌和病毒感染触发的,非感染性因素(如环境污染)也可能引起AECOPD的发生[16]。感染作为AECOPD最常见的诱因,同时作为导火索,使机体抗炎与促炎机制之间的平衡被打破,以NEU为主的各种免疫细胞被激活,从而释放活性氧引起一系列级联式炎症反应[17]。此外,活化的NEU可产生其他重要的炎性介质,如蛋白酶(中性粒细胞弹性蛋白酶、组织蛋白酶G、蛋白酶-3)、基质金属蛋白酶及髓过氧化物酶等[18],蛋白酶增多可导致肺实质破坏和肺气肿改变,而活化的NEU产生的细胞因子、酶、黏附分子和生长因子可促使炎性细胞募集至气道并进一步产生促炎因子,从而形成恶性循环[19]。以上病理过程致使局部和全身炎症反应加重,从而加重肺组织及血管损伤,严重者甚至可发生呼吸衰竭,这也是AECOPD患者住院期间病死率增高的常见原因之一。因此,寻找COPD炎症反应的生物标志物有利于判断病情变化及评估预后。
CRP是临床实践中最常用的炎症标志物之一,在炎症反应过程中快速升高,虽然特异度不强,但敏感度较高[20]。既往研究证实,SCOPD患者的CRP水平高于健康人群[21]。CRP是反映COPD病情严重程度及预后的重要生物标志物[22]。PCT作为一种成熟的炎症标志物,较CRP能更好地预测细菌感染[23]。研究发现,PCT有助于指导AECOPD的抗生素使用及预后判断[24-25]。WBC及其亚群是炎症的重要标志物,当机体抗感染机制启动时,某些巨噬细胞释放的细胞因子(如IL-8)作为抗感染的一线防御因子,可刺激造血功能,增加WBC数量[26]。既往研究发现,WBC及NEU与AECOPD患者的病情严重程度和发作频率有关[27-28],是COPD急性加重及死亡的独立预测因子[29]。本研究发现,随着AECOPD病情的加重,CRP、PCT、WBC及NEU水平逐渐增高,SCOPD患者上述指标水平较AECOPD患者更低,表明以上指标均与COPD病情严重程度相关。SCOPD患者CRP、PCT、WBC及NEU水平明显高于对照组,提示SCOPD患者仍存在低级别炎症反应,这种慢性炎症反应可能在COPD发病过程中起着重要作用。
NLR、PLR作为新兴的炎症生物标志物,近年来受到广泛关注,二者均由全血细胞计数衍生而来,具有简单、经济、高效、可广泛使用等优点,在多种疾病(如COPD、心血管疾病、肿瘤、免疫相关疾病等)的治疗、预后评估及风险预测中应用较为广泛。最近,Yao等[30]的回顾性研究发现,NLR和PLR是AECOPD病死率的重要预测指标,NLR与血清CRP水平呈正相关,其预测能力高于CRP和PLR。Xiong等[31]研究发现,NLR和PLR与吸烟指数、COPD分期及改良版英国医学研究委员会呼吸问卷(modified version of British Medical Research Council respiratory questionnaire,mMRC)得分呈正相关,与FEV1呈负相关。Taylan等[32]研究发现,NLR评估AECOPD炎症水平的效能与CRP相当,且其预测早期常规标志物正常患者病情加重的价值较高。本研究发现,NLR、PLR在SCOPD患者中升高,在AECOPD患者中升高更明显,与El-Gazzar等[9]的研究结果一致;在AECOPD不同临床分级患者中,NLR和PLR均有随病情加重而递增的趋势,但目前NLR、PLR与COPD病情加重及气流受限程度相关的确切机制尚不明确,考虑可能是由于病毒和细菌增强了促炎和趋化因子的产生,以及NEU和PLT活化后诱导一系列炎性因子释放,弹性蛋白酶、基质金属蛋白酶等导致肺泡发生结构性改变,从而加重了气道重建及肺实质的炎症。此外,LYM可能影响免疫系统,增加感染和死亡的风险[33]。本研究还发现,NLR、PLR与其他传统的炎症标志物(如CRP、PCT、WBC等)呈正相关,且二者均是COPD急性加重的独立危险因素。
血浆FIB与血清ALB均是与炎症反应相关的急性期蛋白。前者由肝脏产生,其表达水平随着炎症程度加重而增高,因此被认为是一种类似于CRP的正性急性期蛋白[34]。后者也由肝脏产生,但与FIB不同,其表达水平可能因炎症程度加重而降低,因此被归类为类似于转铁蛋白的负性急性期蛋白[34]。FAR是这两个炎症指标的整合,可作为反映全身炎症状态的可靠指标。由于FIB和ALB是凝血系统、营养状况和炎症的关键因素,因此针对FAR的研究已在肿瘤、心血管疾病及免疫相关疾病等领域广泛开展。Zhang等[10]的meta分析显示,FAR高的癌症患者预后明显较差,临床进展加快。Duan等[11]发现,FAR可预测急性冠脉综合征患者冠状动脉病变的严重程度。Liu等[12]证实,FAR是强直性脊柱炎疾病活动度的预测因子。本研究中,FAR与AECOPD患者CRP、NLR呈正相关,与既往研究结果一致[35]。此外,本研究还发现,FAR、NLR、PLR分别与AECOPD严重程度,各种炎症指标如PCT、WBC及PaCO2呈正相关,而与PaO2/FiO2呈负相关,表明FAR、NLR、PLR不仅可用于评估AECOPD的炎症水平及严重程度,且与呼吸功能有一定的相关性。分析原因可能是发生AECOPD时肺气肿及肺组织损伤加重,导致肺通气及换气功能障碍,引起缺氧和CO2潴留,从而发生不同程度的低氧血症和高碳酸血症,最终出现呼吸功能障碍。AECOPD组FAR高于SCOPD组及对照组,从侧面反映了AECOPD患者营养状态较差,血液呈高凝状态,发生肺部血栓的可能性较大,这会加快COPD的发展进程,从而导致预后不良。多因素logistic回归分析显示,FAR是COPD急性加重的独立危险因素。ROC曲线分析结果显示,FAR的AUC为0.867(95%CI 0.831~0.932),诊断价值高于NLR和PLR,三者联合的诊断价值明显优于各指标单独应用,表明FAR可作为预测COPD急性加重的有效生物标志物。
作为新兴的综合性生物标志物,FAR、NLR、PLR具有简单性、可用性、经济性和可靠性等优势,可评估各种肿瘤、心血管疾病的预后,并提供最佳治疗方案。在COPD中,FAR、NLR、PLR具有评估炎症程度、预测病情发展的作用,并有助于筛选急性加重风险高的患者,因此,上述指标对于早期制定有效的治疗计划具有不可估量的价值。但本研究为单中心研究,样本量较少,未能明确FAR、NLR、PLR与疾病演变过程及不同治疗措施之间的因果关系;作为COPD的炎症指标,CRP、PCT、WBC不能全面代表COPD患者的炎症状况,更多参数如TNF-α、IL-6、IL-8等未作为参考指标。因此,有必要进行更广泛的前瞻性、多中心临床试验,并对研究对象进行更详细的分层研究,以进一步确认FAR、NLR、PLR在COPD中的应用价值。
综上所述,FAR、NLR、PLR对于COPD有较高的临床意义,有助于评估AECOPD患者的炎症水平、疾病严重程度及呼吸功能,三者均是COPD急性加重的独立危险因素,联合应用对AECOPD具有较高的预测价值。

