miR-132对谷氨酸诱导的PC12细胞损伤的保护作用
廖旺 杨少青 刘重旭 罗皓雨 侯涛 路关超
1广州医科大学附属第二医院神经内科,广州 510260;2陕西省富平县医院神经内科,渭南 711700
卒中是老年人致死、致残的最主要原因之一[1]。缺血性中风更为常见,占所有中风的87%[2]。缺血性中风通常是由血块阻塞脑部动脉引起的。组织血纤维蛋白溶酶原激活剂(tPA)是一种可分解血栓的溶栓药,是美国食品药品监督管理局(FDA)批准的唯一治疗缺血性中风的药物[3]。但是,中风患者必须在中风症状发作后4.5 h 内接受此治疗。在此治疗时间范围之外使用tPA 进行治疗可导致出血性转化,可能对脑造成额外损害[4]。如果患者未在时间窗内到医院就诊,血凝块无法清除则可能导致残疾等卒中后遗症[5]。目前认为,脑缺血后细胞死亡的病理生理机制是由于血流中断,营养物质供应不足,从而触发细胞凋亡、炎症、兴奋性中毒、氧化应激和线粒体功能障碍过程,导致神经元死亡,其中谷氨酸兴奋性毒性是其重要特征。当神经细胞损伤,谷氨酸被大量释放到神经突触间隙,从而导致谷氨酸受体过度激活,进而使钙离子不断向神经元内流,最终引起DNA 损伤以及细胞凋亡等病理过程[6]。近期研究表明,脑缺血发生后,微小RNA(miR)表达谱可发生不同程度改变,这些miR 与炎症、自噬、凋亡和氧化应激均密切相关[7-8]。然而,miR-132 对谷氨酸诱导的神经元损伤是否具有保护作用尚不清楚[9]。2021 年9 月至2022 年3 月,笔者使用PC12 细胞建立了谷氨酸细胞损伤模型,以研究miR-132 对缺血性卒中的保护作用。
材料与方法
1、细胞与试剂
本实验所使用的PC12 细胞购于中国科学院上海细胞库。Lipofectamine 3000 购于美国Invitrogen 公司,实时聚合酶链式反应(real-time PCR)试剂盒购于日本TaKaRa 公司,TRIzol 试剂来于美国Thermo Fisher Scientific 公司,RIPA 细胞裂解液、丙二醛(MDA)、活性氧(ROS)检测试剂盒购于上海碧云天生物科技有限公司,CCK8试剂盒购于南京凯基生物技术有限公司,青霉素、链霉素购于Gibco BRL公司,荧光素酶检测试剂购自Promega 北京生物技术有限公司。流式细胞仪购自美国BD公司。miR-132 mimic(5'-ACCGUGGCUUUCGAUUGUUACU-3'),miR-negative control(NC) of the mimic(5'-CAGGUAAUCAACGCGGAGGUCA-3')。
2、RNA表达检测
收集细胞,采用TRIzol法提取RNA,逆转录成cDNA,使用实时荧光定量PCR 法检测RNA 表达情况。本研究使用的引物序列:hsa-miR-132-3p forward,5'-TGCGCTAACAGTCTACAGCCA-3'及5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGG ATACGACCGACCATG-3';U6-F为5'-GGTCACAGTGAACCGGTC-3',U6-R为5'-AACGCTTCACGAATTTGCGT-3'。
反应参数:90~95 ℃30 s、55 ℃30 s、72 ℃30 s,PCR 进行30 个循环,72 ℃延伸10 min,反应体系为20 μl,以U6 为内参,所得数据采用2-ΔΔCt法进行表达量相对定量分析。
3、细胞活力检测
采用CCK-8 法测定细胞活力。取对数生长期的PC12 细胞,加入DMEM 培养基,接种于96 孔板中(密度为1×105/ml),移 除细胞培养基,使用PBS 洗2 次,分别采用瞬时转染法将miR-132 mimics(浓度分别为200、100、50 nmol/L)及NC mimics(浓度分别为200、100、50 nmol/L)转染入PC12 细胞,转染8 h 后去除转染液,加入1 ml OPTI-MEM 培养基继续培养24 h 及48 h。在荧光显微镜下观察示,转染效率达90%以上,表明转染条件可靠。加入10%CCK8。37 ℃孵育1 h,酶标仪测定光密度值(试验波长为570 nm,参比波长为450 nm)。细胞相对增殖率(%)=[(B-A)/B×100%],A 为miR-132 mimics或NCmimics转染组OD值,B 为对照组OD 值。每个实验重复3 次,每次测量3次。
4、炎症因子检测
采用酶联免疫吸附试验(ELISA)检测炎症因子白细胞介素(IL)-1β、IL-6表达。按上述miR-132 mimics瞬时转染步骤进行瞬时转染,使miR-132 mimics终浓度为200 nmol/L,另设NC mimics 组(终浓度为100 nmol/L)、对照组,胰酶消化各组细胞后加入细胞裂解液(RIPA)50 μl 裂解细胞提取总蛋白,采用Bradford 方法进行蛋白定量。采用SDS-PAGE电泳分离总蛋白,每道孔上样50 μg 总蛋白质,电泳2 h 后,采用湿法转膜至PVDF 膜,将膜用5%脱脂奶粉封闭1 h,4 ℃孵育一抗(1∶1 000 稀释)过夜,次晨采用TBST 漂洗膜,加入辣根过氧化物酶标记的二抗(1∶3 000稀释),37 ℃孵育1 h,ECL 显影,保存图像,以β-actin 为对照,采用Quantity One测光密度值。实验重复3次。
5、统计学方法
采用SPSS 20.0 统计软件。符合正态分布的计量资料数据以()表示,多组间比较采用LSD-t 检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
结果
1、谷氨酸处理后PC12细胞miR-132表达变化
使用谷氨酸处理后PC12 细胞后,谷氨酸组相对于对照组表达明显下调(P<0.05),表达空载体NC mimics 之后,miR-132 无明显改变,转染miR-132 mimics 后,miR-132 表达相对于对照组明显上调(P<0.05)。见图1。
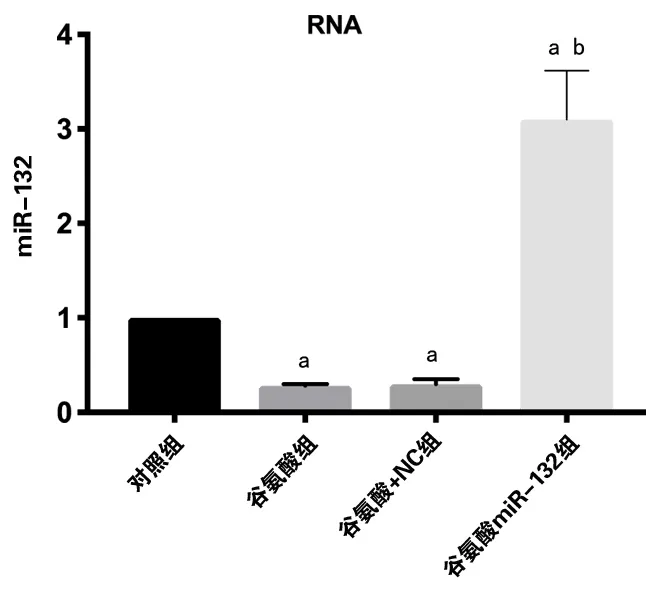
图1 使用谷氨酸处理后PC12 细胞后miR-132 的相对表达量
2、谷氨酸对PC12细胞活力的影响
CCK8检测结果显示,与0mM组相比,PC12细胞存活率随着谷氨酸浓度(0、0.05、0.10、0.20、0.50、1.00、2.00、5.00 mM)增高而降低,呈一定的浓度依赖性。当谷氨酸浓度为2.00 mM 时,PC12 细胞存活率为(48.02±5.24)%,显著低于0 mM 组(P<0.01)。因此,选择浓度为2.00 mM 的谷氨酸处理进行后续实验。见图2。

图2 使用谷氨酸处理后PC12细胞后细胞活力变化
3、转染miR-132后PC12细胞活力比较
CCK8 结果显示,与对照组相比,谷氨酸组细胞存活率明显降低(P<0.05),而谷氨酸+miR-132 组细胞存活率较谷氨酸组明显升高(P<0.01),表明miR-132 可明显改善谷氨酸损伤的PC12细胞活性。见图3。

图3 使用谷氨酸处理后PC12细胞后,过表达miR-132后细胞活力变化
4、转染miR-132后PC12细胞氧化应激水平比较
为进一步检测miR-132 对PC12 细胞的保护作用,我们检测了ROS 及MDA 水平。结果显示,与对照组相比,谷氨酸组ROS 水平明显升高(P<0.01),而谷氨酸+miR-132 组较谷氨酸组明显降低(P<0.01),表明miR-132 可明显改善谷氨酸引起的PC12细胞氧化应激损伤。见图4。

图4 使用谷氨酸处理后PC12细胞后ROS(A)及MDA(B)的变化
5、转染miR-132后PC12细胞炎症因子水平比较
为进一步检测miR-132 对PC12 细胞的保护作用,我们检测了炎症因子IL-1β 及IL-6 的水平。结果显示,与对照组相比,谷氨酸组IL-1β 平明显升高(P<0.001),而谷氨酸+miR-132 组炎症因子表达较谷氨酸组明显降低(P<0.01),同时,谷氨酸组IL-6 水平明显升高(P<0.001),而谷氨酸+miR-132 组炎症因子表达较谷氨酸组明显降低(P<0.001),表明miR-132 可明显改善谷氨酸引起的PC12 细胞的炎性反应。见图5。

图5 使用谷氨酸处理后PC12细胞后IL-6(A)、IL-1β(B)水平的变化
讨论
miR 是长20~24 个核苷酸的小非蛋白质编码RNA,可通过碱基配对识别信使RNA(mRNA)的3'非翻译区(3'-UTR),影响mRNA 稳定性或干扰蛋白质翻译,从而调节下游靶向基因的表达,影响许多生理和病理过程[10]。此外,miR 分泌到体液中,或可作为新型诊断、预后和治疗生物标志物[11]。目前,血液中的miR 在脑卒中及神经细胞保护等方面的作用仍有待研究。
越来越多的证据表明,例如卒中后的细胞增殖、造血、代谢及免疫功能。最新研究显示,卒中后患者miR 表达异常,miR 是缺血性卒中的病因和病理方面的关键介体。循环中的miR 不仅可监测治疗过程中的反应,同时可帮助判断预后。研究证据表明,卒中患者与健康者相比,循环中各种miR 的水平可能有所不同。最近,有研究表明卒中患者循环中的miR-335 相对于正常人下调。研究指出miR-335 的表达与血浆CaM 呈负相关,而细胞内钙的增加与中风的进展有关[12]。
已有研究表明,miR-132 与细胞增殖、分化、凋亡等生物学过程密切相关。同时也有研究表明,miR-132 在卒中患者中表达上调,但miR-132 是否对卒中后的细胞损伤具有作用未有定论。先前的研究表明,转染miR-132 模拟物增加MAP2 标记的树突突起、Tau 标记的轴突突起和NF200 标记的神经纤维的长度[9]。这些结果表明,miR-132 的上调促进了神经可塑性。为进一步研究miR-132 的神经保护作用,本研究表明,经谷氨酸处理后的PC12 细胞的miR-132 表达明显上调,与此前的报道一致,提示miR-132可能对卒中后的细胞损伤具有重要作用。进一步的数据显示,谷氨酸可使细胞活力下降,而转染miR-132后,PC12细胞的活力得到明显改善。
为研究miR-132 在卒中后细胞损伤的作用机制,我们检测了谷氨酸处理后的炎症因子,结果表明,转染miR-132 后的PC12 细胞,神经炎症因子较谷氨酸组明显下调,提示miR-132 可能是通过改善神经炎症保护卒中后的细胞损伤。
氧化应激在卒中后的神经损伤中具有重要作用[13]。因此,我们检测了谷氨酸处理后的氧化应激水平,结果提示,谷氨酸诱导的氧化应激可被miR-132 减轻。由此提示,miR-132 对卒中后细胞损伤的作用可能与改善氧化应激相关。
综上所述,谷氨酸处理后的miR-132表达量明显降低,同时miR-132 可改善PC12 细胞谷氨酸诱导的氧化应激损伤及神经炎症,从而起到保护PC12神经细胞的作用。
利益冲突所有作者均声明不存在利益冲突

