东北岩高兰提取物对上皮性卵巢癌细胞的凋亡作用及机制探讨
张丽丽 隋红梅 贺凤喜 刘丹丹 李爱峰 李爱华
1聊城市人民医院妇产科,聊城 252000;2聊城市妇幼保健院妇科,聊城 252000;3聊城市东昌府区妇幼保健院妇产科,聊城 252000;4 聊城大学化学化工学院,聊城252000
晚期上皮性卵巢癌具有高复发率、高病死率的特点[1],铂耐药是所有患者的共同归宿,也是主要致死原因[2-3],寻找新的抗肿瘤药物成为亟待解决的问题。东北岩高兰广泛分布于东北大兴安岭地区,富含黄酮,其主要化学成分是二氢查耳酮[4-5],具有抗肿瘤活性[6-7]。前期我们已对东北岩高兰提取物查耳酮成分进行分离纯化,得到5 种单体化合物。本研究旨在探讨东北岩高兰提取物对人上皮性卵巢癌细胞凋亡的影响及其可能的作用机制,为明确东北岩高兰活性成分、开发和利用东北岩高兰的药用价值提供理论依据。
材料与方法
1、材料
1.1、组织标本来源 采集2019 年1 月至2020 年9 月聊城市人民医院进行妇科手术治疗的上皮性卵巢癌患者10 例新鲜肿瘤组织,所有病例患者术前均未接受放化疗等辅助治疗,同时收集10 例因良性疾病切除的正常卵巢组织为对照,将新鲜组织标本在取材后30 min内置入-80 ℃冰箱冻存,每位患者的诊断最终由聊城市人民医院病理科确认。
1.2、细胞来源 上皮性卵巢癌细胞A2780、SKOV3、OVCAR3 来由聊城市人民医院中心实验室,正常卵巢细胞IOSE80购自昆腾公司,货号为H055,ATCC来源。
1.3、药物来源 岩高兰提取物Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ来自聊城大学化工学院,分别为提取物Ⅰ2’,4’,β-三羟基二氢查耳酮、Ⅱ2’-甲氧基-4’-羟基二氢查耳酮、Ⅲ2’,4’-二羟基二氢查耳酮、Ⅳ2',5'-二羟基-3'-甲氧基-4',6'-二甲基二氢查耳酮,Ⅴ4',5'-二羟基-2'-甲氧基-3',6'-二甲基-二氢查耳酮,相关成果已发表论文并申请发明专利[8]。
2、实验方法
2.1、细胞培养 将冻存的上皮性卵巢癌细胞A2780、SKOV3、OVCAR3、正常卵巢上皮细胞IOSE80 在37 ℃水浴,加入5 ml 培养液,1 000 r/min(离心半径为16.8 cm),离心5 min,去上清,加入1 ml 培养液,吹打混匀,加入5 ml 培养液,37 ℃5%CO2培养箱中孵育,次日更换培养液,磷酸盐缓冲液(PBS)冲洗2~3 次,加入5 ml培养液继续培养并传代,后制备单细胞悬液。
2.2、应用CCK-8 法测定细胞活力,筛选岩高兰提取物药物作用浓度 将上皮性卵巢癌细胞SKOV3、OVCAR3、A2780、正常卵巢上皮细胞IOSE80 4 组细胞按5×104/ml 密度接种于96 孔板中,37 ℃5%CO2孵育24 h,将岩高兰提取物Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ用甲醛溶解,按照空白组、溶剂对照组、10 μg/μl、20 μg/μl、40 μg/μl、60 μg/μl、80 μg/μl、100 μg/μl浓度作用于细胞,每个浓度有3 个副孔,分别处理24 h、48 h,后加入100 μl CCK-8(cell counting kit-8)培养液混合液,37℃培养2 h,450 nm 测定各孔的光密度,计算生长抑制率,利用SPSS 22.0 软件进行单因素方差分析,取半抑制浓度(IC50值)。
2.3、细胞凋亡检测 使用Annexin V Binding Apoptosis Assay Kit 试剂盒进行检测。取对数生长期细胞,制备单细胞悬浮液,调整细胞密度为1×105个/ml,37 ℃5% CO2孵化24 h,使细胞贴壁,按照空白组、药物组作用于细胞,37℃5% CO2条件培养24 h,进行细胞计数,使每管中含有1×106个细胞,加入200 μl 的Assay Buffer,混匀,再加入2 μl Annexin V-iFluorTM 488 及100X Propidium Iodide 2 μl,室温避光,孵育30 min,加入200 μl 的Assay Buffer,流式细胞分析仪分析结果。
2.4、实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)检测细胞中Beclin-1、Bcl-2mRNA 的表达情况 取各组细胞,Trizol 法提取细胞总RNA,反转录为cDNA。配制反应体系:包括正反向引物各0.4 μl,cDNA 模板2 μl,PCR Master Mix 10 μl,加双蒸水至总体积20 μl。扩增条件,Stage Ⅰ:预变性95 ℃3 min,Stage Ⅱ:PCR 反应95 ℃3 s,60 ℃30 s,共40 个循环。以GAPDH 为内参基因,ΔCt=Ct(Bcl-2/Beclin-1)-Ct(GAPDH),ΔΔCt=Ct(药 物组)-Ct(空白组),计算Bcl-2/Beclin-1 相对表达量,引物序列见表1。

表1 引物序列
2.5、Western Blot 法检测细胞中Beclin-1、Bcl-2 蛋白的表达情况 取各组细胞,加入RIPA 裂解液,提取各组细胞总蛋白,BCA 法测定蛋白浓度,进行SDS-PAGE 凝胶电泳,转至PVDF 膜上,5%脱脂牛奶室温封闭2 h,加入Bcl-2、Beclin-1 一抗(1︰2 000),Actin(1:5 000)4 ℃孵育过夜,TBST 洗膜,加入HRP 标记的二抗(1︰5 000)室温孵育1 h,TBST洗膜,采用ECL放射自显影,Image J软件分析图像。
3、统计学分析
使用统计软件SPSS 22.0、GraphPad Prism 进行统计学分析,单因素方差分析进行细胞IC50值测定,GraphPad Prism进行作图分析,符合正态分布的计量资料以()表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
结果
1、新鲜上皮性卵巢癌组织中Beclin-1、Bcl-2 基因表达情况
上皮性卵巢癌组织中Bcl-2 mRNA 表达显著高于正常卵巢组织(P<0.01),Beclin-1 mRNA表达低于正常卵巢组织(P<0.01)。表明Bcl-2 基因对于上皮性卵巢癌可能起促癌作用,而Beclin-1基因可能发挥抑癌作用(表2)。
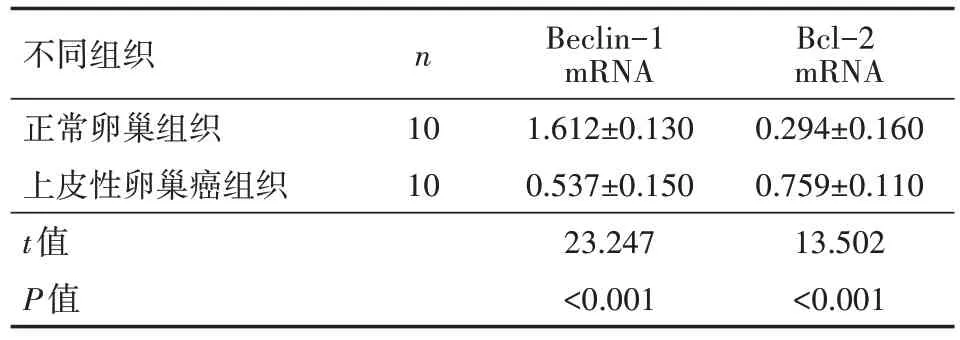
表2 新鲜上皮性卵巢癌组织及正常卵巢组织中的Beclin-1、Bcl-2基因表达情况
2、东北岩高兰提取物药物浓度的筛选
结果显示,东北岩高兰提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ对卵巢癌细胞SKOV3、OVCAR3、A2780 抑制作用显著(P<0.001)(图1),IC50值详见表3,提取物Ⅰ对卵巢癌细胞无增殖及抑制作用。
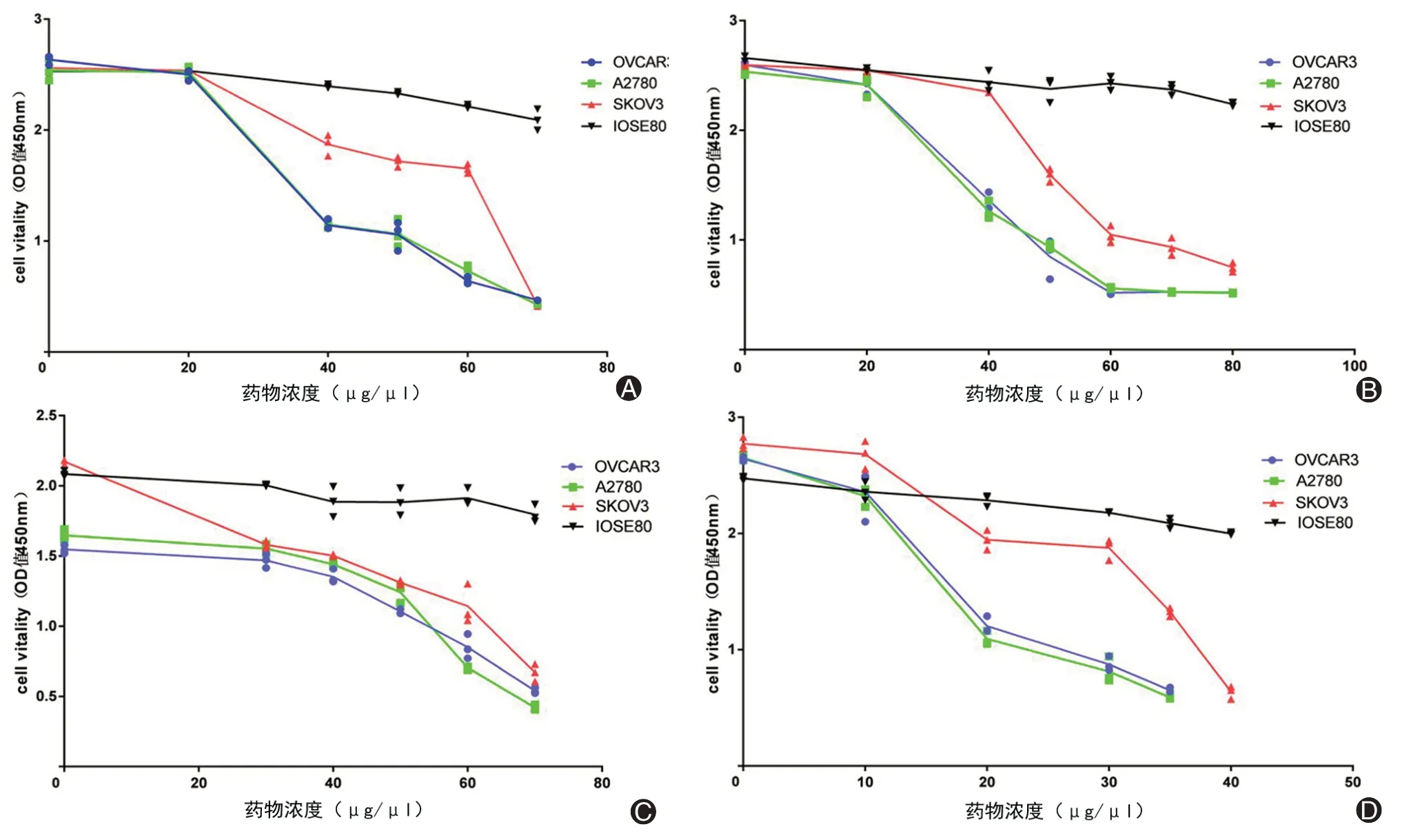
图1 东北岩高兰提取物对上皮性卵巢癌细胞SKOV3、OVCAR3、A2780的抑制作用(A为东北岩高兰提取物Ⅱ,B为东北岩高兰提取物Ⅲ,C为东北岩高兰提取物Ⅳ,D为东北岩高兰提取物Ⅴ)
3、东北岩高兰提取物对上皮性卵巢癌细胞的生长具有抑制作用
经药物处理24 h,OVCAR3 空白组凋亡细胞占1.2%,提取物Ⅱ55 μg/μl、Ⅲ45 μg/μl、Ⅳ65 μg/μl、Ⅴ25 μg/μl 药物组OVCAR3 细胞凋亡率分别为69.6%、54.5%、66.9%、87.6%(P<0.001)。A2780 空白组凋亡细胞占3.2%,提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ药物组A2780 细胞凋亡率分别为58.9%、48.8%、68.6%、73.5%(P<0.01)。SKOV3 空白组凋亡细胞占4.4%,提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ药物组SKOV3 细胞凋亡率分别为52.3%、45.5%、62.9%、47.6%(P<0.01)。结果表明:东北岩高兰提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ对上皮性卵巢癌细胞SKOV3、OVCAR3、A2780 增殖抑制作用显著,呈剂量-时间依赖性,按抑制作用排序为:提取物Ⅴ>Ⅳ>Ⅱ>Ⅲ(图2)。
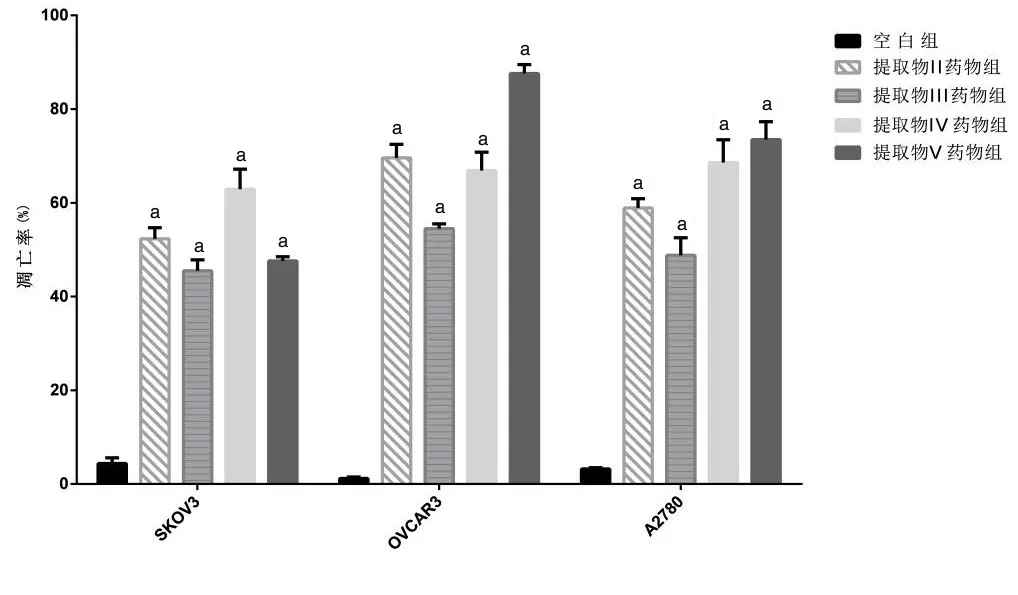
图2 东北岩高兰提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ抑制上皮性卵巢癌细胞SKOV3、OVCAR3、A2780的增殖
4、东北岩高兰提取物对上皮性卵巢癌细胞SKOV3、A2780、OVCAR3中Beclin-1、Bcl-2基因表达的影响
经东北岩高兰提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ处理24 h后,上皮性卵巢癌细胞SKOV3、A2780、OVCAR3 组Beclin-1 mRNA 相对表达量增加,Bcl-2 mRNA 相对表达量降低,差异有统计学意义(P<0.05)。表明Beclin-1 可能在上皮性卵巢癌细胞中起到抑制作用,而Bcl-2基因可能与促进肿瘤细胞增殖有关(图3)。
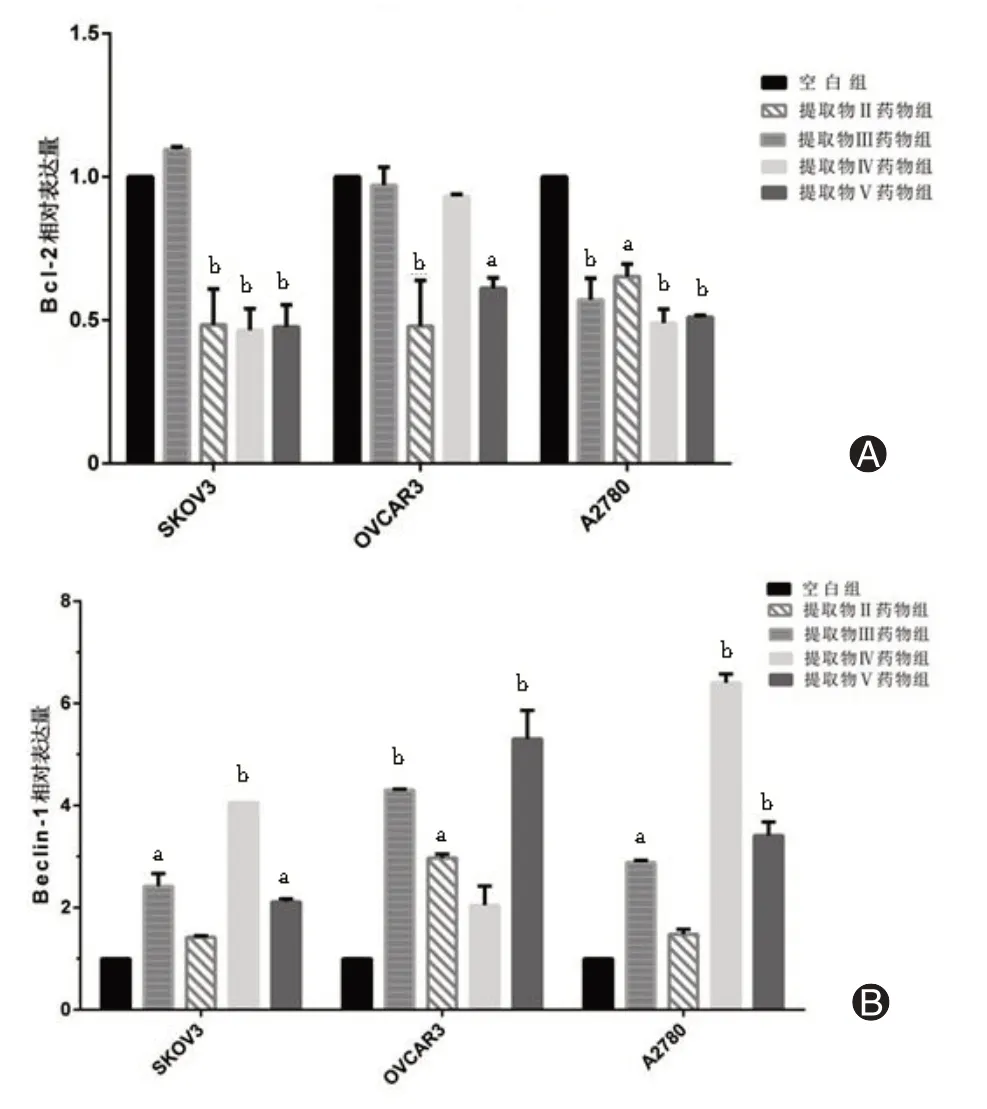
图3 岩高兰提取物对上皮性卵巢癌细胞中Bcl-2(A)、Beclin-1(B)相对表达量的影响
经东北岩高兰提取物处理24 h 后,上皮性卵巢癌细胞SKOV3 中Beclin-1 蛋白表达显著升高(P<0.01),Bcl-2 蛋白表达明显减少(P<0.01)(图4)。
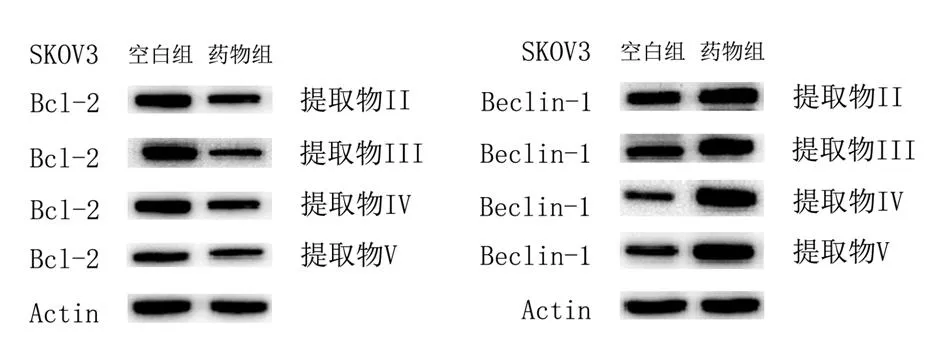
图4 东北岩高兰提取物作用于SKOV3细胞中Bcl-2、Beclin-1蛋白表达情况
讨论
晚期卵巢癌是一个多次复发的“慢性”疾病,70%的卵巢癌患者停止化疗后3 年内复发,大部分卵巢癌患者需要接受二线乃至多线治疗,随着复发次数增加,患者的无进展生存期逐渐缩短,累积的毒性逐渐增加,最终发展为对铂类耐药[1,9-10]。铂耐药患者预后差,NCCN 指南建议加临床试验,化疗多选择非铂药物,总有效率不足20%,中位无进展生存率(PFS)仅3~4 个月,中位总生存时间(OS)不足12个月。
中药有效成分在抗肿瘤方面有独特优势,具有多途径、多靶点、低毒性的特点,开发新型抗肿瘤药物已成为了卵巢癌研究的热点。东北岩高兰广泛分布于东北大兴安岭地区[11],富含黄酮类化合物,其主要活性成分是二氢查耳酮,具有抗肿瘤活性。本课题前期使用AB-8 大孔吸附树脂对东北岩高兰总黄酮进行分离,使用半制备型高效液相色谱对黄酮进行了纯化,得到5 种单体化合物,经核磁共振波谱及质谱分析鉴定为:2’,4’,β-三羟基二氢查耳酮、2’-甲氧基-4’-羟基二氢查耳酮、2’,4’-二羟基二氢查耳酮、2',5'-二羟基-3'-甲氧基-4',6'-二甲基二氢查耳酮、4',5'-二羟基-2'-甲氧基-3',6'-二甲基-二氢查耳酮,相关成果已发表论文并已申请发明专利(一种从东北岩高兰中提取、分离纯化5种查耳酮的方法,专利号:201910261969.7)[8]。
细胞凋亡是细胞程序性死亡的一种主要形式,在调节多细胞生长、发育和维持细胞稳定数量过程中发挥重要作用[12-13],细胞凋亡一但受抑制,就会导致肿瘤的发生和进展[12,14]。抗肿瘤化疗药物诱导凋亡及机制研究是研究者密切关注的热点,也是肿瘤治疗有前途的方向。抗凋亡蛋白Bcl-2是最早发现的参与细胞程序性死亡调控的基因之一,定位于线粒体、内质网及核膜的细胞质面上[15],Bcl-2 在多种肿瘤细胞表达升高,通过抑制细胞程序性死亡,促进癌症的发生[13,16]。本研究发现上皮性卵巢癌组织中Bcl-2 基因表达水平升高,进一步验证了Bcl-2基因的促癌作用[13]。
细胞凋亡是当前生命科学中引人注目的研究热点,以细胞凋亡为靶点,借助分子生物学技术,深化中医药抗肿瘤研究,阐述其抗肿瘤作用机理,具有非常重要的意义。本研究应用CCK-8法测定细胞活力,筛选药物浓度,研究东北岩高兰提取物对上皮性卵巢癌细胞SKOV3、OVCAR3、A2780 的增殖抑制作用,结果显示:提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ对卵巢癌细胞SKOV3、OVCAR3、A2780抑制作用显著,而提取物Ⅰ无增殖抑制作用;进而确定了提取物IC50值,在此药物浓度作用下,采取流式细胞学检测细胞凋亡率,发现东北岩高兰提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ对上皮性卵巢癌细胞SKOV3、OVCAR3、A2780 增殖抑制作用显著,呈剂量-时间依赖性,其抑制作用排序如下:提取物Ⅴ>Ⅳ>Ⅱ>Ⅲ。可见,东北岩高兰提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ通过促进细胞凋亡发挥抗肿瘤细胞增殖作用,进一步证明了二氢查耳酮的抗肿瘤作用,为开发东北岩高兰抗肿瘤药用价值提供依据。
细胞自噬又称Ⅱ型程序性细胞死亡[17],是指细胞在外界环境因素的影响下,利用溶酶体降解自身受损、变性或衰老的大分子物质以及细胞器的自我消化过程[13]。自噬是一把双刃剑,具有保护和破坏作用,一方面通过溶酶体途径去除受损的细胞器、有毒代谢物和病原体,并产生能量维持细胞的生存,另一方面,细胞内重要成分的过度自我消化和降解会导致细胞死亡[16]。细胞自噬与肿瘤的关系非常密切,在肿瘤发生发展过程中也扮演双重角色,在肿瘤初期阶段,细胞自噬可以抑制肿瘤的发生,随着肿瘤进展,自噬可促进肿瘤细胞增殖、抑制凋亡、并可促进肿瘤细胞转移,同时还通过促血管生成促进肿瘤细胞生长[12,14]。Beclin-1是第1个被发现参与自噬过程的基因,定位于人类第17q21 号染色体,在自噬中发挥核心作用[17],编码Beclin-1 蛋白,是启动自噬体形成的必需蛋白,可作为支架,通过与其他蛋白质结合,调控自噬前体的形成[12,17],起到类似“平台”的作用。Beclin-1 最初是作为Bcl-2 的交互蛋白被分离出来,含有与Bcl-2 相似的BH3 结构域,Bcl-2 可通过与该结构域影响自噬。本研究结果显示卵巢癌组织中的Beclin-1 基因表达水平显著降低,减弱了自噬活性,论证了Beclin-1 是肿瘤形成的负调节因子,有助于功能性自噬,这与乳腺癌研究结论一致[18-19]。
近年来研究发现Bcl-2 通过与Beclin-1 相互作用发挥抗自噬作用,Beclin-1/Bcl-2 复合物在细胞中起着变阻器功能,Bcl-2不仅通过与含有BH3结构域的促凋亡蛋白结合来抑制细胞凋亡,而且通过与Beclin-1 的BH3 结构域结合,调节生长因子信号,调节自噬。抗凋亡蛋白Bcl-2与自噬蛋白Beclin-1 的相互作用是研究细胞凋亡与自噬机制的潜在靶点。本研究采用Bcl-2、Beclin-1 作为标志物,发现东北岩高兰提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ对上皮性卵巢癌细胞增殖有显著抑制作用,药物组Bcl-2 基因相对表达量降低,说明提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ可能在基因水平调控细胞增殖,诱导细胞凋亡;提取物作用后肿瘤细胞Beclin-1 基因相对表达量升高,提示Beclin-1 基因可能通过参与自噬,加速了细胞凋亡的进程。另外,通过Western Blot 法检测细胞中Bcl-2、Beclin-1 蛋白表达情况,发现药物组卵巢癌细胞SKOV3、A2780、OVCAR3 中Bcl-2 蛋白的表达量降低,Beclin-1 蛋白表达量升高,说明提取物Ⅱ、Ⅲ、Ⅳ、Ⅴ在蛋白质水平同样影响了卵巢癌响细胞的增殖活性,加速了肿瘤细胞的凋亡。可见,Bcl-2/Beclin-1 复合物可能是一个变阻器,通过调节Bcl-2 与Beclin-1 的相互作用,不仅控制细胞自噬水平,而且控制自噬基因依赖性细胞死亡。本研究结果支持东北岩高兰提取物二氢查耳酮单体对于卵巢癌肿瘤细胞的抑制作用。
凋亡和自噬是两种显著不同的细胞死亡形式,两者在形态、生化指标以及调控细胞死亡的过程上存在较大的差异,但两者又不是两个完全独立的过程,在某些情况下相互影响和制约[16]。自噬和凋亡之间存在着3 种不同类型的相互作用,每种类型都对应着特定的细胞类型、刺激和环境。研究发现Bcl-2家族成员是细胞凋亡的关键调节因子,含有4 个(BH1、BH2、BH3、BH4)高度保守的同源结构域,其中BH3域是细胞凋亡相关的关键结构域[16],Bcl-2通过该域与Beclin1 相互作用。Beclin-1 蛋白干预自噬过程的每一个主要步骤,从自噬体形成到自噬体成熟,其中许多效应是通过激活特定的Beclin-1 结合蛋白介导的,同样Beclin-1 含有BH3 同源结构域,是结合抗凋亡Bcl-2 家族成员所必需的,这表明BH3结构域可能是一个共同的结构基序,Bcl-2家族成员通过该结构域识别并双重调节凋亡和自噬分子[14,17]。
Beclin-1 与Bcl-2 蛋白的相互作用可能是相对不稳定、短暂、仅在特定条件下发生,如饥饿可激活c-Jun N 末端激酶JNK1,磷酸化Bcl-2,导致其与Beclin-1 结合能力减弱,引发自噬,而在营养充足的情况下,非磷酸化Bcl-2 与Beclin1 结合加强,阻断自噬;Bcl-2 或Beclin-1 翻译后修饰可以改变Bcl-2–Beclin-1 的相互作用,不仅BH3 肽或蛋白质可以竞争性破坏Bcl-2/Beclin 1 复合体的相互作用,不同的膜锚定受体或其衔接蛋白也可能调节Bcl-2 和Beclin-1 之间的相互作用[14],如死亡相关蛋白激酶(DAPK)可使Beclin1 的BH3 结构域磷酸化,阻碍Beclin1 与Bcl-2 的结合等。所以,自噬可作为凋亡的上游调节因子,直接调控细胞凋亡,通过去除因氧化应激受损的细胞器,或降解变性的大分子物质,为饥饿的细胞提供生存所需要的营养和能量,也可以降解未折叠的蛋白来抑制内质网应激,抑制促凋亡信号的产生,拮抗细胞的凋亡效应。Bcl-2、Beclin-1蛋白之间的作用机制复杂,二者的具体作用机理及相关信号转导通路需要深入研究。
在大多数情况下,化疗诱导的肿瘤细胞自噬是一种促生存反应,可能导致耐药性的发展,同时自噬也可导致细胞死亡,提高治疗效果。寻找易受自噬影响的肿瘤细胞类型,并确定自噬途径对细胞的优势作用,对肿瘤治疗意义重大[9,20]。本研究结果支持东北岩高兰提取物二氢查耳酮单体Ⅱ、Ⅲ、Ⅳ、Ⅴ可抑制肿瘤细胞的增殖,降低Bcl-2 基因和蛋白的表达,升高Beclin-1 基因和蛋白的表达来控制细胞自噬,促进细胞凋亡,达到抑制肿瘤发展的作用,提示抗凋亡蛋白Bcl-2 与自噬蛋白Beclin-1 的相互作用是上皮性卵巢癌治疗的潜在靶点,为开发东北岩高兰抗肿瘤药用价值提供了基础依据。
由于时间及条件限制,仅做了体外实验,未进行体内实验验证,仅研究了Bcl-2、Beclin-1 基因和蛋白的表达水平,其信号通路及其具体作用机制有待于未来进一步深入研究。
利益冲突所有作者均声明不存在利益冲突

