不同雪茄烟品种生长发育对光强的响应差异
任晓春,高华军,张本强,杨锦鹏,余 君,乔保明,杨瑞玮,杨春雷*,马兴华
不同雪茄烟品种生长发育对光强的响应差异
任晓春1,2,高华军3,张本强4,杨锦鹏5,余 君5,乔保明5,杨瑞玮5,杨春雷5*,马兴华1*
(1.中国农业科学院烟草研究所,农业农村部烟草生物学与加工重点实验室,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.中国烟草总公司海南省公司海口雪茄研究所,海口 571100;4.山东中烟工业有限责任公司,济南 250100;5.湖北省烟草科学研究院,武汉 430030)
为明确不同雪茄品种生长发育对光强的响应差异,在室内模拟条件下,以雪茄品种BES NO H382(简称H382)和古引4号为材料,设置高光强[T200,光照强度为200±12µmol/(m2·s)]和低光强[T100,光照强度为100±12 µmol/(m2·s)]两个光强处理,分析了H382和古引4号在叶片形态、生物量、光合特性等方面对光强的响应差异。结果表明,与高光强处理相比,低光强处理下,H382和古引4号叶长分别增加19.8%、8.6%,叶宽分别增加18.1%、9.3%,叶面积分别增加42.1%、15.6%,H382叶片大小对光强变化的响应更敏感。同时,低光强处理下,H382和古引4号的生物量分别降低20.8%、41.8%,叶脉密度分别降低12.4%、9.4%,叶片厚度分别降低15.7%、19.7%,古引4号的生物量和叶片厚度对光强变化的响应更敏感。低光强处理下H382的表观量子效率升高34.4%,最大净光合速率和光补偿点分别降低21.9%、38.0%,而古引4号无显著变化。综上,H382和古引4号均对光强变化有一定的响应,可望通过遮荫等栽培措施调控烟叶生长。
雪茄烟;光强;生长发育;响应差异
雪茄是一种对人体危害较小的卷烟制品[1],近年来其销售量在国际市场上一直保持着上升势头[2]。雪茄由茄衣、茄套和茄芯3部分组成,其中,茄衣占雪茄的比重最小,但是单价最高,在雪茄生产中占有较高的地位。优质的雪茄茄衣要求叶片大小适中、厚度较薄、完整度好、无斑点和孔洞、色泽均匀、组织细密、支脉细而不突、弹性好、拉力强、燃烧性好[3]。目前我国生产的雪茄茄衣存在着叶片厚、组织粗糙、支脉粗大、色泽不均等问题[4],茄衣生产水平整体偏低,缺乏优质的雪茄原料[5],优质茄衣生产已成为制约中式雪茄发展的瓶颈问题。
遮荫栽培是生产优质雪茄茄衣烟叶的关键技术[6]。林开创[7]研究表明遮荫栽培可提高田间湿度,生产的雪茄茄衣烟叶叶片较薄、组织细腻。赵宇[8]研究表明适度遮荫栽培影响雪茄的光合作用及生长发育,增加叶长和叶宽,减小叶片厚度,是解决目前叶片较厚、组织粗糙等问题的重要技术措施。时向东等[9]研究表明,在雪茄烟遮荫生产中,随着透光率降低,烟株茎变细、叶片变薄、同时株高和叶面积也会发生一定的变化,表现出对环境的适应性。遮荫可降低雪茄茄衣烟叶的净光合速率和水分利用效率、减少光合产物的积累[10]。
虽然前人已经开展了部分遮荫栽培对雪茄茄衣烟叶生长及品质方面的研究,但针对不同雪茄品种生长发育对光强的响应差异研究尚少。BES NO H382引自印度尼西亚,2011年在湖北来凤试种成功,是目前产区种植的主要雪茄品种之一;古引4号引自古巴,是我国首个通过农业评审的雪茄烟品种,在海南、云南等产区均有种植。本研究以BES NO H382和古引4号为研究对象,在控制光强条件下,研究了两个品种在不同光强下的叶片形态、生物量、光合特性等的差异,旨在阐明两个雪茄品种对光强的响应特征及差异,为制定基于品种光响应特征的遮荫栽培技术方案提供理论依据。
1 材料与方法
1.1 试验材料
供试雪茄品种为BES NO H382(简称H382)和古引4号。
1.2 试验设计
本试验于2020年在中国农业科学院烟草研究所青岛即墨试验基地进行。采用托盘育苗方式培育烟苗,待其长至6叶1心时,选取生长健壮、长势均匀一致的烟株移栽至直径为15 cm、装满基质(草炭土∶蛭石∶珍珠岩=3∶1∶1)的塑料花盆中,放置于人工气候室进行光照处理。人工气候室昼夜温度分别为28和23 ℃,相对湿度为(70±5)%,光周期为昼夜14 h/10 h。设置高低2种光强处理,分别为高光强处理(T200):光照强度为200±12 μmol/(m2·s);低光强处理(T100):光照强度为100±12μmol/(m2·s)。采用可升降的LED红蓝光源控制光强,使用光合作用测定仪(LI-6800,LI-COR,美国)测定其有效辐射强度。每品种每处理种植30株,共120株。处理前标记新生叶,用于样品采集和指标测定。除光照外,烟苗生长过程中其他条件保持一致。
1.3 测定项目与方法
1.3.1 形态学指标 待标记的新生叶定长后,每品种选取长势均匀一致的烟株6株,测定标记叶位叶片的叶长、叶宽和叶柄长,并计算长宽比,使用数码相机和Adobe Photoshop CC2019软件[11]测量叶片面积。
1.3.2 生物量 待标记的新生叶定长后,每品种选择长势均匀一致的烟株6株,收获完整植株,水洗去除根部土壤,擦净水分后,根、茎、叶分别称量,记录鲜质量,随后105 ℃杀青30 min,80 ℃烘干至恒重,称取干质量,计算生物量、比叶质量(单位面积叶质量)、叶片含水量和根冠比。
1.3.3 光合特性和光合-光响应曲线 光照处理15 d时,选择所标记叶片,采用便携式光合作用测定系统LI-6800(LI-COR,美国)测定光响应曲线,每品种测定6片标记叶。测定选择红蓝光源,闭合气路,CO2浓度控制为400μmol/(m2·s),叶室温度设置为28 ℃,气体流速为500μmol/s,光照强度从高到低依次设为1800、1500、1200、900、600、300、200、150、100、70、30和0 μmol/(m2·s)。每个光强下稳定120 s后测定净光合速率(n)。根据叶子飘等[12]的双曲线修正模型进行光合拟合。
1.3.4 叶绿素含量 在测定完光合的叶片中部(避开叶脉),用直径为12.5 mm的打孔器打孔,剪成约1 mm宽的细丝,放入盛有5 mL 80%丙酮溶液的试管中,参照舒展等[13]的方法进行测定和计算。
1.3.5 叶脉密度 在叶片中部位置切取约1 cm× 2 cm的小叶块5到6片,放进7% NaOH溶液中煮沸,待叶片褪色直至透明后,用蒸馏水漂洗30 min并移至5% NaClO水溶液中漂白5 min,再放入蒸馏水中30 min,最后置于载玻片上,经0.5%甲苯胺蓝溶液染色3 min后在光学显微镜下观察叶脉并拍照,每个品种每个处理拍摄15个视野。对含有叶脉的照片用Image J软件测量视野中所有叶脉的长度,单位叶面积的叶脉总长度为叶脉密度。
1.3.6 叶片组织结构 取叶片中部约2 cm×4 cm大小(避开叶脉)放入FAA固定液(甲醛∶冰醋酸∶酒精体积比5∶5∶90)中保存。将固定片段用乙醇溶液梯度脱水,石蜡包埋切片,番红(1%)-固绿(0.5%)染色,光学显微镜(LEICA DMC 2900,中国)下观察,并捕获微观图像。用Image J测量叶片上、下表皮厚度,栅栏组织厚度和海绵组织厚度,并计算叶片总厚度以及栅栏组织与海绵组织的比值。
1.4 数据分析与处理
采用Excel 2019和SAS 9.1软件对数据进行统计分析和作图,采用LSD法比较处理间的差异显著性(< 0.05)。
2 结 果
2.1 形态学指标
由表1看出,不同光强下,雪茄品种H382和古引4号在叶片形态上均有明显差异。与高光强相比,低光强处理的H382叶长、叶宽、叶面积和叶柄长分别增加19.8%、18.1%、42.1%、35.7%,差异显著;古引4号叶长、叶宽、叶面积和叶柄长分别增加8.6%、9.3%、15.6%、21.3%。说明降低光强显著促进了叶片的生长,并且H382对低光强的响应更敏感。
2.2 生物量
由表2看出,低光照强度显著降低了H382和古引4号的生物量。H382和古引4号的生物量分配均为叶片>茎>根系,随光强的变化,H382总叶干质量变化最大,古引4号根干质量变化最大。与高光强处理相比,低光强处理的H382根干质量、茎干质量、总叶干质量、单株干质量、比叶质量分别降低21.5%、18.4%、22.0%、20.8%、29.0%,差异显著,根冠比并无显著变化;古引4号的根干质量、茎干质量、总叶干质量、单株干质量、比叶质量、根冠比分别降低52.6%、36.4%、42.0%、41.8%、42.4%、23.1%,差异显著。可见,低光强降低了烟株的生物量,尤其是根系和叶片的生物量。古引4号的变化幅度更大,古引4号的生物合成能力对于光强变化更为敏感。

表1 不同光强处理下两个雪茄品种的叶片形态差异
注:同一栏内不同字母表示在0.05水平差异显著,数据为平均值±标准差,下同。
Note: Different letters indicate significant difference at 0.05 probability level within a column, data are means ±,the same as below.
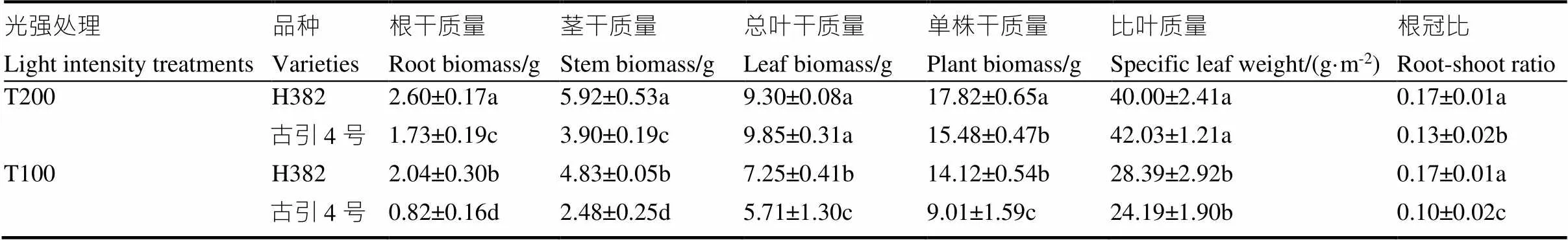
表2 不同光强处理下两个雪茄品种的生物量
2.3 光合特性和光合-光响应曲线
由图1可以看出,不同光强处理下,H382和古引4号光合-光响应曲线也有所不同。当光合有效辐射(PAR)≤300 µmol/(m2·s)时,两个光强处理下的H382和古引4号的净光合速率(n)均随着光合有效辐射(PAR)的增加快速增加;PAR在300~1000 µmol/(m2·s)时,n均随PAR的增加上升幅度逐渐变小;PAR在1000~1800 µmol/(m2·s)时,高光强处理下的古引4号、低光强处理下的古引4号、低光强处理下的H382依次到达光饱和点(表3),随后光合速率逐渐下降,高光强处理下的H382在PAR≤1800 µmol/(m2·s)范围内未达到光饱和点,仍缓慢上升。与高光强处理相比(表3),低光强下,H382的表观量子效率(AQE)升高34.4%,最大净光合效率(max)、光补偿点(LCP)分别降低21.9%、38.0%,差异显著;古引4号无显著差异。说明低光强降低了H382的净光合能力,而古引4号的光合能力更稳定。
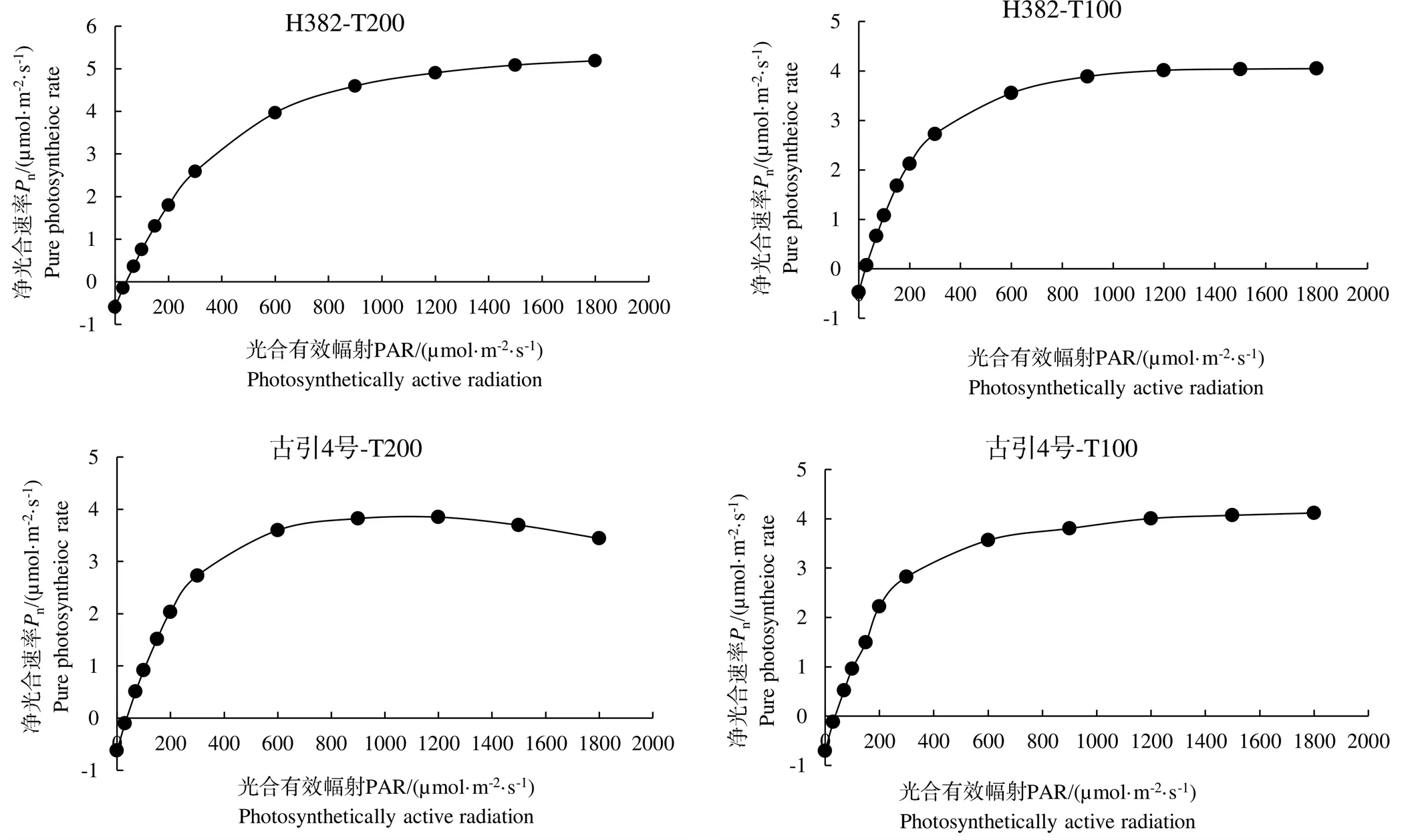
图1 不同光强处理下两个雪茄品种的叶片光合-光响应曲线
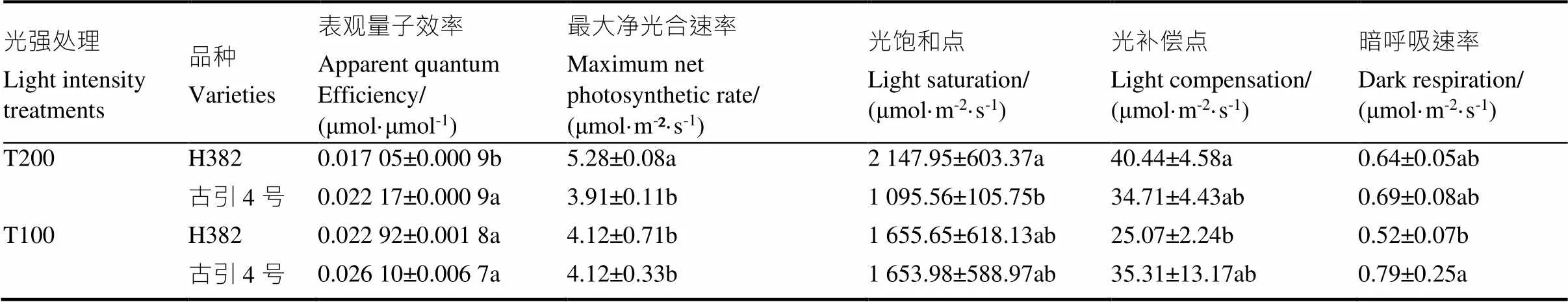
表3 不同光强处理下两个雪茄品种叶片光合生理参数
2.4 叶绿素含量
如表4所示,低光强降低雪茄烟叶片的叶绿素含量。光强降低,H382的叶绿素a和叶绿素b的含量无显著变化,但叶绿素总含量和叶绿素a/b分别显著降低11.7%、7.4%,古引4号的叶绿素含量虽然降低,但无显著差异。
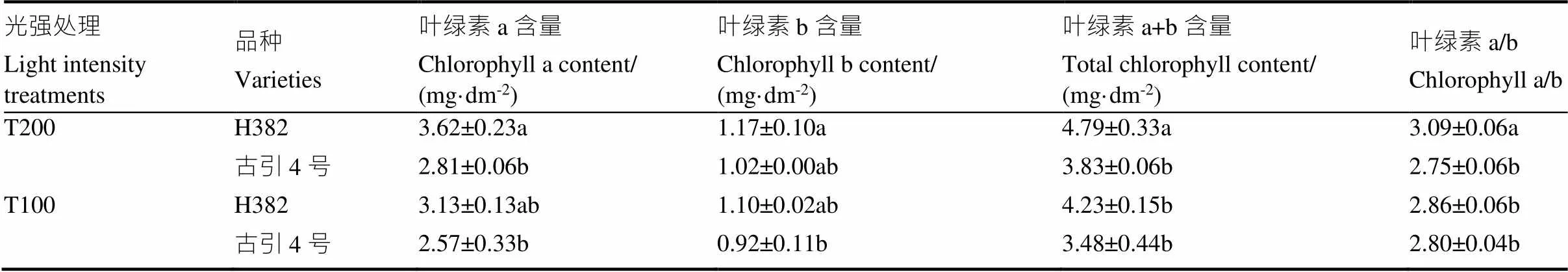
表4 不同光强处理下两个雪茄品种叶片叶绿素含量
2.5 叶脉密度和叶片含水量
光照强度降低导致H382和古引4号叶脉密度显著降低,叶片含水量显著升高(图2、表5)。与高光强处理相比,低光强处理使H382和古引4号的叶脉密度分别降低12.4%、9.4%,差异显著;叶片含水量升高4.7%、5.7%,差异显著。H382叶脉密度对光的响应更敏感,古引4号叶片含水量对光的响应更敏感。
2.6 叶片组织结构
从表6可以看到,高光强下,古引4号的叶片厚度、上下表皮厚度和海绵组织厚度均显著高于H382。与高光强相比,低光强下H382叶片厚度、上表皮厚度、下表皮厚度、海绵组织厚度、栅栏组织厚度分别显著降低15.7%、5.7%、5.3%、13.3%、10.9%,古引4号叶片厚度、上表皮厚度、下表皮厚度、海绵组织厚度、栅栏组织厚度分别显著降低19.7%、12.8%、6.8%、17.0%、12.6%,可见低光强使H382和古引4号叶片厚度显著降低(图3),且古引4号的各组织厚度对光强的响应更敏感,降低幅度更大。但低光强下古引4号下表皮厚度、海绵组织厚度及叶片厚度仍均显著大于H382。
3 讨 论
植物叶片是具有可塑性的器官,光是影响植物叶片形态、解剖结构及光合生理特性的重要因素[14]。叶片通过增加叶面积的方式来捕获更多的光能以适应低光强环境。本研究结果显示,随光照强度降低,H382和古引4号的叶长、叶宽、叶面积均有所增加,这与吴晓颖等[15]的研究结果一致,说明H382和古引4号可以通过自身的调节适应周围光环境的变化。H382的叶面积增加幅度及低光强下的叶面积均大于古引4号(表1),说明低光强促进了H382和古引4号在基-顶轴向、中-边轴向的细胞分裂和扩张[16-17],而且其对H382的促进作用强于古引4号。本研究发现,在低光强下雪茄烟叶片厚度降低,这与文志强[18]的研究一致。光是一种可以诱导叶肉组织发育变化的环境因素,HAN等[19]的研究表明低光强处理通过降低叶片上下表皮、栅栏组织和海绵组织厚度,对叶片厚度产生显著影响。本研究中,低光强处理后,H382和古引4号的海绵组织厚度下降最大,其次为上下表皮厚度和栅栏组织厚度;古引4号的叶片厚度降低幅度大于H382(表6),说明低光强抑制了H382和古引4号在腹-背轴向的细胞分裂和扩张[16-17],而且其对古引4号的抑制作用强于H382。叶脉密度与植物叶片光合速率、水分传导等密切相关,最终影响叶片大小构建[20-21]。本研究中,与高光强处理相比,低光强处理的叶片叶面积增加而叶脉密度降低,主要是由于低光强下,烟株将更多的资源投入到叶面积的构建,由此形成较大的叶片,以获得更多的光资源;而低光强下较低的蒸腾耗水需求,造成了较小的叶脉密度[22]。叶脉密度和叶片大小的关系反映了烟株叶片对外界环境的适应性响应。

表5 不同光强处理下两个雪茄品种叶片叶脉密度和含水量
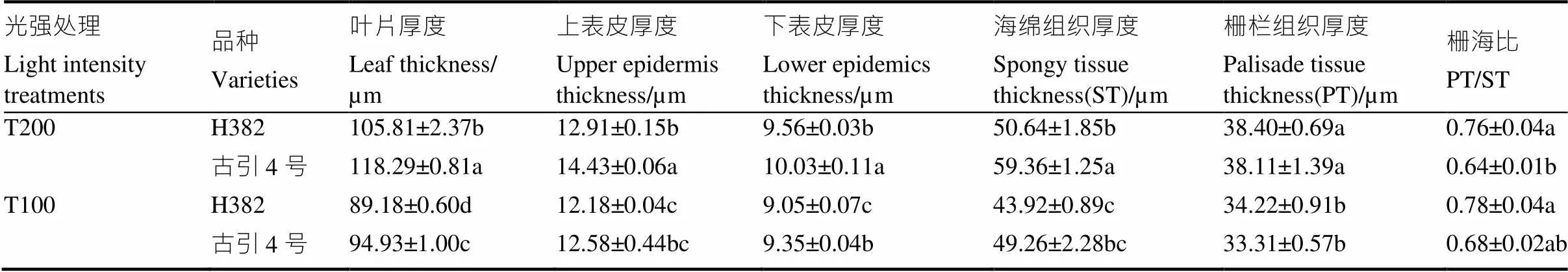
表6 不同光强处理下两个雪茄品种叶片解剖结构
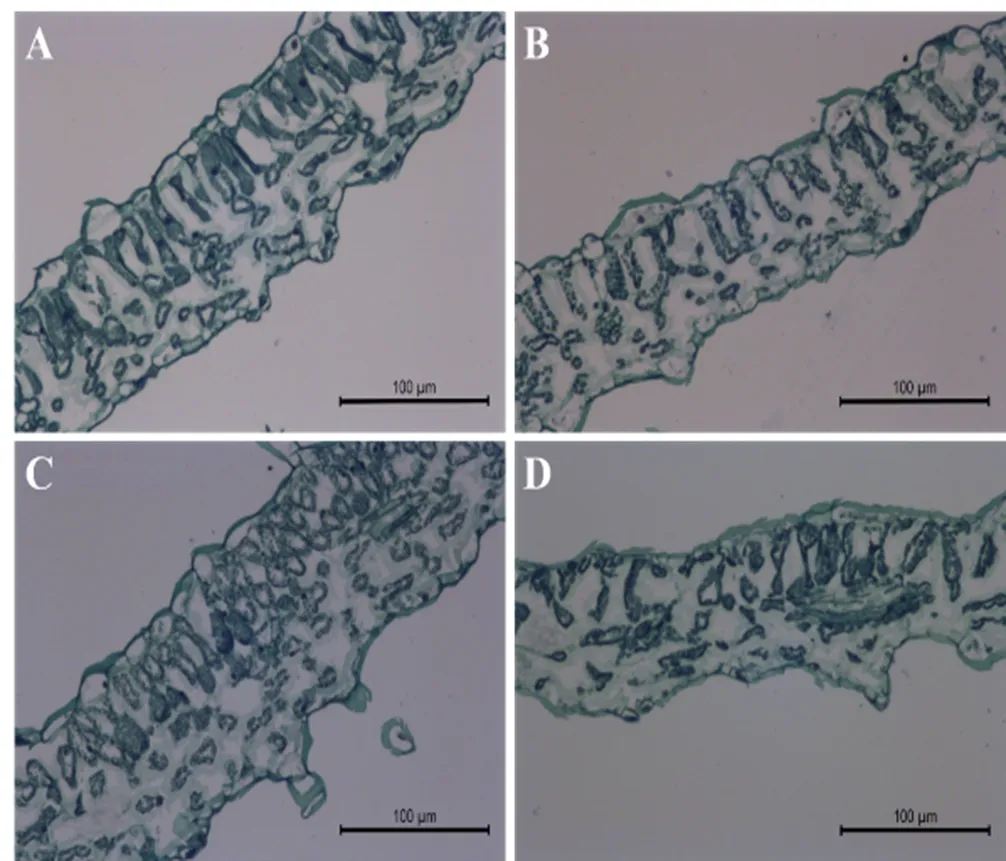
图3 不同光强处理两个雪茄品种的叶片组织结构
植物叶片内的叶绿素由叶绿素a和叶绿素b组成,与光合作用中光能的吸收、传递和转化有关。大多数植物叶片中的叶绿素会对光强的变化做出一定的响应,表现为叶绿素含量和叶绿素a/b的值随光强的降低而降低[23]。在本研究中,随光强降低,H382和叶绿素含量和叶绿素a/b的值均降低,说明低光强限制了叶绿素的合成,这与张其德等[24]的研究一致。古引4号叶绿素含量较为稳定,说明H382的叶绿素合成能力对低光强的响应较古引4号敏感。叶绿素含量的降低将限制光合能力,光合能力与作物产量和品质形成密切相关[25]。已有研究表明,低光强环境下,植物光合能力有所降低[26-27]。本研究中,不同品种雪茄的光合特性对光强响应存在明显差异,低光强处理的H382最大净光合速率(max)和光补偿点(LCP)显著降低,表观量子效率(AQE)显著提高;而古引4号无显著变化。这说明H382的光合能力对光强降低的响应更为敏感。
4 结 论
试验结果表明,与高光强相比,低光强下H382和古引4号的叶柄长、叶片含水量均增加,生物量和叶脉密度均降低,H382叶柄长和叶脉密度变化幅度更大;古引4号叶片含水量和生物量变化幅度更大。H382的光合作用显著降低,而古引4号无显著差异。光强由高转低,H382的叶面积增加幅度大于古引4号,古引4号的叶片厚度降低幅度大于H382。基于两个品种对光强的响应差异,从叶片形态分析,同样的遮荫强度下H382的叶片叶面积更大、叶片更薄。优质茄衣是外观质量、物理特性和内在品质的综合反映,优质茄衣生产适宜的遮荫强度需综合考虑品种特性、烟区气候条件等因素通过田间试验进一步研究确定。
[1] 万德建. 海南雪茄烟杈烟、二茬烟和带茎调制烟叶品质研究[D]. 郑州:河南农业大学,2018.
WAN D J. Study on the quality characteristics of branch leaves and second crop cigars and flue-curing with stalk in Hainan[D]. Zhengzhou: Henan Agricultural University, 2018.
[2] 王浩雅,左兴俊,孙福山,等. 雪茄烟外包叶的研究进展[J]. 中国烟草科学,2009,30(5):71-76.
WANG H Y, ZUO X J, SUN F S, et al. Advance in cigar wrapper tobacco[J]. Chinese Tobacco Science, 2009, 30(5): 71-76.
[3] 邓弋戈,时向东. 雪茄茄衣品种生态适应性及栽培技术研究进展[J]. 江西农业学报,2021,33(1): 60-66.
ZHENG G G, SHI X D. Advances in ecological adaptability and cultivation techniques of cigar-coated varieties [J]. Acta Agriculturae Jiangxi, 2021, 33(1): 60-66.
[4] 时向东,王一恒,崔俊明,等. 雪茄外包皮烟叶品种的比较试验[J]. 烟草科技,2010(8):65-68.
SHI X D, WANG Y H, CUI J M, et al. Comparison test of cigar wrapper tobacco varieties[J]. Tobacco Science & Technology, 2010 (8): 65-68.
[5] 蔡斌,耿召良,高华军,等. 国产雪茄原料生产技术研究现状[J]. 中国烟草学报,2019,25(6):110-119.
CAI B, GENG L C, GAO H J, et al. Production technology of domestic raw material for cigar[J]. Acta Tabacaria Sinica, 2019, 25(6): 110-119.
[6] 王一恒. 雪茄外包皮烟关键栽培技术研究[D]. 郑州:河南农业大学,2011.
WANG Y H. Studies on the key cultivation techniques of cigar wrapper tobacco[D]. Zhengzhou: Henan Agricultural University, 2011.
[7] 林开创. 什邡雪茄外包皮烟叶生产关键技术及其质量特色研究[D]. 郑州:河南农业大学,2013.
LIN K C. Study on key technology and quality characteristics of Shifang cigar wrapper tobacco[D]. Zhengzhou: Henan Agricultural University, 2013.
[8] 赵宇. 雪茄烟遮荫种植研究[J]. 四川农业科技,2017(3):12-14.
ZHAO Y. Study on shade cultivation of cigar[J]. Sichuan Agriculture Science and Technology, 2017(3): 12-14.
[9] 时向东,文志强,刘艳芳,等. 遮荫对雪茄外包皮烟生长和光合特性的影响[J]. 西北植物学报,2006,26(8):1718-1721.
SHI X D, WEN Z Q, LIU Y F, et al. Effects of shading on growth and photosynthetic characteristics of cigar wrapper tobacco[J]. Acta Botanice Boreali-Occidentalia Sinica., 2006, 26(8): 1718-1721.
[10] 时向东,汪文杰,顾会战,等. 遮荫对雪茄外包烟叶光合和水分利用效率日变化的影响[J]. 河南科学,2006,24(5):672-675.
SHI X D, WANG W J, GU H Z et al. Effects of shading on diurnal variation of photosynthesis and water use efficiency of cigar-wrapper tobacco leaves [J]. Henan Science, 2006, 24(5): 672-675.
[11] EASLON H M, BLOOM A J. Easy leaf area: automated digital image analysis for rapid and accurate measurement of leaf area[J]. Applications In Plant Sciences, 2014, 2(7): 1400033.
[12] 叶子飘,王建林. 植物光合-光响应模型的比较分析[J]. 井冈山学院学报,2009,30(4):9-13.
YE Z P, WANG J L. Comparison and analysis of light-response models of plant photosynthesis[J]. Journal of Jinggangshan University, 2009, 30(4): 9-13.
[13] 舒展,张晓素,陈娟,等. 叶绿素含量测定的简化[J]. 植物生理学通讯,2010,46(4):399-402.
SHU Z, ZHANG X S, CHEN J, et al. The simplification of chlorophyll content measurement[J]. Plant Physiology Communications, 2010, 46(4): 399-402.
[14] 游文娟,张庆费,夏檑. 城市绿化植物叶片结构对光强的响应[J]. 西北林学院学报,2008,23(5):22-25.
YOU W J, ZHANG Q F, XIA L. Responses of leaf structure of urban greening plants to different light conditions[J]. Journal of Northwest Forestry University, 2008, 23(5): 22-25.
[15] 吴晓颖,高华军,王晓琳,等. 光照强度对雪茄烟叶片组织结构及内源激素含量的影响[J]. 中国烟草科学,2021,42(2):37-42.
WU X Y, GAO H J, WANG X L, et al. Effects of light intensity on tissue structure and endogenous hormone content in cigar tobacco leaves[J]. Chinese Tobacco Science, 2021, 42(2): 37-42.
[16] 严松,严长杰,顾铭洪. 植物叶发育的分子机理[J]. 遗传,2008,30(9):1127-1135.
YAN S, YAN C J, GU M H. Molecular mechanism of plant leaf development [J]. Hereditas, 2008, 30(9): 1127-1135.
[17] SHWETA K, JOANNA F, TOM B, et al. Three-dimensional patterns of cell division and expansion throughout the development of Arabidopsis thaliana leaves[J]. Journal of Experimental Botany, 2014, 65(22): 6385-6397.
[18] 文志强. 遮荫对雪茄外包皮烟生长发育和生理特性的影响[D]. 郑州:河南农业大学,2007.
WEN Z Q. Effects of shading on growth and physiological characteristics of cigar wrapper tobacco[D]. Zhengzhou: Henan Agricultural University, 2007.
[19] HAN C, YU M, WANG Q, et al. Leaf structure and seed histochemistry analyses provided structural insights into the improved yield and quality of tree peony seed under light shading conditions[J]. Scientific Reports, 2020, 10(1): 4328.
[20] CARINS MURPHY M R, JORDAN G J, BRODRIBB T J. Acclimation to humidity modifies the link between leaf size and the density of veins and stomata[J]. Plant Cell and Environment, 2014, 37(1): 124-131.
[21] SACK L, SCOFFONI C, MCKOWN A D, et al. Developmentally based scaling of leaf venation architecture explains global ecological patterns[J]. Nature Communications, 2012, 3(1): 837.
[22] 徐婷,赵成章,段贝贝,等. 兰州北山刺槐不同等级叶脉密度与叶大小关系的坡向差异性[J]. 生态学杂志,2016,35(1):41-47.
XU T, ZHAO C Z, DUAN B B, et al. Slope-related variations of different levels of vein density and leaf size in Robinia pseudoacacia in the northern mountains of Lanzhou[J]. Chinese Journal of Ecology, 2016, 35 (1): 41-47.
[23] 孙小玲,许岳飞,马鲁沂,等. 植株叶片的光合色素构成对遮阴的响应[J]. 植物生态学报,2010,34(8):989-999.
SUN X L, XU Y F, MA L Y, et al. Photosynthetic pigment composition of plant leaves in response to shading[J]. Chinese Journal of Plant Ecology, 2010, 34(8): 989-999.
[24] 张其德,唐崇钦,林世青,等. 光强度对小麦幼苗光合特性的影响[J]. 植物学报,1988,30(5):508-514.
ZHANG Q D, TANG C Q, LIN S Q, et al. Effects of light intensity on photosynthetic characteristics of wheat seedlings[J]. Acta Botanica Sinica, 1988, 30(5): 508-514.
[25] 战吉宬,黄卫东,王利军. 植物弱光逆境生理研究综述[J]. 植物学通报,2003,20(1):43-50.
ZHAN J C, HUANG W D, WANG L J. Review on physiology of plant under low light stress[J]. Chinese Bulletin of Botany, 2003, 20(1): 43-50.
[26] 程亚娇,范元芳,谌俊旭,等. 光照强度对大豆叶片光合特性及同化物的影响[J]. 作物学报,2018,44(12):1867-1874.
CHENG Y J, FAN Y F, SHEN J X, et al. Effects of light intensity on photosynthetic characteristics and assimilates of soybean leaf[J]. Acta Agronomica Sinica, 2018, 44(12): 1867-1874.
[27] 黄卫东,吴兰坤,战吉成. 中国矮樱桃叶片生长和光合作用对低光强环境的适应性调节[J]. 中国农业科学,2004,37(12):1981-1985.
HUANG W D, WU L K, ZHAN J C. Adaptive regulation of growth and photosynthesis of Chinese dwarf cherry leaves to low light intensity environment[J]. Scientia Agricultura Sinica, 2004, 37(12): 1981-1985.
The Different Response of Growth and Development to Light Intensity in Two Cigar Varieties
REN Xiaochun1,2, GAO Huajun3, ZHANG Benqiang4, YANG Jinpeng5, YU Jun5, QIAO Baoming5, YANG Ruiwei5, YANG Chunlei5*, MA Xinghua1*
(1.Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Key Laboratory of Tobacco Biology and Processing, Ministry of Agriculture and Rural Affairs, Qingdao 266101, China; 2. Graduate School, Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3. Haikou Cigar Research Institute of Hainan Provincial Branch of China National Tobacco Corporation, Haikou 571100, China; 4. China Tobacco Shandong Industrial Co., Ltd., Jinan 250100, China; 5. Tobacco Research Institute of Hubei Province, Wuhan 430030, China)
A laboratory experiment was carried out to clarify the growth and development of two cigar tobacco varieties under different light intensities. The different light intensities were set as higher light intensity T200 [200±12 µmol/(m2·s)] and lower light intensity T100 [100±12 µmol/(m2·s)] and the two cigar tobacco varieties were H382 and Guyin 4. The effects of different light intensities on leaf morphology, biomass, and photosynthetic characteristics of H382 and Guyin 4 were analyzed. The results showed a respective increase of 19.8%, 18.1%, and 42.1% under T100 in leaf length, leaf width, and leaf area, compared with high light intensity. While, the leaf length, leaf width, and leaf area of Guyin 4 showed 8.6%, 9.3%, and 15.6% increment under low light intensity in comparison with high light intensity, respectively. The leaf size of H382 was more sensitive to variation in light intensity. Furthermore, the plant growth diminished under low light intensity with a respective biomass reduction of 20.8% and 41.8% in H382 and Guyin 4. The leaf vein density and leaf thickness (LT) were also decreased by 12.4% and 15.7% in H382 and 9.4% and 19.7% in Guyin 4, respectively, under low light intensity. It was noteworthy that the LT and biomass in H382 was less sensitive to low light intensity than that of Guyin 4. The apparent quantum efficiency of H382 increased by 34.4% while the maximum net photosynthetic efficiency and light compensation point decreased by 21.9% and 38.0%, respectively, but Guyin 4 showed no significant change. In conclusion, H382 and Guyin 4 both responded to the light intensity variation, which was expected to control leaf growth by shading and other cultivation measures.
cigar; light intensity; growth and development; response difference
S572
A
1007-5119(2022)03-0096-07
10.13496/j.issn.1007-5119.2022.03.014
中国农业科学院科技创新工程(ASTIP-TRIC03);中国烟草总公司科技重大专项项目[110202101013(XJ-05)]
任晓春(1998-),女,在读硕士,研究方向为雪茄烟烟叶发育调控。E-mail:renxiaochunw@163.com
,E-mail:杨春雷,ycl193737@163.com;马兴华,maxinghua@caas.cn
2021-09-26
2022-01-18

