基于ESR和比色法的美拉德产物抗氧化活性对比研究
章银良,黄天琪,郭浩彬,王悦,王明雷,陈科宇
(郑州轻工业大学 食品与生物工程学院,郑州 450001)
美拉德反应产物(Maillard reaction products,MRPs)是指美拉德反应(Maillard reaction,MR),即在一定条件下含羰基的碳水化合物与含氨基的氨基酸、多肽或蛋白质之间的两种基团发生缩合反应,形成的棕黑色聚合产物[1-2]。MRPs中含有抗氧化活性的还原酮、呋喃、类黑精等物质[3-5]。在食品加工过程中,合理利用好MRPs的天然抗氧化活性可以极大地提高食品安全性能、食品贮藏期、抗氧化活性等[6-7]。
目前有许多方法与指标已经应用于食品中抗氧化活性的检测,最常用的为通过抗氧化活性物质清除自由基能力来反映食品的抗氧化性强弱[8]。电子自旋共振技术(electron spin resonance,ESR)是一种快速、简单、直接的方法,能以谱图的形式直接反映自由基的种类及数量[9]。研究者们发现选用比色法测定样品的抗氧化活性容易受到样品本身的影响。如臧爽[10]发现,蓝莓、黑布林本身的颜色能影响紫外分光光度计法对于样品抗氧化活性检测的准确性。郭学文等[11]发现,番茄红素与DPPH在517 nm处都具有较强吸收值,使得紫外法所测结果不准确。目前对于MRPs的抗氧化性研究多采用UV法检测,而随着美拉德反应条件的不同,MRPs褐变程度也截然不同[12-13],这一差异极有可能会干扰到我们对于最优条件的判断,因此利用ESR法对MRPs抗氧化活性进行检测并和紫外分光光度计法进行比较有利于我们更好地判断MRPs抗氧化活性能力大小,为深入研究MRPs抗氧化活性提供了参考依据。
1 材料、设备与方法
1.1 试剂与材料
D-核糖(AR)、L-阿拉伯糖(AR)、L-精氨酸(AR)、L-赖氨酸(AR)、L-甘氨酸(AR):北京索莱宝科技有限公司;氢氧化钠(AR)、无水乙醇(AR):天津市永大化学试剂有限公司;盐酸:烟台市双双化工有限公司;1,1-二苯基-2-苦肼基自由基 (DPPH)(AR):进口试剂。
1.2 仪器设备
SQP电子天平 赛多利斯科学仪器(北京)有限公司;E-scan Bruker电子顺磁共振波谱仪 德国布鲁克科技(北京)有限公司;FE20 pH计 瑞士梅特勒-托利多公司;HH-1智能型数显恒温油浴槽、HH-S水浴锅 巩义市予华仪器有限责任公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;Tecan Spark 20M多功能微孔板读数仪 瑞士Tecan公司。
1.3 方法
1.3.1 MRPs的制备
将实验样品依次分为时间组、pH组、温度组和比例组,制备美拉德反应产物的具体操作如下。
1.3.1.1 时间组
准确称量阿拉伯糖和赖氨酸各12.5 g(质量比为1∶1),溶解于450 mL的去离子水中,并分别用4 mol/L的HCl溶液和6 mol/L的NaOH溶液调整pH至10.0,然后用去离子水定容至500 mL,混合均匀。用移液枪吸取10 mL反应液转移至25 mL带盖螺口试管中,密封严实后,置于100 ℃恒温油浴槽中反应20,40,60,80,100,120,140,160,180,200 min。每组反应平行2次,反应结束后快速置于冰水中冷却并进行相关测定,剩余样品置于-20 ℃冰箱中保存备用。
1.3.1.2 pH组
准确称量阿拉伯糖和赖氨酸各1.25 g(质量比为1∶1),溶解于45 mL的去离子水中,并分别用4 mol/L的HCl溶液和6 mol/L的NaOH溶液调整pH至3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0,11.0,12.0,然后用去离子水定容至50 mL,混合均匀。用移液枪吸取10 mL反应液转移至25 mL带盖螺口试管中,密封严实后,置于100 ℃恒温油浴槽中反应1 h,每组反应平行2次。反应结束后快速置于冰水中冷却并进行相关测定,剩余样品置于-20 ℃冰箱中保存备用。
1.3.1.3 温度组
准确称量阿拉伯糖和赖氨酸各12.5 g(质量比为1∶1),溶解于450 mL的去离子水中,并分别用4 mol/L的HCl溶液和6 mol/L的NaOH溶液调整pH至10.0,然后用去离子水定容至500 mL,混合均匀。用移液枪吸取10 mL反应液转移至25 mL带盖螺口试管中,密封严实后,分别置于40,60,80 ℃水浴锅中反应1 h。量取10 mL反应液转移至25 mL带盖螺口试管中,密封严实后,分别置于100,120,140 ℃恒温油浴槽中反应1 h。再取50 mL反应液转移至100 mL圆底烧瓶中,固定冷凝回流装置于160,180,200 ℃恒温油浴槽中反应1 h。反应结束后快速置于冰水中冷却并进行相关测定,每组反应平行2次,剩余样品置于-20 ℃冰箱中保存备用。
1.3.1.4 比例组
准确称量阿拉伯糖和赖氨酸,使它们的质量比分别为1∶1、1∶1.5、1∶2、1∶2.5、1∶3、1.5∶1、2∶1、2.5∶1、3∶1,溶解于45 mL的去离子水中,并分别用4 mol/L的HCl溶液和6 mol/L的NaOH溶液调整pH至10.0,然后用去离子水定容至50 mL,混合均匀。用移液枪吸取10 mL反应液转移至25 mL带盖螺口试管中,密封严实后,置于120 ℃恒温油浴槽中反应1 h。反应结束后快速置于冰水中冷却并进行相关测定,每组反应平行2次,剩余样品置于-20 ℃冰箱中保存备用。
1.3.1.5 种类组
准确称量一种糖(D-阿拉伯糖、D-核糖)和一种氨基酸(L-赖氨酸、L-精氨酸、L-甘氨酸)各1.25 g,溶解于45 mL的去离子水中,并分别用4 mol/L的HCl溶液和6 mol/L的NaOH溶液调整pH至10.0,然后用去离子水定容至50 mL,混合均匀。用移液枪吸取10 mL反应液转移至25 mL带盖螺口试管中,密封严实后,置于100 ℃恒温油浴槽中反应1 h。反应结束后快速置于冰水中冷却并进行相关测定,每组反应平行2次,剩余样品置于-20 ℃冰箱中保存备用。
1.3.2 DPPH自由基清除率的测定
1.3.2.1 ESR法测定MRPs抗氧化活性
吸取0.1 mL MRPs于具塞刻度管中,加入4.9 mL去离子水,配制成50倍稀释液,涡旋振荡。再吸取500 μL MRPs(等量去离子水溶液作为空白对照组)与2 mL 0.35 mmol/L DPPH于棕色具塞试管中振荡,混合均匀。暗反应30 min后,立即放入电子顺磁波谱仪的谐振腔中,待仪器自动调谐完毕后按开始测量。将扫描谱图导入WinEPR-Processing中,对DPPH自由基的ESR谱图进行二重积分(积分区域为(3450±0.01)~(3525±0.01) G),将测量的二重积分值记为As。在相同操作条件下,以0.5 mL去离子水代替0.5 mL稀释后的样品溶液,作为空白组,并记录其二重积分值,记为Ac。美拉德反应产物对DPPH自由基的清除能力可由下式计算得出:
(1)
ESR测定条件:参考李辉等[14]的方法。频率9.792069 GHz,功率5.00 mW,中心磁场3487 G,扫描宽度100 G,调制幅度2.27 G,调制频率86.00 kHz,时间常数40.96,扫描时间83.88 s(20.97 s×4次),横坐标点数512,接收机增益为3.17×103。
1.3.2.2 紫外分光光度计法测定MRPs抗氧化活性
结合周绍琴等[15]、He等[16]的方法。取0.1 mL MRPs于具塞刻度管中,加入4.9 mL去离子水,配制成50倍稀释液,振荡摇匀。再取1 mL MRPs(等量去离子水溶液作为空白对照组)与4 mL 0.1 mmol/L DPPH于棕色具塞试管中振荡,混合均匀。暗反应30 min后,记录其在517 nm处的吸光度值为As。空白组在517 nm处的吸光度值记作Ac。MRPs对DPPH自由基的清除能力可由公式(1)得出。
1.3.2.3 多功能微孔板读数仪(酶标仪)法测定MRPs抗氧化活性
用酶标仪测定空板在517 nm处的OD值,随后吸取0.1 mL MRPs于具塞刻度管中,加入4.9 mL去离子水,配制成50倍稀释液,涡旋振荡。再吸取500 μL MRPs(等量去离子水溶液作为空白对照组)与2 mL 0.35 mmol/L DPPH于棕色具塞试管中振荡,混合均匀。暗反应30 min后,吸取200 μL MRPs加入96孔板内,所测得在517 nm处的OD值减去空板OD值记为As,空白组在517 nm处的OD值减去空板OD值记作Ac。MRPs对DPPH自由基的清除能力可由公式(1)得出。
酶标仪参数:温度25 ℃、波长517 nm、无盖。
1.3.3 MRPs吸光度值测定
取0.1 mL MRPs于具塞刻度管中,加入4.9 mL去离子水,配制成50倍稀释液,振荡摇匀。在517 nm处测量并记录不同条件下MRPs的吸光度值。取不同种类的MRPs稀释50倍,吸取200 μL加入至96孔板,用酶标仪测量不同波长范围下的OD值。
1.3.4 标准曲线建立
以无水乙醇作为溶剂,配制0.1,0.2,0.3,0.4,0.5 mmol/L的DPPH溶液,按照1.3.2.1与1.3.2.3所述方法测量并建立ESR与酶标仪标准曲线。以无水乙醇作为溶剂,配制0.025,0.033,0.05,0.0667,0.075,0.1,0.2,0.3 mmol/L的DPPH溶液,按照1.3.2.2所述方法测量并建立紫外分光光度计标准曲线。
1.3.5 均匀实验因素水平设计
选取阿拉伯糖与赖氨酸组合,以DPPH自由基(DPPH·)清除率为检测指标,应用酶标仪、ESR、紫外分光光度计对其进行抗氧化活性研究,采用 U10×(108)均匀实验表,因素水平见表1。
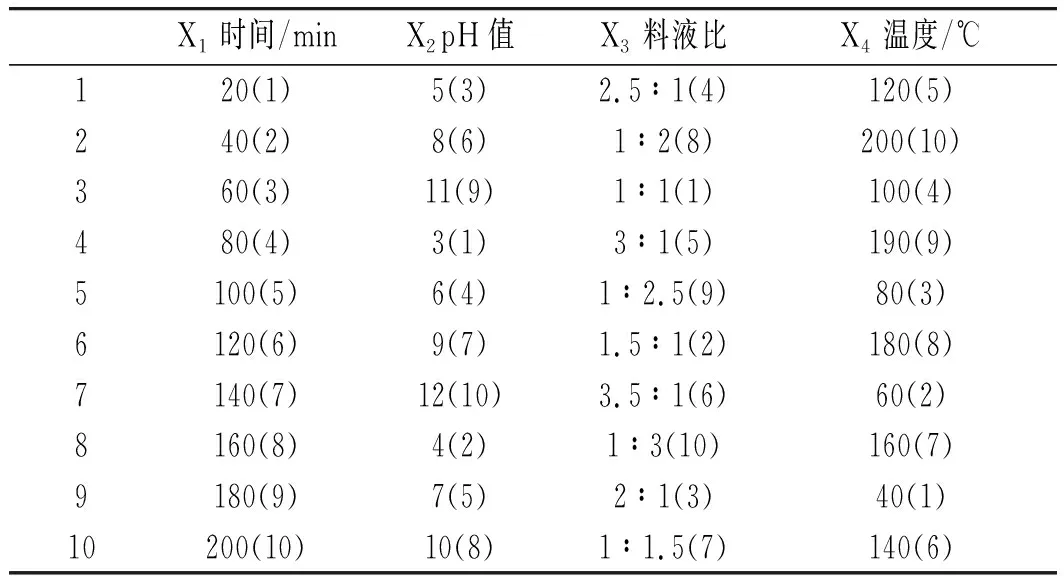
表1 U10×(108)均匀试验因素水平表Table 1 Factors and levels of U10×(108) uniform experiment
1.4 统计分析
所有实验均做3次平行,采用WinEPR-Processing、Origin 8.0、Mathematics 4.0及其相关方法进行处理,并用SPSS软件进行显著性分析(差异显著p<0.05)。
2 结果与讨论
2.1 标准曲线的建立
ESR、酶标仪、紫外分光光度计的标准曲线见图1。

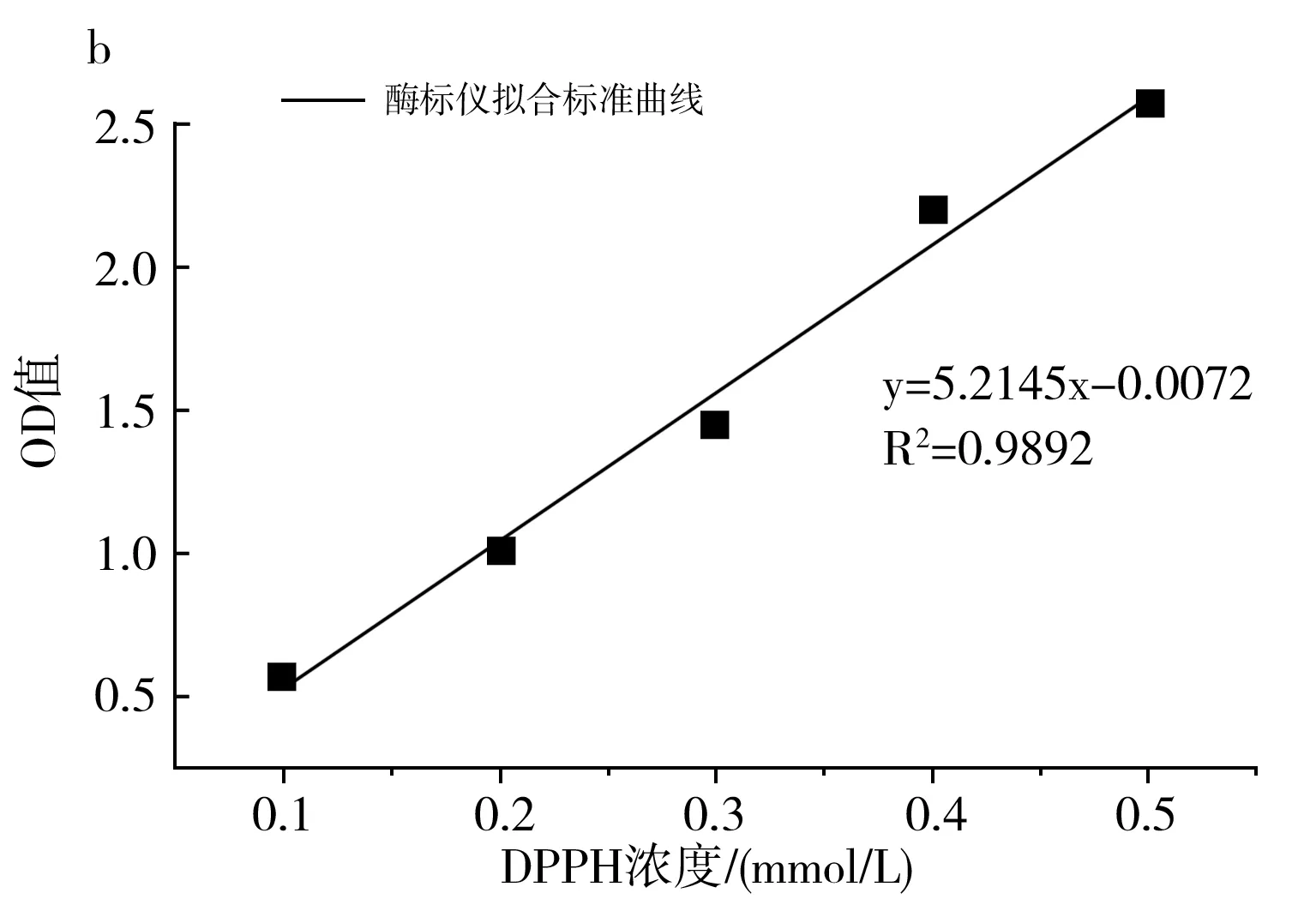
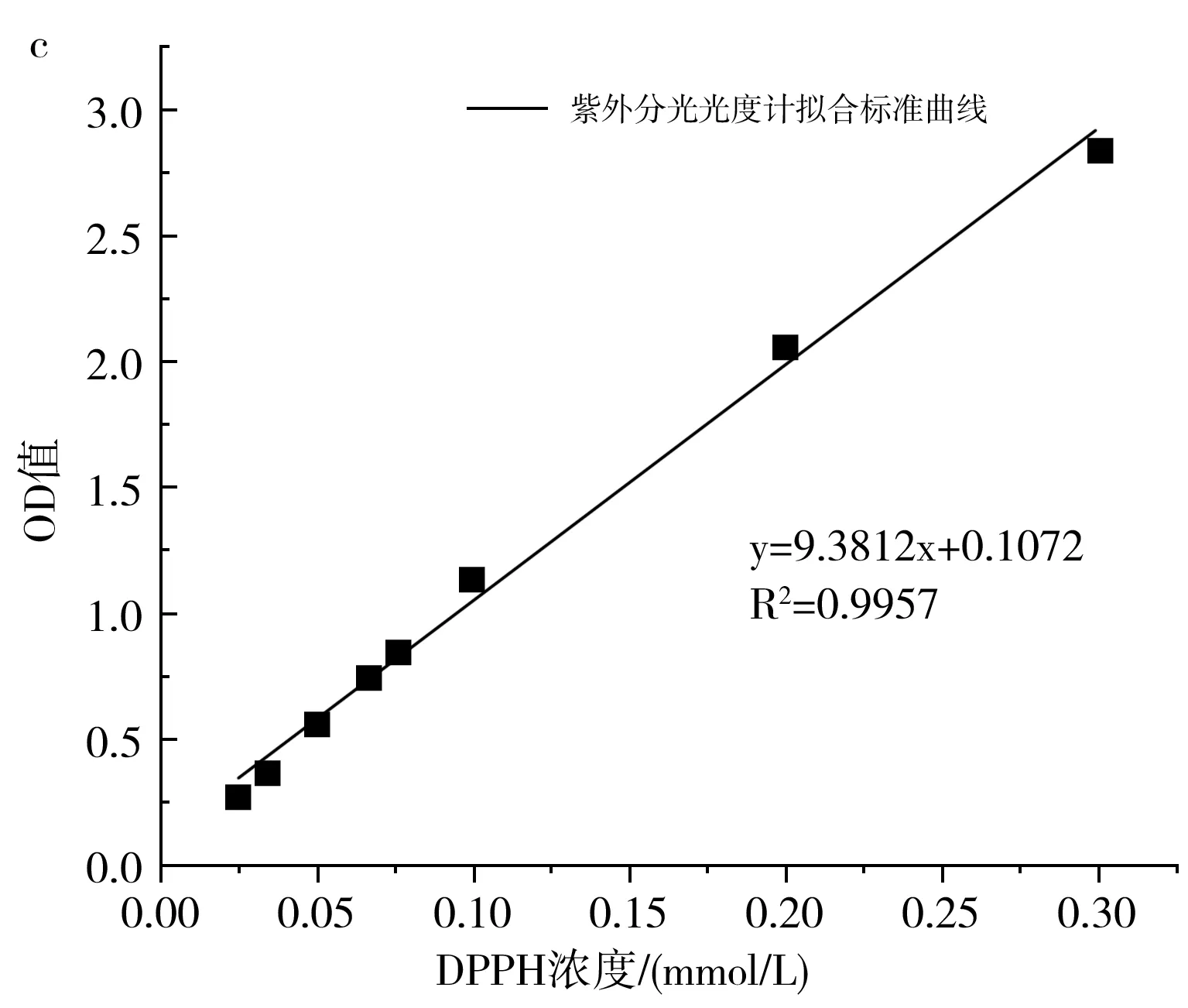
图1 ESR(a)、多功能微孔板读数仪(b)、 紫外分光光度计(c)标准曲线拟合图Fig.1 Standard curve fitting diagrams of ESR (a), multifunctional microporous plate reader (b), UV spectrophotometer (c)
由图1可知,DPPH浓度与ESR的强度和酶标仪、紫外分光光度计的OD值均具有良好的线性关系,3种仪器的相关性系数R2均大于0.98,线性方程依次为y=8.4596x+0.0317(ESR),y=5.2145x-0.0072(酶标仪),y=9.3812x+0.1072(UV)。因此从理论上来说,3种检测仪器均可用于抗氧化活性研究。由图1中b和c可知,紫外分光光度计法的相关系数大于酶标仪法,因此当选取的DPPH浓度较小时,应优先选用紫外分光光度计法测量。
2.2 DPPH·清除率的测定
2.2.1 pH对DPPH·清除率的影响
pH对DPPH·清除率的影响关系图见图2。
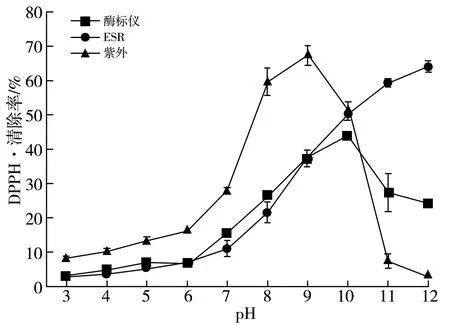
图2 pH对DPPH自由基清除率的影响关系图Fig.2 Effect of pH on DPPH radical scavenging rate
由图2可知,使用ESR测量的MRPs对DPPH·的清除率随着pH值的增大而增大,在pH为12时达到最大,在酸性条件下(pH 3~7),MRPs对DPPH·的清除率缓慢递增且清除率非常低,当模拟体系进入到碱性后,MRPs对DPPH·的清除率迅速增大,说明碱性环境更加有利于MRPs中抗氧化活性物质的生成。使用紫外分光光度计法与酶标仪法测量的结果与ESR法结果不一致,UV法与酶标仪法测量的MRPs对DPPH·的清除率随着pH值的增大呈现先增后减的趋势。相同性在于在酸性条件下(pH 3~7),MRPs对DPPH·的清除率呈现缓慢递增趋势,使用紫外法测得的MRPs对DPPH·的清除率在pH为9时达到最大,之后呈现递减趋势。而使用酶标仪所测的MRPs对DPPH·的清除率在pH为10时达到最大,之后呈现递减趋势。这一差别可能来源于样品自身OD值以及MRPs与DPPH反应后反应产物的OD值的影响。
2.2.2 反应温度对DPPH·清除率的影响
反应温度对DPPH·清除率的影响关系图见图3。
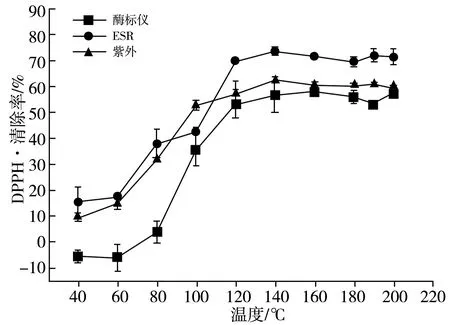
图3 反应温度对DPPH自由基清除率的影响关系图Fig.3 Effect of reaction temperature on DPPH radical scavenging rate
由图3可知,使用3种方法测量的MRPs对DPPH自由基的清除率随着温度的升高都呈现出先增大后稳定的趋势。当反应温度为40~120 ℃时,MRPs对DPPH自由基的清除率随着温度的升高而增大,当反应温度为120~200 ℃时,MRPs对DPPH自由基的清除率随着温度的升高而呈现稳定的趋势。这说明提高温度有利于MRPs中抗氧化活性物质的生成,并且MRPs中抗氧化活性物质总量具有一定的稳定性,可能存在两种形式:一种形式为,随着温度提升到120 ℃以上,MRPs中抗氧化活性物质不再生成,且具有极强的耐热性,不会随着反应温度的提升而分解或者转化;另一种形式为,当温度提升到120 ℃以上时,MRPs中抗氧化活性物质会随着温度的升高而分解或者转化,但与此同时有新的抗氧化活性物质在不断生成,而生成的速率与分解或者转化的速率一致,呈现出动态稳定。使用酶标仪所测的MRPs对DPPH自由基的清除率在40~60 ℃时出现了负值,这可能是受到了样品OD值的影响。
2.2.3 反应时间对DPPH·清除率的影响
反应时间对DPPH·清除率的影响关系图见图4。
由图4可知,使用3种方法测量的MRPs对DPPH·的清除率随着反应时间的延长都呈现出先增大后稳定的趋势。反应时间为20~120 min时,MRPs抗氧化活性物质迅速生成。反应时间为120~200 min时,MRPs对DPPH·的清除率基本无明显变化,说明 MRPs 中具有抗氧化活性的物质形成于反应的初始阶段,同时在后期的反应过程中,MRPs中具有抗氧化活性的物质不会随着反应时间的增长而分解,MRPs在模拟美拉德反应体系中具有一定的稳定性。使用酶标仪所测得的MRPs对DPPH·的清除率在20 min时出现了负值,这可能是受到了样品OD值的影响。
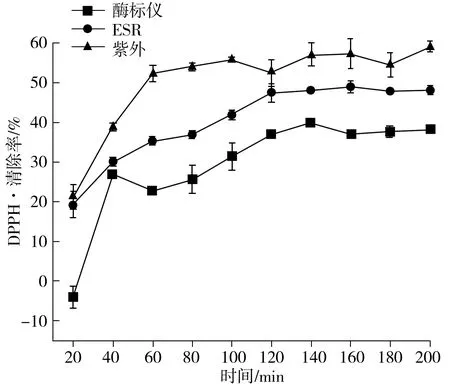
图4 反应时间对DPPH自由基清除率的影响关系图Fig.4 Effect of reaction time on DPPH radical scavenging rate
2.2.4 反应料液比对DPPH·清除率的影响
反应料液比对DPPH·清除率的影响关系图见图5。
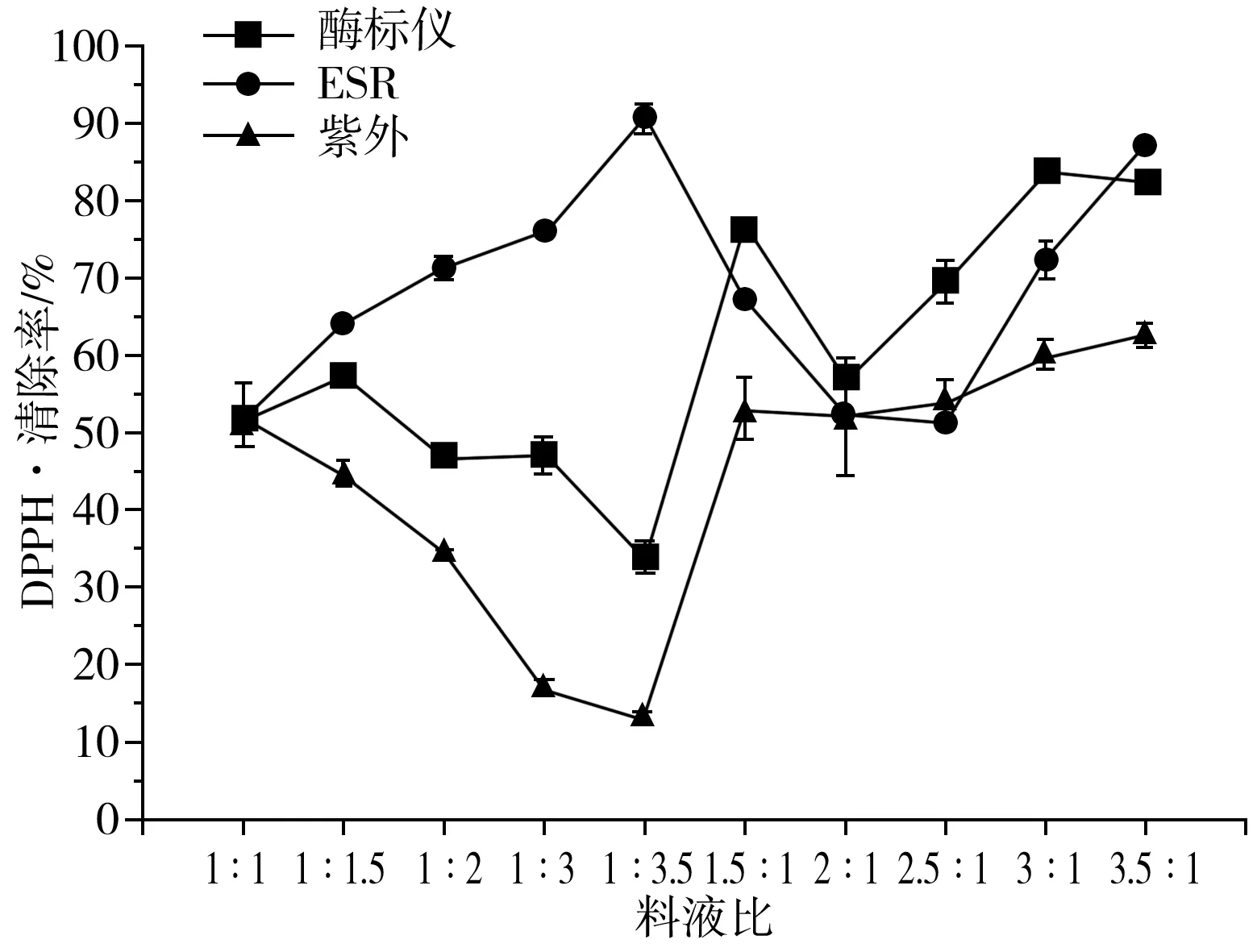
图5 料液比(阿拉伯糖∶赖氨酸)对DPPH自由基 清除率的影响关系图Fig.5 Effect of solid-liquid ratio (arabinose∶lysine) on DPPH radical scavenging rate
由图5可知,使用ESR法测量的MRPs对DPPH·的清除率随着赖氨酸在反应体系中含量增大而升高,而使用UV法与酶标仪法所测结果与ESR法相反,即MRPs对DPPH·的清除率随着赖氨酸在反应体系中含量增大而降低。使用紫外法研究的MRPs对DPPH自由基的清除率随着阿拉伯糖在反应体系中含量增大而增大,而ESR法与酶标仪法则无规律,但是ESR法与酶标仪法所测得的结果更为接近。使用3种方法得出不同的结果,极有可能是MRPs与DPPH·反应后的反应产物在517 nm处具有很强的吸收值,而这类抗氧化活性物质的生成可能与赖氨酸有关,使用UV法与酶标仪法测量的结果不一致在于DPPH含量不同,虽然酶标仪法原理与紫外法一致(即都以517 nm处的OD值反映DPPH·的含量),但是由于酶标仪使用的DPPH含量更高,因此所受影响更小。
2.3 样品OD值的测定
2.3.1 不同反应条件下MRPs OD值的测定
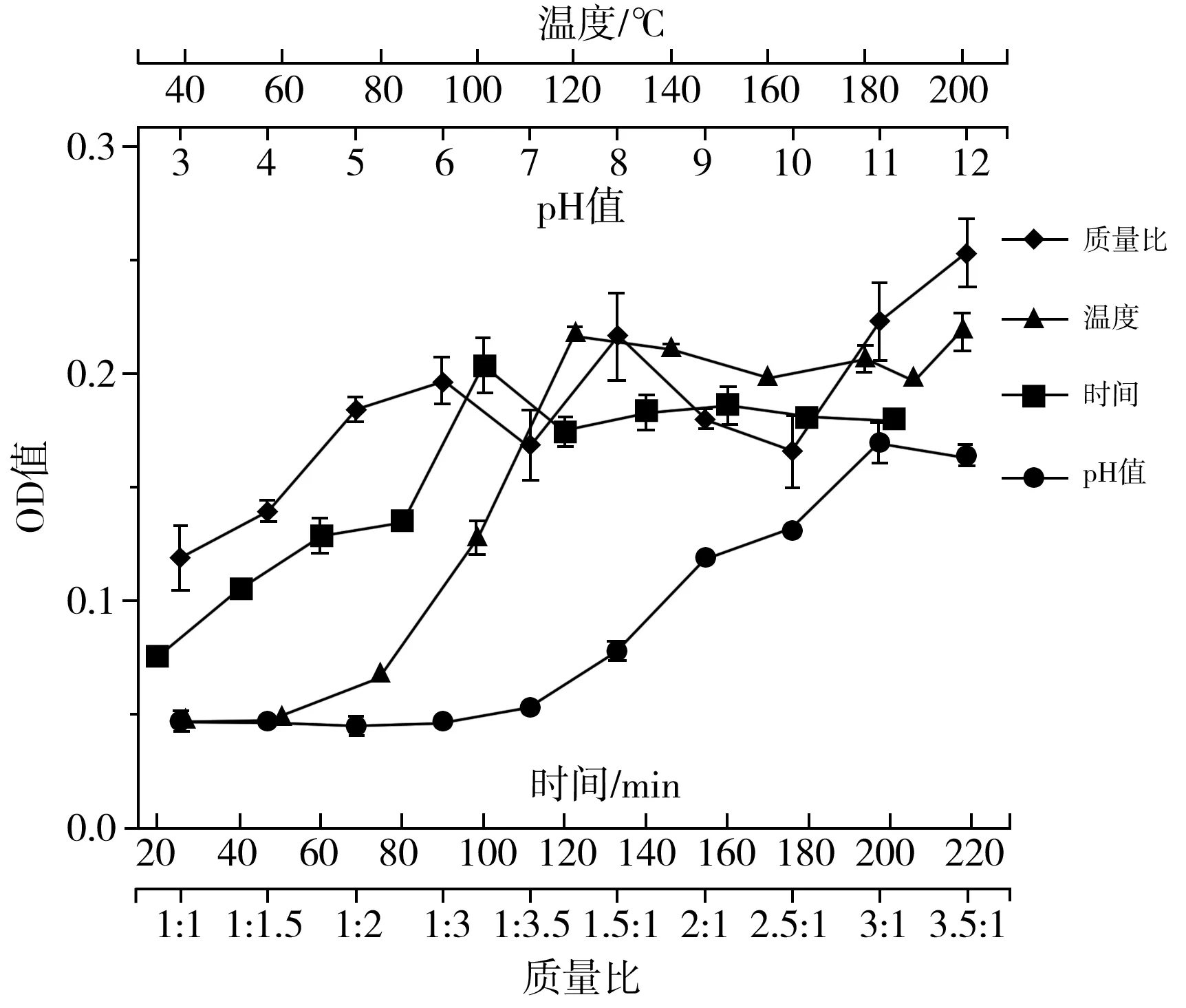
图6 不同反应条件下MRPs OD值的变化关系曲线图Fig.6 Change relation curves of OD values of MRPs under different reaction conditions
由图6可知,不同条件的模拟体系下MRPs在517 nm处的吸光度值不同,随着反应温度、时间的增加,样品OD值呈现先升高后稳定的趋势。反应温度在40~120 ℃时,MRPs的OD值迅速增大,在120~200 ℃时,MRPs的OD值趋于稳定。反应时间在20~100 min时,OD值急速增大,随后随着反应时间的延长,MRPs的吸光度值趋于稳定。随着pH值的增大,MRPs的吸光度值在不断增大,在酸性条件下,MRPs的OD值增长较为缓慢,当模拟体系进入碱性条件时,MRPs的OD值迅速增大,在pH值为12时达到最大。随着模拟体系中阿拉伯糖与赖氨酸的比例不同,MRPs的OD值也随即变化。随着反应条件的变化,MRPs自身的OD值呈现了不同的变化,这是影响比色法结果准确性的重要原因之一。
2.3.2 不同种类的MRPs对DPPH·清除率以及OD值的测定
为了验证2.3.1的猜想,选取6种不同组合的糖和氨基酸,进行了MRPs OD值的测定。并且使用ESR法和紫外分光光度计法计进行对比,其中紫外分光光度计法测定的DPPH·清除率采用了扣除样品OD值以及未扣除样品OD值的两种算法,结果见图7。
由图7可知,ESR法测量不同种类模拟反应组合的MRPs对DPPH·的清除率由大到小依次为:核糖与赖氨酸>阿拉伯糖与赖氨酸>核糖与精氨酸>阿拉伯糖与甘氨酸>阿拉伯糖与精氨酸>核糖与甘氨酸。用紫外分光光度计法测量不同种类模拟反应组合的MRPs对DPPH·的清除率由大到小依次为:核糖与精氨酸>核糖与赖氨酸>阿拉伯糖与精氨酸>阿拉伯糖与赖氨酸>阿拉伯糖与甘氨酸>核糖与甘氨酸。减去样品稀释液吸光度值后计算不同种类模拟反应组合的MRPs对DPPH·的清除率由大到小依次为:阿拉伯糖与赖氨酸>阿拉伯糖与甘氨酸>核糖与甘氨酸>核糖与赖氨酸>核糖与精氨酸>阿拉伯糖与精氨酸,这一结果与紫外法相比,减去样品吸光度值后计算的DPPH·清除率和ESR法测量的结果更为接近,但是依旧不同,可能是由于MRPs中具有抗氧化活性的物质在和DPPH·反应后所生成的新产物在517 nm处依旧具有吸光度值。
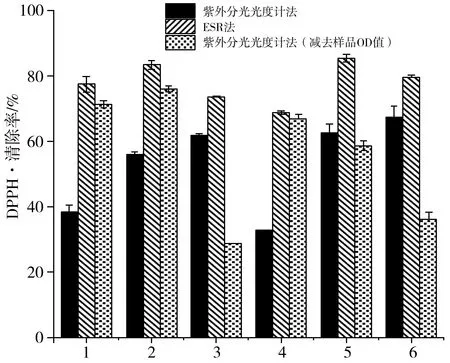
图 7 不同方法测定不同种类MRPs对DPPH·清除率Fig.7 Determination of DPPH· scavenging rate of different kinds of MRPs by different methods
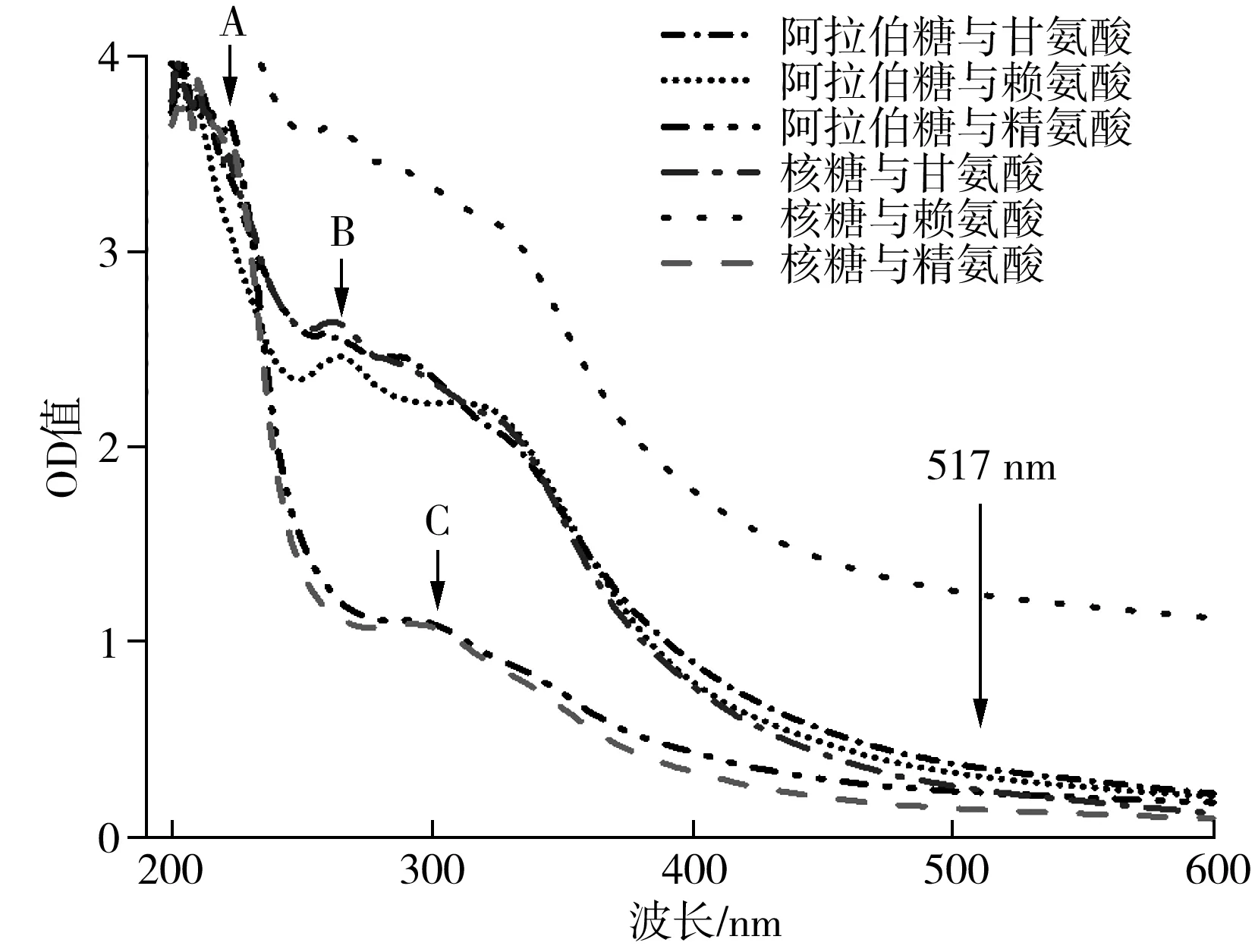
图8 不同种类的MRPs在不同波长处OD值变化曲线图Fig.8 OD value variation curves of different kinds of MRPs at different wavelengths
由图8可知,在517 nm处MRPs都具有一定的吸光度值,因此运用紫外分光光度计法测量自由基清除率容易受到MRPs自身的影响而造成实验误差。由图中3个出峰位置观察可知(A:阿拉伯糖与精氨酸、核糖与精氨酸;B:核糖与赖氨酸、阿拉伯糖与赖氨酸;C:阿拉伯糖与精氨酸、核糖与精氨酸),MRPs产生的OD值极有可能与反应体系中的氨基酸类物质有关,这一猜想需要进一步证实。
2.4 均匀实验
为了更好地对比3种仪器测量MRPs抗氧化活性的准确性,选取阿拉伯糖与赖氨酸组合,以DPPH自由基(DPPH·)清除率为检测指标,应用酶标仪法、ESR法、紫外分光光度计法对其抗氧化活性进行均匀实验,结果见表2。
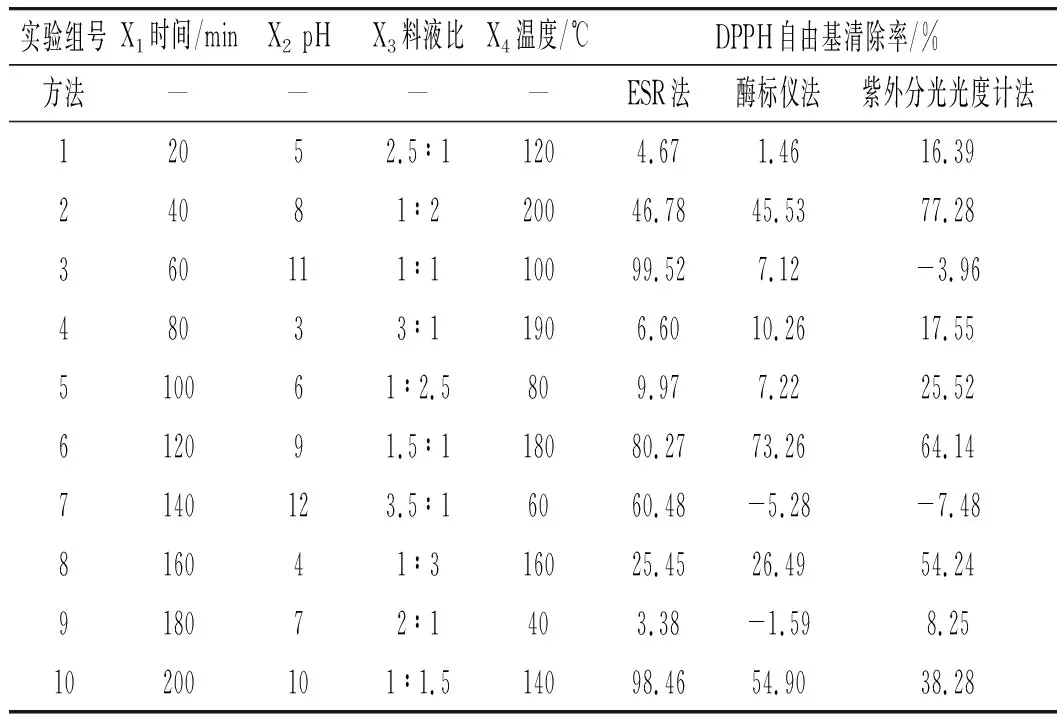
表2 均匀实验结果Table 2 Uniform experimental results
ESR法均匀实验Mathmatics 4.0软件分析:回归方程的P值为0.008837,方程可靠;回归方程为:Y=-31.2045-0.4127X1+12.0035X2-2.5427X3-0.1311X4+0.003888X1X4。
从回归分析的显著性分析可以看出,pH值(X2)对DPPH·清除率具有极显著的影响,P值为0.00126;反应时间与反应温度有一定的交互影响。
酶标仪法均匀实验Mathmatics 4.0软件分析:回归方程的P值为0.035175,方程可靠;回归方程为:Y=-64.3146+0.1509X1+3.4743X2-5.7622X3+0.4131X4。
从回归分析的显著性分析可以看出,反应温度(X4)对DPPH·清除率具有极显著的影响,P值为0.0095;反应时间(X1)、pH(X2)和料液比(X3)都不具有显著影响。
紫外分光光度计法均匀实验Mathmatics 4.0软件分析:回归方程的P值为0.00793,方程可靠;回归方程为:Y=124.362+3.186X2X3+0.1083X2X4-19.6154X2-25.0783X3-0.3485X4。
从回归分析的显著性分析可以看出,pH(X2)、料液比(X3)以及pH(X2)与料液比(X3)之间的交互影响,pH(X2)与反应温度(X4)之间的交互影响,对DPPH·清除率具有显著的影响,P值分别为0.0145,0.020,0.0244,0.02136。
结合上述均匀实验结果以及研究实际情况得到优化水平组合,见表3。
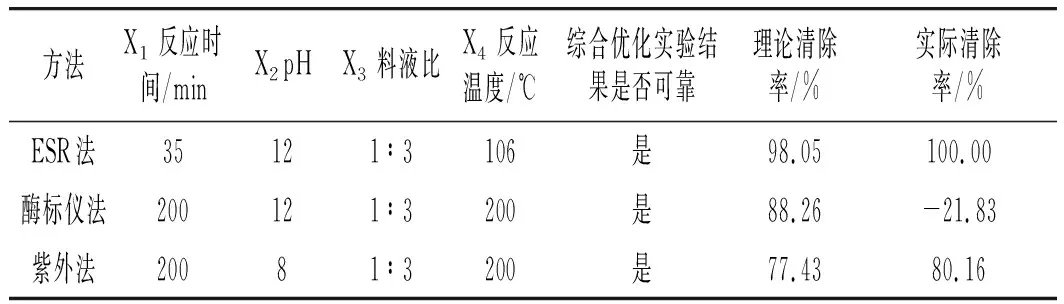
表3 3种方法均匀实验优化水平结果Table 3 Results of the uniform experimental optimization level of the three methods
由表2可知,紫外法和酶标仪法的DPPH·有负数存在,即加入MRPs后生成了DPPH·,这显然不符合实际情况。且出现负数的组多为pH较大的组,这与pH的单因素实验结果类似,因此pH值越高,越有利于在517 nm处有较强吸光度的反应产物生成或者是MRPs中某类物质在碱性条件下转化成具有较强吸光度值的物质,这一猜想有待于进一步研究。
由表3可知,3种方法优化的结果不同,且最优条件差异较大。ESR法、酶标仪法、紫外法3种方法优化结果的相对误差分别为1.95%、504.31%、3.41%。因此从优化结果来看,3种方法的准确性为ESR法>紫外法>酶标仪法。从最优条件分析,酶标仪法与紫外法优化都需要高温和较长时间,而ESR法最优条件的反应温度和反应时间都很合理,因此ESR法优于另外两种方法。
3 结论
本实验以阿拉伯糖与赖氨酸为美拉德反应模型,运用ESR法、紫外分光光度计法、酶标仪法测量了不同反应时间、反应温度、料液比、pH下得到的MRPs对DPPH·的清除能力大小,通过单因素实验发现,3种方法所测得的反应时间、反应温度的结果基本保持一致,在酸性条件下3种方法所测得的结果也基本一致,但是用3种方法测得的碱性条件和不同糖和氨基酸比例组的结果不同。
对此可以做出以下假设:美拉德反应产物中具有抗氧化活性的物质是一种复杂的物质。在这类物质中有一类物质能够与DPPH结合,且结合后的产物在517 nm处具有极强的吸光度信号,这类物质在pH值越大时生成量也越大,且与糖和氨基酸的比例有关,因此以吸光度值来衡量MRPs与DPPH反应前后浓度变化就会有很大的误差,且反应后反应物的OD值占据主要变化,因此扣除样品OD值也不能完全保证实验结果的准确性,在寻找MR最优条件时也会因为这一误差而导致结果不准确,因此ESR法更适合于寻找MR最优条件以及抗氧化活性的研究。比色法(紫外法、酶标仪法)极有可能不适合MRPs最优条件的优化实验,而只适用于同一反应条件下MRPs抗氧化活性的对比研究。

