阵发性交感神经过度兴奋综合征诊断及治疗进展
王玉明综述, 陈艳兰审校
阵发性交感神经过度兴奋综合征(paroxysmalsympathetic hyperactivity,PSH),是一种严重的临床症候群,又称为自主神经功能障碍综合征、间脑发作、交感风暴、自主神经风暴、温热植物神经失调等,可由多种颅脑损伤所致,临床以发作性交感神经过度活跃(发热、呼吸频率增快、心率增快、血压升高、出汗等)伴姿势或肌张力障碍为特征[1,2],一般可持续数周或数月不等。PSH目前没有统一的诊断标准及指南规范,即使是高年资神经科医师亦有可能误诊、漏诊,常误诊为恶性综合征、血清素综合征、癫痫全面性发作、严重感染、中枢性高热等,进而可能采取不恰当的治疗措施,导致不良的预后结局[3]。同时PSH是继发脑损伤的潜在高危因素之一,增加患者的病死率[4],因此早期识别、诊断及治疗尤为重要。本研究对PSH近年文献进行复习总结,主要论述PSH的病因、机制、诊断标准、治疗方法等,以期为临床工作中此类疾病的诊断、治疗提供借鉴或参考,使患者获益。
1 病因及发病机制
PSH的病因复杂多样,主要见于颅脑外伤[1,5],约占1/3以上,最常见于年轻昏迷的重型颅脑创伤患者[1],其次可发生于非创伤性颅脑疾患如脑卒中、缺氧性颅脑损伤、中毒性脑病、颅内感染、颅内肿瘤、抗N-甲基-D-天冬氨酸受体脑炎等[6],也见于无明显器质性脑损害的疾患,如严重烧伤、水电解质酸碱失衡、坏死性筋膜炎[7,8]以及睡眠剥夺[9]等。关于产生PSH的病理生理机制目前尚有争议,存在多种学说,如失联学说、神经内分泌假说和癫痫假说等[6]。传统的失联学说认为,PSH可能是交感神经兴奋中枢失去更高级中枢如皮质或皮质下结构控制后的释放现象[10,11],但该理论无法完全解释PSH的临床表现。目前较认可的是兴奋-抑制率模型学说,该理论提出间脑和脑干存在脊髓传入抑制中枢,当其受损时,交感神经兴奋中枢兴奋性及敏感性增强,微小刺激(非伤害性,如小便、翻身、吸痰等)或伤害性刺激均可导致PSH发生[12,13]。有研究认为年龄较轻、脑室周围损伤、弥漫性轴索损伤、修改版昏迷恢复量表(Coma Recovery Scale-revised,CRS-R)评分较低、气管切开术等是发生PSH的独立危险因素[12,14]。
2 临床表现
有研究报道PSH患者以男性居多[15],多见于脑损伤后24 h内至数周[4],也可发生在脑损伤后7 d至5 y[12],其临床表现形式多样,主要为发作性的运动症状和交感神经过度兴奋症状,可同时出现,亦可单独出现。运动症状主要表现为去皮质强直或去脑强直、肌阵挛、肌痉挛、姿势或肌张力障碍等。交感神经过度兴奋症状则主要表现为瞳孔散大、躁动不安、高热、大汗、心率及呼吸增快、血压升高等,有文献报道高达98%的PSH患者心率增快,少于40%的患者出现姿势或肌张力障碍,发汗、呼吸急促、血压增高者超过71%[16]。但除此之外,也可伴有副交感神经过度兴奋症状,如瞳孔缩小、流泪、体温低于正常、心率及呼吸减慢、血压下降、呃逆等;PSH一般发作1~3次/d,常突然发作,持续数分钟至数小时不等,病程持续1~2 w或数月[10,17]。
3 诊断标准
由于PSH的临床表现无特异性,且与多种神经系统疾病的肌肉过度运动及自主神经过度兴奋的表现相似或重叠,目前亦缺乏特异性的辅助检查及统一的诊断标准,故临床诊断有一定困难[4,17]。自1929年Penfield首次报道继发于颅脑外伤的PSH,至今共提出了9个诊断标准[10,18],其中较认可的有2004年Blackman等[19]及2006年Fernandez-Ortega等[20]提出的诊断标准,但并未被广泛采用。直到2014年Baguley等[21]提出了PSH评估量表(paroxysmal sympathetichyperactivity assessment measure,PSH-AM),则较为公认,临床上使用较多。PSH-AM包括临床特征评分(clinical feature scale,CFS)、诊断可能性评估工具(diagnosis likelihood tool,DLT)两个模块,据此进行综合评定。其中CFS(见表1)根据患者临床症状严重程度分为:无(0)、轻度(1~6)、中度(7~12)、重度(≥13);DLT则列出了11个诊断分项,每符合一项计1分,分别为:①症状同时发生;②症状可由轻微刺激诱发;③症状发生在脑损伤两周后;④获得性脑损伤病史;⑤发作具有突发性;⑥发作≥2次/d;⑦发作期无副交感神经兴奋症状;⑧临床表现出现3 d及以上;⑨使用交感神经抑制药物治疗有效;⑩其他鉴别诊断治疗无效;排除其它原因。总分=CFS+ DLT,依据不同的分值来判定诊断PSH的可能性,分为:很可能诊断(≥17分)、可能诊断(8~16分)、不能诊断(<8分)。PSH-AM的出现,对PSH的诊断标准起到了量化作用,但CFS亦存在明显的不足,例如对于严重躁动的患者,其体温、血压等指标无法作出准确的评分;同时该评分特异性相对较低,一项回顾性研究[22]认为,PSH-AM的敏感性为94%,特异性为35%。因此,PSH的诊断标准仍须进一步完善和规范,以更好地指导临床工作。
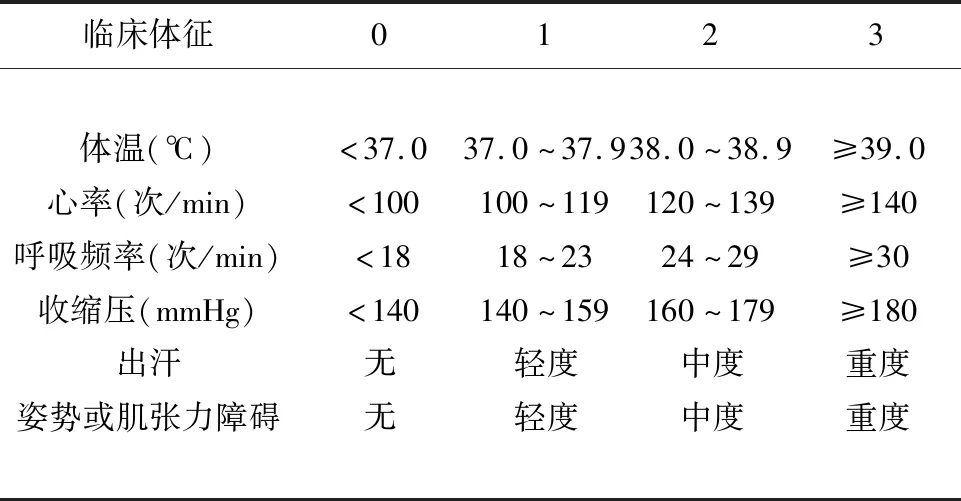
表1 PSH临床特征评分量表(clinical feature scale,CFS)
4 治疗措施
PSH发作的治疗主要是对症支持及病因治疗,即一般治疗、药物治疗和特殊治疗,治疗目标是消除病因或诱因,控制症状,减少交感神经过度兴奋导致的并发症,以改善预后。
4.1 一般治疗 包括吸氧、物理降温、营养支持、维持水电解质酸碱平衡[17]等,可促进患者恢复,减少相关并发症,如肌萎缩、脱水等。
4.2 药物治疗 相关药物的作用靶点包括β-肾上腺素能受体、阿片受体、钙离子通道、多巴胺D2受体、GABA-A/B受体等,药理机制则包括:(1)抑制传入感觉通路的超敏化反应;(2)抑制中枢交感神经递质的释放;(3)阻断终末靶器官的生物效应。①非选择性β受体阻断剂,常用普萘洛尔,对大部分患者有效(有禁忌证者除外,如合并支气管哮喘、心源性休克等),其脂溶性强,易透过血脑屏障,主要通过拮抗外周及中枢交感神经活性和儿茶酚胺类递质,减少PSH发作频率和降低高热状态所致脑损伤[18,23]。②阿片类受体激动剂,可抑制大脑皮质痛觉区,且可能对中枢交感神经有抑制作用,能降低血压、减慢心率、降低呼吸频率等,首选吗啡,其次有芬太尼、美沙酮等。吗啡能快速终止PSH发作[24],但有剂量依耐性,部分患者需要的剂量较大[25],且使用禁忌证较多,故临床使用受到一定限制。③苯二氮卓类,主要作用于中枢神经系统GABA-A受体,通过肌松、镇静、催眠和抗惊厥等作用控制PSH发作,相关药物有咪达唑仑、劳拉西泮和地西泮等,多与其他药物联合使用,PSH控制后,逐渐减停,突然撤药则可能致病情恶化或癫痫发作。④γ-氨基丁酸(GABA)受体激动剂,主要通过激动GABA-B受体,抑制兴奋性氨基酸释放而发挥作用,临床常用药物为巴氯芬、替扎尼定,可降低体温、松弛肌肉张力。部分研究报道口服巴氯芬治疗PSH无效[26],但有研究[27]表明鞘内泵入巴氯芬对常规药物治疗无效的PSH患者具有良好效果。⑤α2受体激动剂,通过激活中枢交感神经的突触前膜α2受体而发挥作用,减少去甲肾上腺素释放,起到降低血压,同时有一定的镇痛、镇静作用,目前主要有右美托咪啶、可乐定。有研究[28]表明,右美托咪啶优于咪达唑仑,具有更可控的镇静效果和安全性。另有报道[29],右美托咪啶对中枢迷走神经亦可能具有直接兴奋作用。⑥钙通道受体阻滞剂,主要通过阻滞钙离子通道,抑制中枢神经系统及脊髓后角灰质神经递质的释放而发挥作用,常用药物为加巴喷丁,有报道[30],加巴喷丁联合胍法辛治疗PSH效果较好,可能是治疗PSH的一种选择。⑦多巴胺D2受体激动剂,其机制可能是选择性激动多巴胺D2受体,进而抑制交感兴奋,对改善肌张力障碍和降低中枢性高热效果显著。主要药物为溴隐亭,但忌与H2受体阻滞剂、降压药等药物合用。⑧肌松药,能够抑制肌浆网释放Ca2+,有效缓解肌肉痉挛,主要药物为丹曲林,但其具有呼吸抑制及肝毒性等不良反应[26],应予谨慎使用,注意观察。另须指出的是,氟哌啶醇、氯丙嗪等多巴胺受体阻断剂不宜应用于PSH患者,因其具有潜在危害性,对病情控制无益。
4.3 特殊治疗:(1)经皮迷走神经刺激术(transcutaneous vagus nerve stimulation,t-VNS),可通过影响孤束核及中枢神经系统神经元电活动[31],抑制交感兴奋,有望成为治疗PSH的方式之一,但仍须大样本研究支持;(2)高压氧治疗可增加受损脑组织的氧供,有研究表明高压氧对PSH的治疗有效,但其效果是有限的[32],故高压氧作为一种治疗措施,其疗效仍需临床研究进一步证实。同时考虑到PSH患者大多生活不能自理,仍需加强护理,采取适当的床旁康复训练措施,以减少近期及远期并发症。
5 结 论
PSH是一种严重的临床症候群,其发病机制尚不明确,目前诊断主要依靠临床表现,并排除其它导致类似症状的疾病。在临床实践中,对PSH认识不足,易造成漏诊、误诊;该综合征被识别得越晚,患者的预后也越差[13]。因此,有必要加强对PSH的认识,规范PSH的诊疗,及早识别、诊断和处理,有助于减少继发损伤,对患者的康复具有重要意义[2]。今后可开展多中心的大样本研究,以进一步探讨PSH的发病机制,制定更适合临床、更实用的诊断标准及治疗方案。

