引流阀(FP7)植入术与小梁切除联合羊膜移植术治疗难治性青光眼的疗效对比
吕平 姚柯婷 程红 李彬 黄灏 张大传
青光眼是世界范围内首位不可逆转的致盲眼病[1]。就其治疗而言,以小梁切除术为代表的滤过手术是目前较为通用的手术方式[2],但对于某些难治性青光眼,小梁切除术的成功率仅为11%~52%[3-5]。联合羊膜移植可以在一定程度上提高手术成功率[6]。近年来房水引流阀植入手术应用率逐渐上升,已经成为治疗青光眼尤其难治性青光眼的首选术式[3]。FP7型Ahmed青光眼引流阀是通过一种弹力膜的方式[7,8],将眼压控制在8~10 mmHg(1 mmHg=0.133 kPa)。由于房水引流阀植入手术的操作主要在眼球壁完成,进入前房少,因而相对小梁切除术,手术安全性较高,术中引起的严重并发症少[9]。但手术步骤相对较多、缝合操作多,时间相对延长。收集我科难治性青光眼28例(30只眼),观察改良式FP7引流阀植入术对比小梁切除联合羊膜移植的有效性。报告如下。
资料与方法
一、一般资料
回顾性病例研究。选自2016年1月至2021年1月入住我科的难治性青光眼患者28例(30只眼), A组18例(18只眼)均行FP7引流阀植入术。其中男性10例(10只眼),女性8例(8只眼),年龄38~79 岁,平均年龄(63.72±12.46)岁。术前眼压30~ 59 mmHg,平均眼压(42.83±9.82) mmHg;术前视力无光感4只眼,光感3只眼,手动5只眼,指数2只眼,≤0.1者2只眼,≤0.3者2只眼。B组10例(12只眼)均行小梁切除联合羊膜移植术。其中男性5例(5只眼),女性5例(7只眼),年龄18~74岁,平均年龄(61.30±11.64)岁。术前眼压22~ 53 mmHg,平均眼压(40.17±13.65) mmHg;术前手动2只眼,指数/眼前1只眼,≤0.3者4只眼,≥0.3者5只眼。两组术前使用的局部或全身降眼压药物种类数量为2~5(3.44±0.92)种,全部患者术前用药数量≥2。两组患者基本数据年龄、性别、术前眼压等均无明显差异(P<0.05)。所有入组患者病理类型均属于难治性青光眼。
二、方法
1.手术成功的判断标准:(1)手术成功:不加用降眼压药物,眼压控制在21 mmHg以下;(2)部分成功:加用1种或者2种降眼压药物后眼压维持在21 mmHg以下。手术失败的判断标准:(1)部分失败:术后加用局部降眼压药物,眼压仍>21 mmHg,需联合全身用药者;(2)手术失败:降眼压药物不能控制眼压,需要再次手术,或者发生严重并发症以及须取出AGV。
2.手术方式:A组均采用MODEL FP7可弯曲阀体(new world medical 公司,美国),选取颞上象限作为手术区域,麻醉方式选择球后麻醉+局部结膜下浸润麻醉。做以穹隆部为基底的结膜瓣,钝性分离结膜下筋膜等组织,充分暴露巩膜,隧道刀制作大小约4 mm×6 mm巩膜瓣(厚度大约1/3巩膜厚度)。将引流阀初始化,即用4号钝针头向引流管内推注平衡盐溶液或者生理盐水以打开阀门。将预置缝线的引流盘纳入结膜瓣下,放置于上直肌与外直肌之间巩膜赤道部,前段据角膜缘10 mm,固定于巩膜上。修剪引流阀管道长度,于巩膜瓣下做一平行于角膜缘之切口,7号针头穿刺入前房,隧道稍长,穿刺方向与虹膜面平行,注入适量黏弹剂于前房与隧道内,引流管斜面向上植入前房约2~3 mm。为避免接触周边组织,尽量让引流管与虹膜面平行。对位缝合巩膜瓣2针,缝线固定引流管于浅层巩膜上1针。缝合结膜瓣。调试眼压。B组麻醉、制作结膜瓣方式同A组,分离结膜下组织,暴露上方巩膜,做3 mm×4 mm板层巩膜瓣,做辅助切口,于巩膜瓣下深层巩膜做一1.5 mm×2 mm小梁窗,见虹膜脱出,予以切除部分虹膜,整复虹膜,复位巩膜瓣,平铺羊膜于巩膜瓣下,对位缝合巩膜,结膜,自辅助切口形成前房,观察滤过满意。两组术后均予以局部消炎、预防感染对症治疗,积极处理并发症。
三、统计学分析方法
运用IBM SPSS22.0统计学软件,经检验数据均符合正态分布,故采用重复测量方差分析及独立样本t检验对两组患者术前、术后不同时间眼压值进行统计学分析。
结 果
一、眼压
两组患者手术前后眼压值比较(表1)。
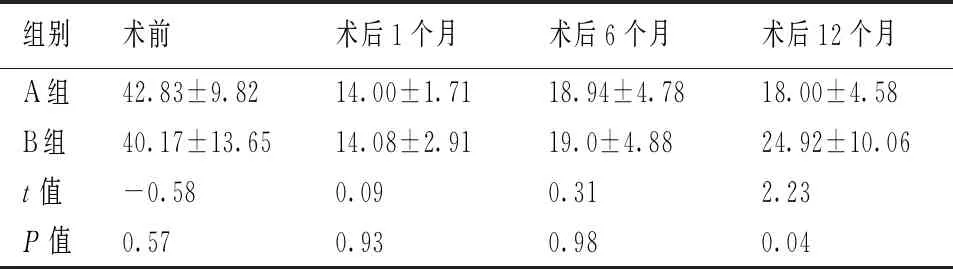
表1 两组患者术前术后不同时间眼压水平(mmHg)
两组患者术前、术后不同时间眼压值方差分析差异均有统计学性意义,术后眼压较术前均有明显降低,两组间术前眼压差异采用独立样本t检验得出没有统计学异议(P>0.05),术后1个月、6个月两组之间差异没有统计学意义(P>0.05),术后1年差异有统计学意义(P<0.05)。
二、视力
末次随访时最佳矫正视力分布如下: A组中有 7只眼(38.89%)最佳视力提高,9只眼 (50%)无明显变化,2只眼(11.11%)视力降低。 B组:3只眼(25.0%%)最佳视力提高,4只眼 (33.33%)无明显变化,5只眼(41.67%)视力降低。
三、联合使用降眼压药物种类
到末次随访,A组术后18只眼中5只眼(27.78%) ,B组术后12只眼中6只眼(50.0%)需联合使用降眼压药物。
四、手术成功率
根据末次随访结果判定A组12只眼 (66.67%)手术成功,部分成功5只眼(27.78%),1只眼(5.56%)手术失败;B组6只眼(50.0%)手术成功,部分成功2只眼(16.67%),4只眼(33.33%)手术失败。
五、并发症
术后早期并发症A组分别为低眼压1只眼(5.56%)、浅前房2只眼(11.11%),B组浅前房、脉络膜脱离4只眼(33.33%),经过积极对症治疗后均好转出院。中晚期并发症发现A组引流管口堵塞1只眼 (5.56%), B组6只眼(50.0%)在术后1年出现滤过通道堵塞。
讨 论
难治性青光眼一般指那些药物难以控制眼压,而做常规滤过性手术预后不好的青光眼,如小梁切除术后失败的青光眼、白内障术后或者玻璃体切除术后的青光眼、外伤后的青光眼、新生血管性青光眼、青少年性青光眼、继发于眼部相关疾病引起的青光眼等[10]。由于难治性青光眼均为不同原因所致的眼部正常组织结构的损坏和紊乱,从而促使成纤维细胞的增殖[8],普通的抗青光眼手术滤过通道位于术后增殖活跃的前部结膜组织,术后容易堵塞,从而不能形成有效的滤过。我们的观察中B组行小梁切除术的患者为了防止术后堵塞,术式联合了羊膜移植。到末次随访12只眼中仍有6只眼发生了堵塞。青光眼引流阀(FP7)是将眼内的房水通过插入前房内的管道引流入埋置于赤道部的引流盘,再渗透进入周边组织,最后经淋巴管或者毛细血管循环吸收达到降眼压的目的。房水直接引流入后部的结膜组织下,避开了容易增殖堵塞的前部区域,手术成功率得到了显著的提升[11-13]。我们的观察中,仅一小部分患者有明显的视力提高,大部分患者视力没有明显变化甚至下降,但是对于晚期青光眼患者而言,保留住一点生活视力,减少眼部疼痛感,却能够显著改善他们的生活质量[14]。随访观察中发现术后降眼压药物使用数量较术前明显减少,改善了患者的用药依从性的同时减少了他们的经济压力[15]。引流阀是由Ahmed发明并运用于临床的,是通过一种弹力膜的方式,将眼压控制在8~10 mmHg。当眼压高于8~10 mmHg时开放,眼压低于5~6 mmHg时关闭,这对减轻术后早期低眼压、浅前房的发生非常重要[16],是目前临床应用性能较为稳定的植入物。以往的研究表明引流阀植入手术早期容易发生前房出血,低眼压、浅前房以及脉脱等;中远期并发症主要包括引流管移位、管口堵塞及盘周纤维机化包裹。我们的观察中未发现前房出血的患者,所有新生血管性青光眼患者均在入院后先行抗VEGF治疗至虹膜面新生血管基本消退后再植入引流阀。抗VEGF治疗不仅能够减少术中、术后前房出血,有研究报道[17],新生血管消退后再行引流阀植入术能够降低手术失败率。 A组中:2只眼术后早期出现浅前房,考虑系房水从巩膜瓣与引流管缝隙处流出较多所致,予以扩瞳、激素、加压包扎治疗后前房恢复正常;1只眼术后低眼压,系引流阀植入联合超声乳化白内障摘除并人工晶状体植入术患者,联合手术降眼压幅度更大,予以扩瞳、激素对症治疗6 d后眼压升高至正常范围;中远期并发症,我们观察到1例虹膜角膜内皮综合征(iridocorneal endothelial syndrome,ICE)患者在术后1年出现引流导管口堵塞,导致眼压再次升高,分析原因:该患者相对年轻,增殖能力旺盛且ICE是一种进展性疾病,术后异常的内皮细胞仍继续增殖,导致引流管道堵塞[18]。到末次随访,未观察到引流阀暴露,引流盘机化包裹、引流管移位病例,可能随访时间不够或样本量不足。B组中2只眼术后早期发生浅前房,2只眼浅前房合并脉脱,系引流过畅所致,予以扩瞳、激素、加压包扎后好转出院;到末次随访中6只眼发生了管口堵塞、眼压升高,系增殖旺盛堵塞引流通道所致。我们的观察中引流阀植入术组成功率明显较小梁切除联合羊膜移植组高,较之前的报道也稍微偏高,可能我们的手术技巧在以往的基础上做了改进,植入引流管之前我们先从穿刺口注入黏弹剂,既可以形成前房,稳定眼压,预防低眼压、浅前房,又有利于引流管插入前房;NVG患者入院后先予以抗VEGF治疗,观察新生血管消退后再置入引流阀,减少了手术导致前房出血的可能性;引流管均用缝线固定在浅层巩膜上,可以预防引流管移位及术后早期引流过畅。成功率较高的原因也可能在于随访病例偏少、时间偏短。日后我们将继续随访这些患者,观察长期的成功率。
综上所述,引流阀植入手术较小梁切除联合羊膜移植术,手术并发症少,成功率高,随着引流阀植入手术技巧的提高以及经验的不断积累,可以作为难治性青光眼的首选治疗方式。

