新疆海岛棉胚性愈伤组织培养体系
杨 静,王为然,王 萌,朱家辉,宁新民,阿里甫·艾尔西,闵 玲,孔 杰,3
(1.新疆农业科学院经济作物研究所,乌鲁木齐 830091;2.华中农业大学作物遗传改良国家重点实验室,武汉 430070; 3.国家棉花工程技术研究中心,乌鲁木齐 830091)
0 引言
【研究意义】棉花基因工程育种中组织再生是关键环节,其包括愈伤组织诱导增殖、体细胞胚形成和植株再生3个重要阶段[1],而高质量的愈伤细胞对获得胚性愈伤及再生植株非常重要。围绕海岛棉胚性愈伤组织培养体系开展研究,筛选出增殖能力好的海岛棉材料,对新疆海岛棉育种提供新策略具有重要意义。【前人研究进展】1971年Beasley利用陆地棉胚珠珠孔诱导出愈伤组织[2];1983年Davidonis获得第一株体细胞再生植株[3];1996年利用遗传转化技术,第一代转基因的抗虫和抗除草剂的棉花诞生[4]。而后随着组织培养技术的不断发展,近年来,棉花再生体系得到不断的完善和提升。但相比油菜,玉米,大豆等作物,仍存在体细胞发生率低、培养周期长,成苗率低,畸形胚高等[5]。获得体细胞胚的野生棉种有:拟似棉[6]、克劳茨基棉[7]、戴维逊氏棉[8-9]、旱地棉、异常棉、瑟伯氏棉、雷蒙德氏棉、斯笃克氏棉、比克氏棉[9]、灰白棉、澳洲棉[10]、奈尔逊氏棉[11]、陆地棉[3]等部分棉花种。其中仅有克劳茨基棉、斯笃克氏棉、拟似棉、戴维逊氏棉、雷蒙德氏棉、奈尔逊氏棉、陆地棉[3]等中的少量品种,获得正常的再生植株。在海岛棉中,Sakhanokh实现了体细胞的再生培养,但试验品种单一,无法应用推广[10]。大多数研究是以海岛棉的茎尖[12],丛生芽[13]等部位进行的组织培养,通过嫁接[14]的手段获得再生植株,这种方法会存在嵌合体,需要对转化苗多次筛选[14],增加了后期验证的次数,也存在假阳性,并不适用于后续研究。【本研究切入点】通过组织培养筛选出再生能力强的基因型品种,不断拓宽棉花基因工程中转化受体的范围,是重要的研究方向。目前在棉花体细胞再生的研究中,对新疆海岛棉再生体系研究很少,制约了基因工程技术改良新疆海岛棉品种改良中的应用。开展高质量的愈伤细胞培养,筛选再生能力强的基因型品种非常必要。【拟解决的关键问题】以新疆海岛棉为材料,研究不同基因型品种的再生能力及其对激素诱导的响应,筛选出愈伤增殖好、且能够转化的海岛棉材料,完善新疆海岛棉再生体系,培育再生能力强的品种,为新疆海岛棉基因工程育种提供支持。
1 材料与方法
1.1 材 料
选取 105份国内外海岛棉材料,品种均进行连续多年自交,遗传稳定。海岛棉种子由新疆农业科学院经济作物研究所提供,Jin668作为陆地棉对照由华中农业大学棉花团队提供。试验在华中农业大学国家重点实验室进行。表1
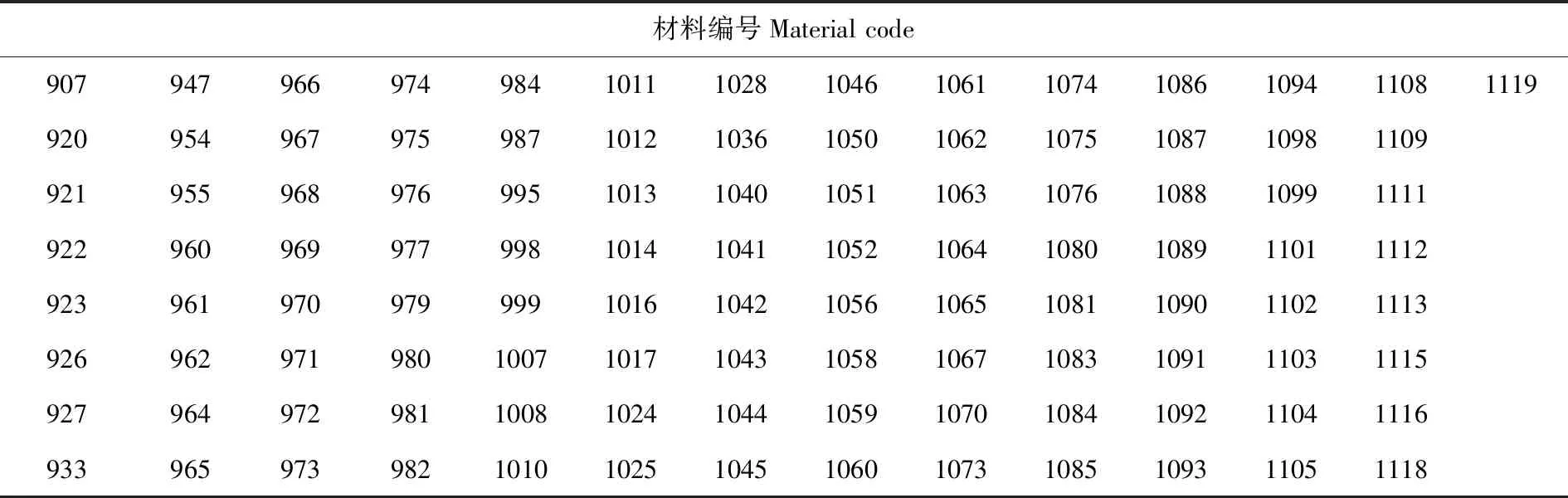
表1 海岛棉试验材料Table 1 The experiment accessions of island cotton
1.2 方 法
1.2.1 新疆海岛棉棉胚性愈伤组织诱导
种子处理:选取籽粒饱满的无损种子,剥去种壳。用75%NaAC(V/V)消毒3次,每次消毒8~10 min,无菌蒸馏水快速清洗3次,之后用无菌蒸馏水泡3次,直至种子充分吸胀,每次5~8 min。
无菌苗培养:将吸胀后的种子接种于1/2MS + 1.5%(W/V)葡萄糖的培养基上避光培养36~48 h后,扶苗。随后继续避光培养生长3~5 d,获得黄化的无菌苗。
农杆菌浸染:带有红色荧光蛋白的载体构建及农杆菌的转化参考金双侠等[15-16]实验方法。将活化之后的农杆菌离心收集菌株,悬浮于MGL活化培养基(胰蛋白胨5 g/L+NaCl 5 g/L +MgSO4·7H2O 0.1 g/L+KH2PO40.25 g/L+甘露醇5 g/L+甘氨酸1 g/L)中,并加入0.1%的As(乙酰丁香酮),以300 r/min,28℃摇床活化30 min。将去除根部和子叶的无菌苗下胚轴,切成0.5~0.7 cm的小段作为外植体,置于活化好的农杆菌菌液中搅匀,静置8~10 min,倒掉菌液,滤纸吸干残余菌液,置于超净台10min,吹干表面菌液。
共培养:将干燥好的下胚轴切段分散布于垫有滤纸的共培养培养基[MS培养基+1%(V/V)MS培养基无机盐+ 0.2%(W/V)L-Gly +0.1%(V/V)B5培养基维生素+ 0.60 mg/L 2, 4-D + 0.1 mg/L KT + 3%(W/V)葡萄糖 + 0.26%(W/V)phytagel]中,保证每段下胚轴均接触到滤纸,随后置于21℃培养箱避光培养36~48 h。
愈伤组织诱导;将浸染共培养后的下胚轴切段接种于2,4-D诱导培养基[MS培养基+1%(V/V)MS培养基无机盐+ 0.2%(W/V)L-Gly +0.1%(V/V)B5培养基维生素+ 0.60 mg/L 2, 4-D + 0.08 mg/L KT + 3%(W/V)葡萄糖 + 0.26%(W/V)phytagel+0.05 mg/mL卡那霉素]上,愈伤组织的诱导及增殖在温度(28±2)℃,光照强度1 600 lx,置于光照培养室,每天光照14 h进行培养。
1.2.2 诱导再生变化
表型:当下胚轴两端有膨大之后,愈伤组织开始增殖时,进行拍照。
重量:当下胚轴两端有膨大突起的细胞生长时,定期称量其重量。
1.2.3 红色荧光蛋白转化
对生长良好的下胚轴进行红色荧光蛋白细胞转化,并观察。将下胚轴从培养基中取出,置于显微镜下观察细胞形态。对两端膨大组织细胞,取少许加水后的细胞悬浮液置于载玻片上形成薄层,置于荧光显微镜下检测,发红色荧光的为转入红色荧光蛋白的细胞,若不发荧光则为未转入成功。
如果说隐喻是利用事物之间的相似性促动范畴的扩展,那么转喻就是利用事物的相关性促动的扩展。有些范畴化既包含着隐喻又包含着转喻,两者共同作用。图式是人们在认识客观世界的过程中基于身体经验而形成的固定的认知结构模式,如路径图式、终点图式,图式与图式之间存在着转换关系,由于这种转换关系促动的多义现象就是图式转换因素。规约意象是人脑中反映的客观事物和情景的形象和印记,它在量词范畴扩展方面发挥了极其重要的作用,文中也详细的以日语中的量词“本”为例解释了图式转换和规约意象的作用。
1.2.4 细胞形态
将正常增殖的下胚轴愈伤组织取出,对其进行分离,用1%的甲苯胺蓝染色30 s,置于显微镜下观察细胞形态。
2 结果与分析
2.1 利用2,4-D培养基对海岛棉愈伤组织诱导
研究表明,灭菌吸胀后的种子,在无菌苗培养基中经过5~7 d的培养后,海岛棉无菌苗下胚轴长势较强,粗壮,对照陆地棉Jin668的无菌苗下胚轴较为纤细。将无菌苗下胚轴切段作为外植体,浸染农杆菌后,置于2,4-D诱导培养基上愈伤诱导、增殖。培养28 d后,海岛棉下胚轴两端开始膨大生长,切口处的愈伤组织细胞增多,且不同品种间表现出质地、颜色及形态上的差异。对照Jin668的下胚轴表面光滑,两端切口处慢慢变为棕色或黑色。图1

注:A.陆地棉Jin668无菌苗(CK);B.Jin668下胚轴;C.海岛棉无菌苗;D~F.923、971、962下胚轴。Bars 值均为1 cm
2.2 海岛棉愈伤组织诱导培养后的表型
研究表明,利用农杆菌浸染的海岛棉下胚轴置于2,4-D培养基中培养4个月后,愈伤组织的质地、颜色、增殖体积呈现明显差异。
第一种为不能诱导出胚性愈伤组织的材料,表现为3种形态。一是能产生愈伤组织,增殖较慢,颜色为棕褐色,下胚轴两端呈硬质化,该类型愈伤组织最后逐渐死亡,代表性材料有923等39份;二是愈伤组织呈米色或无色,部分呈褐色,质地松软呈稀泥状,增殖较慢,且后期无增殖迹象,代表性材料有1 007等42份;三是下胚轴两端呈蓬松状,长时间培养得到米黄色絮状,后期基本不再增殖,并逐渐死亡,代表性材料有972等15份。
第二种是能诱导出胚性愈伤组织的材料。愈伤组织呈黄绿色或棕红色,质地疏松,且下胚轴两端不断膨大增殖明显,代表材料为986等共9份材料;对照Jin668也呈现出这种表型,而未浸染的Jin668愈伤则发生褐化,变黑,最后死亡,基本未发生增殖。图2

注:A.未浸染农杆菌的陆地棉Jin668(CK)的愈伤组织;B~C,E~F.培养4个月后的愈伤组织;D.Jin668浸染农杆菌后培养4个月的愈伤组织。Bars值均为1 cm
2.3 不同培养时间海岛棉材料诱导增殖变化
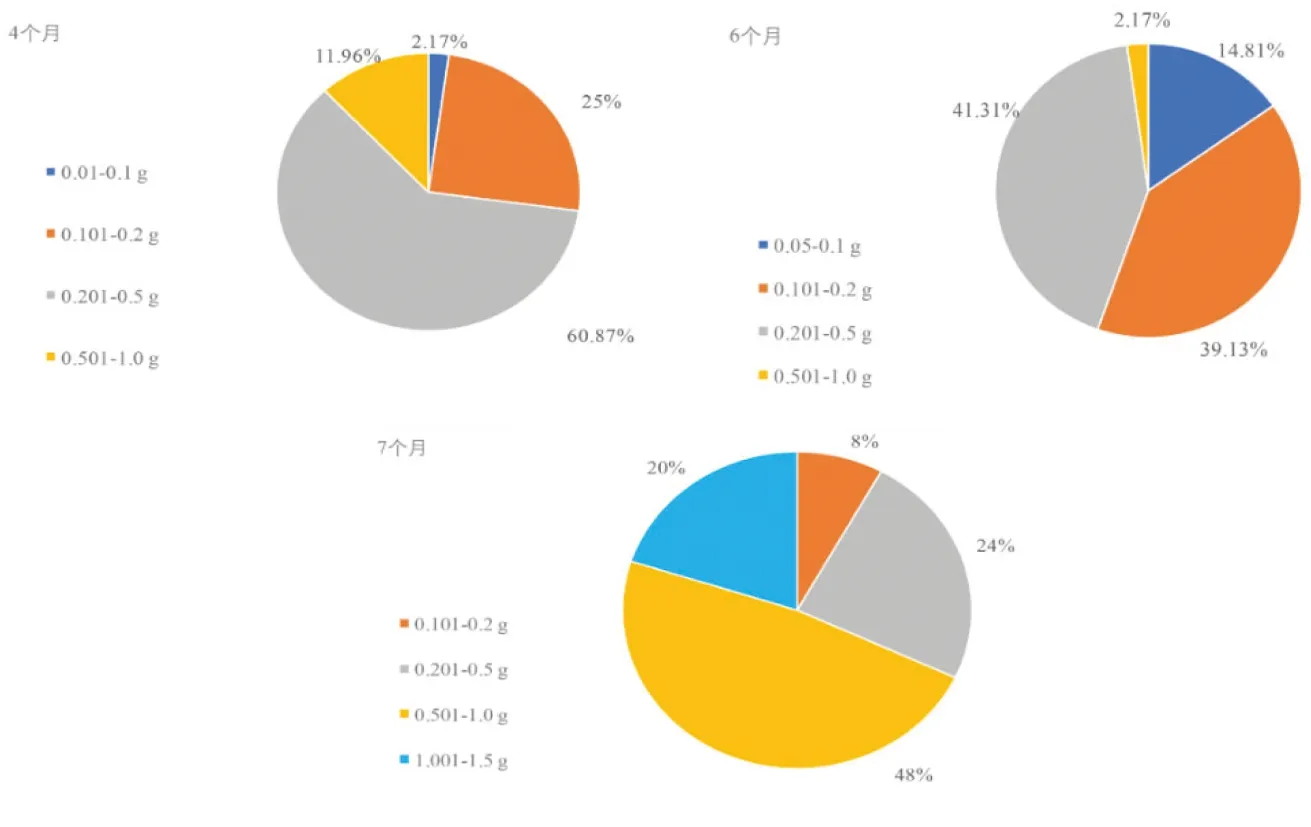
图3 海岛棉材料下胚轴增殖变化Fig.3 Variation of hypocotyledonary axis proliferation different accessions of island cotton
2.4 海岛棉材料愈伤增殖质量变化
研究表明,随着培养时间变化,不同海岛棉材料增殖速率和质量呈现出差异性。不同品种间愈伤组织大致呈现出浅黄、绿色、棕色、浅红色4种颜色,质地主要分为疏松、僵硬、硬、较软及稀泥状等类型,愈伤细胞的形态多为长柱形和近球形。愈伤呈现出的颜色、质地、细胞形态等指标筛选出962、964、986、1010、1011、1025、1052、1086、1103共9份愈伤增殖较好的材料。表2,图4

表2 不同诱导时间下胚轴愈伤组织质量(部分)Table 2 Callus quality of hypocotyl at different induction time

注:A~H分别为962,964,1010,1011,1025,1052,1086和1103培养4个月后的愈伤组织。Bars值均为1 cm
2.5 海岛棉农杆菌转化后细胞特征
研究表明,以964为代表的2份材料转化效果好,经诱导之后下胚轴增殖较快愈伤颜色呈黄绿或米黄色,质地松散,且转化成功的红色荧光的细胞多而聚集;以1010为代表的3份材料转化效果一般,虽然下胚轴长势良好,但红色荧光蛋白细胞,荧光信号较弱。且细胞呈圆球形、椭球形,细胞较为分散;以1103为代表的2份材料转化效果差,主要表现为愈伤呈棕红色、淡绿色,部分则无色,能够转化的细胞较少,荧光信号较弱。细胞多呈圆柱形或椭球形,较为聚集;以1052为代表的2份材料,转化效率极低,愈伤呈棕色或无色,质地软,如稀泥的,红色荧光蛋白的细胞极少,多呈圆柱形、椭球形及部分不规则细胞,且较为分散。图5,图6
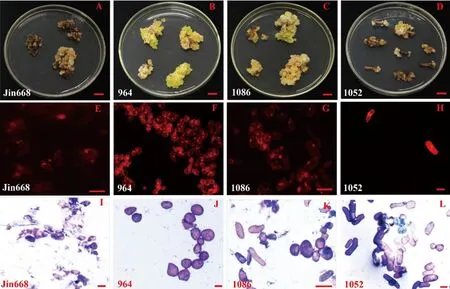
注:A~D.Jin668、964、1086和1052培育4个月后的愈伤组织;E~H.Jin668、964、1086和1052培育4个月愈伤组织中的红色荧光蛋白;I~L.Jin668、964、1086和1052培育4个月后愈伤组织的细胞形态(甲苯胺蓝染色).A,B,C,D的bars值为1cm,E、F、G、H、I、J、K、L为100 μm

注:A,D.海岛棉1010和1103培育4个月后的愈伤组织;B,E.1010和1103培育4个月后愈伤组织中的红色荧光蛋白;C,F:1010和1103培育4个月后愈伤组织的细胞形态(甲苯胺蓝染色).A和D的bars值为1 cm,B、C、E、F为100 μm
在2,4-D诱导培养条件下,筛选出964和1086两份海岛棉材料能够获得较高质量的愈伤组织和转化效果。
3 讨 论
3.1 海岛棉愈伤组织细胞对2,4-D培养基的诱导响应
植物组织再生中愈伤组织的诱导增殖、体细胞胚的形成和植株再生3个阶段尤为重要[1],而高质量的愈伤细胞是获得胚性愈伤及再生植株的前提。通过向培养基中添加适宜浓度的2,4-D,能够使细胞快速分化,过高或过低则会使细胞无法增殖或者死亡。研究利用改良后的2,4-D培养基进行海岛棉愈伤组织诱导和红色荧光蛋白的转化。在相同培养时间,海岛棉比陆地棉Jin668的愈伤组织增殖更快。但不同海岛棉品种愈伤组织对2,4-D浓度的响应程度差异很大,这可能由于品种基因型的不同对2,4-D要求有差异,也与新疆海岛棉某些关键的特异基因在其特定组织中的表达量不同有关[17]。棉花作为一种较难获得体细胞培养的作物,体胚发生能力受基因型影响较大[18-19]。
3.2 影响棉花愈伤组织表型和增殖速度的因素
研究中,不同海岛棉材料愈伤组织表型各有差异,其中淡黄色疏松的愈伤组织明显比棕色或者褐色的材料增殖快,这与前人的研究结论一致[18];并且增殖较快的品种,其荧光蛋白的转化率相对较高。而部分品种出现了褐化的现象,可能与受外植体本身遗传物质、生理状态及培养条件有关。因为材料中原生质体酶的活性和棉酚的含量都会影响愈伤组织的表型,褐化会导致SOD酶、 IAA氧化酶和CAT酶活性的降低,以及蛋白合成的减少[20],从而减缓或阻碍愈伤组织发育速度,最终导致无法形成体细胞胚。导致棉花愈伤组织生长缓慢、褐化的主要诱因与培养基氮源配比也有关[21]。品种的基因型、培养基配比、激素条件等,都会影响海岛棉愈伤组织的增殖。
3.3 海岛棉愈伤组织增殖过程培养时间
细胞培养时间过长会引起再生植株发生畸变[22]。在研究中,利用OD值为0.6的农杆菌介导的红色荧光蛋白浸染海岛棉下胚轴,浸染8~10 min,于2,4-D培养基上培养4~7个月后,发现愈伤组织的诱导增殖过程,与培养时间并不呈正相关;超过4个月,部分材料的愈伤组织增殖缓慢,甚至停滞或者死亡,可能与选取的培养组织,菌液浓度及浸染时间有一定关系[23],同时还受到材料自身愈伤细胞的活性的影响。这些影响过程,还需要后期进一步进行梯度实验验证。
4 结 论
海岛棉下胚轴经改进后的组织转化体系培养28 d后,下胚轴两端呈现不同的质地,颜色和状态;改良后的2,4-D诱导培养基可有效用于海岛棉下胚轴愈伤组织再生。培养4个月是愈伤组织快速增殖的最佳时期,此时有60.86%的海岛棉材料愈伤增重可达到0.201~0.5 g。当培养时间延长,愈伤组织增殖缓慢;随着培养时间增加,愈伤会呈现不同的颜色和质地。愈伤增殖较快的材料其红色荧光蛋白转化率也比较高。根据培养时间,增殖速率和转化效率,筛选出9份愈伤增殖较快的海岛棉材料。

