利用基因芯片分析比较Giza75和SG747纤维发育差异表达基因
宋吉坤,辛 玥,李龙云,刘国元,裴文锋,马建江,曲延英,于霁雯,吴 嫚
(1.中国农业科学院棉花研究所/棉花生物学国家重点实验室,河南安阳 455000; 2.新疆农业大学农学院/教育部棉花工程研究中心,乌鲁木齐 830052)
0 引 言
【研究意义】我国棉花每年种植面积约333.33×104hm2(5 000万亩),借助检测海岛棉和陆地棉棉纤维发育过程中基因的转录水平变化,阐明关键基因的表达模式,有助于解析调控棉纤维品质的分子机制,对棉花纤维品质遗传改良有重要意义。【前人研究进展】棉属包括46个二倍体棉种(2n= 2x= 26)和5个异源四倍体棉种(2n= 4x= 52)。异源四倍体棉花品种起源于A基因组和D基因组的自然杂交[1],其中包括两个商业上重要的栽培品种陆地棉(GossypiumhirsutumL.)和海岛棉(GossypiumbarbadenseL.)。陆地棉适应性广,产量高,占全球棉纤维产量的90%以上,而海岛棉纤维品质好,占5%~8%。在形态、生理、抗虫性、特别是皮棉产量和纤维品质等方面存在着显著的种间差异。尝试把海岛棉的优良基因转移到陆地棉中,但因种间杂交后代分离严重一直未获得成功[2]。在利用经典的遗传学和数量遗传学开展了陆海杂交群体纤维品质和产量性状的QTLs定位及候选基因挖掘等研究[3],但是鉴定出来的有效QTLs较少[4,5]。芯片技术为基因表达研究提供了一个大规模分析基因表达谱的平台,可以同时快速有效地分析大量的转录本。随着棉花基因组测序的完成,大规模的棉花组装分析应用于设计高通量的基因芯片的研究越来越多,主要应用在棉花纤维胚珠或纤维功能基因组的研究[6,7]。以往的基因表达谱研究主要集中在单一品种或突变体上,以获得纤维起始和伸长的候选基因,Alabadyet等[8]利用基因芯片技术对陆地棉和海岛棉纤维之间的变化进行评估,确定了特定物种和生育期基因转录水平。Wu等[9]利用Affymetrix公司的棉花基因芯片对棉纤维长度性状存在显著差异的两组回交近交系进行差异表达基因分析,并结合qRT-PCR发现GhACX和GhKIF与纤维发育存在密切关系。【本研究切入点】目前许多与纤维发育相关的基因已经被鉴定出来[10-12],但是海岛棉和陆地棉之间纤维品质差异的生物学原因还很少被报道。需研究Giza75和SG747纤维发育差异表达基因。【拟解决的关键问题】以SG747(GossypiumhirsutumL.)和Giza75(GossypiumbarbadenseL.)为材料,利用Affymetrix公司的棉花寡聚核苷酸基因芯片对其开花后10 d(10 days after anthesis, 10 DPA)的棉纤维进行表达谱分析,为棉纤维发育关键候选基因的功能验证提供的理论支撑。
1 材料与方法
1.1 材 料
以海岛棉Giza75和陆地棉SG747为材料,分别剥取5、10、15、20和25 DPA棉铃的纤维以及叶片、花瓣和花蕾,收集后迅速浸入液氮中进行速冻,保存在 -80℃冰箱中备用。每个样品取3个生物学重复。田间试验地点在河南省安阳县白璧镇中棉所试验基地进行(36°06’N,114°21’E),室内试验在河南省安阳市中国农业科学院棉花研究所生物学重点实验室进行。
1.2 方 法
1.2.1 RNA提取
利用CTAB法提取5、10、15 、20、25 DPA的纤维及叶片、花瓣、花蕾的总RNA[13]。每个样品3个生物学重复分开提取RNA。用1.5%琼脂糖凝胶电泳检测总RNA的完整性及纯度。利用DU800核酸/蛋白质分析仪(Beckman Coulter,Brea,CA,USA)检测RNA的质量和浓度。
1.2.2 基因芯片的制备及差异表达基因的筛选
GeneChip®棉花基因组芯片购自美国Affymetrix公司,基因芯片杂交及分析由上海晶泰生物技术有限公司完成。分别以Giza75和SG747纤维发育10 DPA的3个生物学重复混合而成的RNA池与GeneChip®棉花基因组芯片杂交,方法同Li和Wu等一致[14,15]。以陆地棉SG747纤维发育10 DPA的芯片杂交结果为对照,以海岛棉Giza75与陆地棉SG747的Log2Ratio值确定上下调基因。
1.2.3 差异表达基因的功能预测
将筛选获得的差异表达基因利用COG数据库(Clusters of orthologous groups)和COGNITOR程序(http://www.ncbi.nlm.nih.gov/COG/)对其进行功能预测分析[15]。
1.2.4 qRT-PCR分析
利用Prime ScriptII第一链cDNA合成试剂盒将RNA合成cDNA(宝生物工程大连有限公司)。从差异表达基因中随机挑选差异表达显著的4个基因,使用Oligo软件设计引物,以看家基因Actin为内参对照,利用SYBRGREEN PCR MASTER MIX(美国应用生物系统公司)在Light Cycler480荧光定量PCR仪(Roche公司)对4个差异表达基因进行分析。上海英骏生物技术有限公司负责引物合成,每个样品qRT-PCR设置3个生物学重复。表1

表1 qRT-PCR所用基因及其引物序列Table 1 Gene Primers for quantitative RT-PCR analysis
1.3 数据处理
Giza75和SG747的2006-2008年纤维品质和产量数据引自Yu等[13]。利用SAS软件对Giza75和SG747的纤维长度、强度、马克隆值、伸长率、整齐度指数、籽棉产量、皮棉产量、衣分和铃重进行Duncan Grouping显著性分析,检验各性状种间差异的显著性。
2 结果与分析
2.1 陆地棉和海岛棉纤维品质与产量性状比较
研究表明,除伸长率以外,陆地棉SG747和海岛棉Giza75的纤维长度、马克隆值、断裂比强度、整齐度指数、籽棉产量、皮棉产量、衣分和铃重存在显著性差异。海岛棉Giza75的纤维长度为34.09 mm,纤维强度高达40.39 mm,马克隆值为4.57,而其铃重为3.62 g,衣分为36.92%,籽棉产量为70.95 kg/667m2,皮棉产量为26.68 kg/667m2。海岛棉和陆地棉之间可能存在着基因转录水平上的差异。表2

表2 陆地棉与海岛棉的纤维品质和产量性状差异Table 2 Fiber quality andyield difference between G. hirsutum and G. barbadense
2.2 差异表达基因分析及功能预测
研究表明,棉花基因组芯片共有24 029个探针组成,其中Giza75有12 837个探针信号检测到(53%),SG747有13 387个探针信号检测到(56%)。筛选到3 095个差异表达基因,其中在1 680个基因在Giza75中高表达,而1 415个基因在Giza75中低表达。
2个材料3 095个差异表达基因进行功能分类,共分为15类。其中功能预测基因占比17.80%,翻译、核糖体结构相关基因占比16.82%,翻译后修饰占比14.32%。根据P< 0.05、Log2Ratio > 1、 Log2Ratio < -1和基因注释挑选了20个可能在纤维发育过程中起到重要作用的基因,其中上调表达基因10个,下调表达基因10个。图1,图2

图1 差异表达基因功能分类Fig.1 Distribution of differentially expressed genes based on gene ontology functional classifications
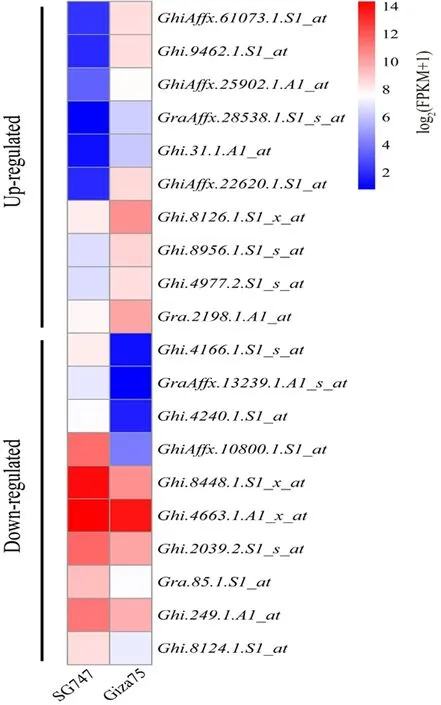
图2 纤维发育10 DPA的差异表达基因Fig. 2 Differentially expressed genes for fiber development 10 DPA
2.3 差异表达基因的实时荧光定量PCR分析
研究表明,Gra.2198.1.A1_at在Giza75的纤维发育关键时期(5、10、15 、20 DPA)和花中的表达量均超过SG747,而SG747在叶和蕾中表达量最高。Gra.2198.1.A1_at是一个纤维特异性基因。Gra.85.1.S1_at在Giza75和SG747的纤维发育不同阶段和不同组织中也存在差异表达。Gra.85.1.S1_at在Giza75的蕾中的表达量最高;而在SG747的叶片中表达量最高。Gra.85.1.S1_at在Giza75中10、15和20 DPA时表达量较低;在SG747中,Gra.85.1.S1_at的表达从5 DPA开始下降,在15 DPA时表达量最低,之后表达量一直升高到25 DPA。Ghi.249.1.A1_at在Giza75和SG747中表现出相同的表达模式:在花中表达最高,在纤维中几乎没有表达。在10 DPA时,Ghi.249.1.A1_at在SG747中表达量高于Giza75,这与基因芯片得到的结果一致。Ghi.8448.1.S1_x_at在花中的表达量最高,而在纤维中10 DPA的表达量最高且在两个材料中存在显著性差异,表明该基因也是一个纤维特异基因。图3,图4

A:Gra.2198.1.A1_at B: Gra.85.1.S1_at

C: Ghi.249.1.A1_at D: Ghi.8448.1.S1_x_at.
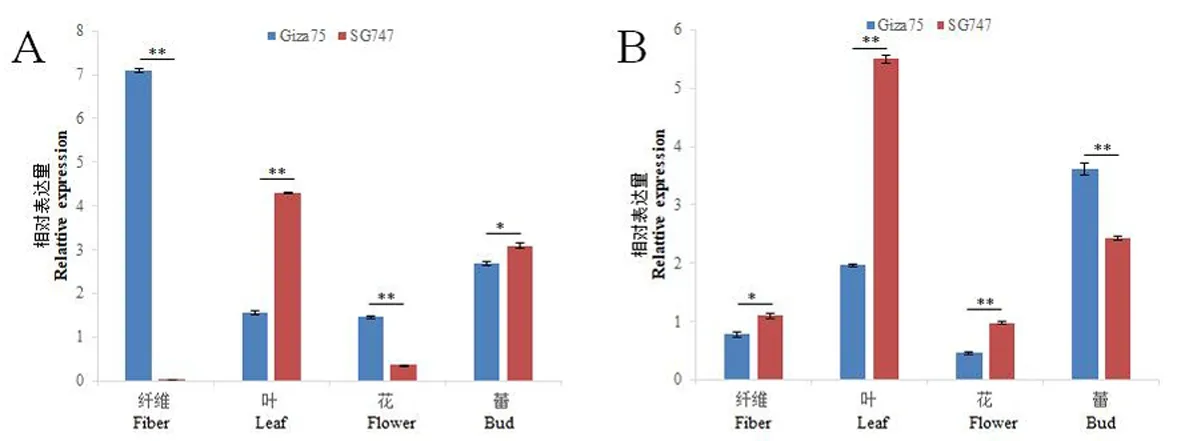
A:Gra.2198.1.A1_at B: Gra.85.1.S1_at;
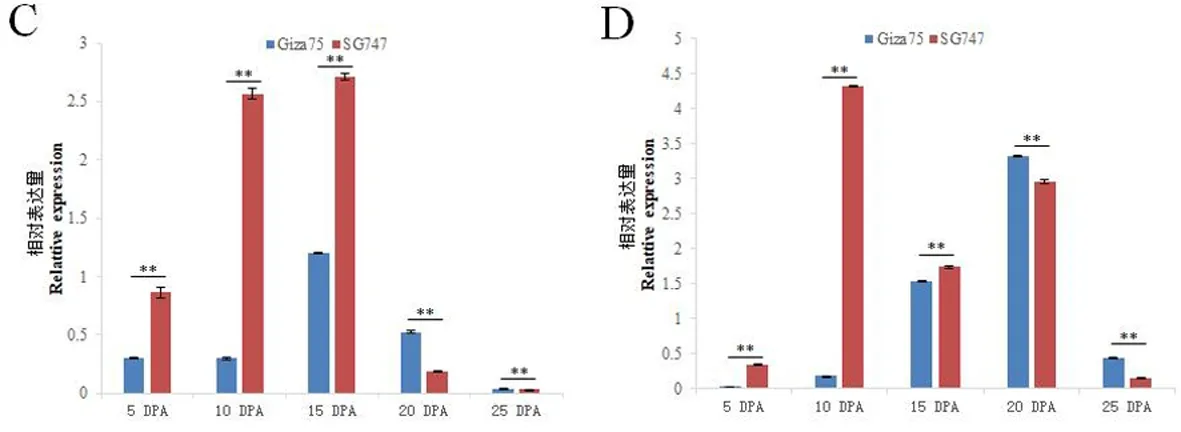
C: Ghi.249.1.A1_at D: Ghi.8448.1.S1_x_at.
3 讨 论
3.1 Giza75和SG747在表型、DNA和基因表达的差异
海岛棉Giza75和陆地棉SG747在产量和纤维品质上的差异与以往研究[16-18]的结果一致,且在两个材料中的差异达到显著水平,这2个材料适合进行差异基因表达分析。在2580对SSR引物中,有1258对引物检测到两种基因型的多态性,占48.76%。其中EST-SSR多态性占18.84%[18]。利用基因芯片技术分析了海岛棉与陆地棉基因表达的差异,共获得24029条转录本,其中差异表达的转录本有5757条,在总转录本中占比23.96%。其中差异表达倍数在2倍或2倍以上的转录本有3095条,在总转录本中占比12.88%[19]。利用COG数据库将3095条转录本按照功能分为:其中功能预测基因占比17.80%,翻译、核糖体结构相关基因占比16.82%,翻译后修饰占比14.32%。结果表明,海岛棉与陆地棉的基因型差异为48.76%,占差异表达转录本(23.96%)的2倍。并不是所有的基因型差异都会引起影响基因表达量的差异。因为有些基因表达差异是由序列差异引起的,也可能会影响基因芯片上的杂交信号[20]。海岛棉Giza75和陆地棉SG747在品质和产量性状中都存在显著差异,是研究DNA水平差异的优异材料。
3.2 陆地棉和海岛棉之间差异表达候选基因的功能预测
根据P值、Log2 Ratio和基因注释挑选了20个可能在纤维发育过程中起到重要作用的基因,结合前人研究,对4个差异表达基因Gra.2198.1.A1_at、Gra.85.1.S1_at、Ghi.249.1.A1_at和GhiAffx.25902.1.A1_at进行qRT-PCR分析。
Gra.2198.1.A1_at在棉花中编码一个活化甲基循环的关键酶,S-腺苷-L-同型半胱氨酸水解酶(SAHH)。SAHH可以通过影响细胞分裂素的含量和DNA甲基化水平来调控基因的表达和发育,在抗逆境和抗病毒保护中发挥重要作用。然而,SAHH在棉花生长和纤维发育中的作用仍不清楚[21]。Li等[22]利用cDNA基因芯片在纤维细胞中检测到高表达的SAHH。SAHH通过调节,S-腺苷-L-高半胱氨酸/S-腺苷甲硫氨酸(SAH/SAM)比值影响基因的甲基化,调控基因的表达,也可能通过调节细胞分裂素水平影响植物的发育[19]。在研究中,通过基因芯片筛选到表达上调的基因(SAHH),尽管该基因在海岛棉和陆地棉中都有表达,但表达水平却大不相同。在Giza75中,SAHH基因在5 DPA和10 DPA时高表达;在SG747中的叶片和蕾中高表达。对于SAHH基因在海岛棉Giza75和陆地棉SG747中的作用还需要进一步研究。
Gra.85.1.S1_at编码纤维素合成酶(CesA)的催化亚基。CesA的氨基末端有一个锌指状结构域,该结构域对于蛋白质对和特定降解非常重要[23]。在植物组织和细胞壁发育阶段参与纤维素合成的酶不同[24],棉花纤维素的生物合成和沉积类型与次生细胞壁的形成和纤维品质密切相关[25]。最近,Zhang等[26]对4个棉种中的CesAs基因进行家族分析,发现74个纤维品质相关的QTL附近有18个GhCesA基因。研究发现Gra.85.1.S1_at的序列片段来源于雷蒙德氏棉,BLAST分析结果显示该基因与CesA4具有高度同源性。从其在棉花不同组织和不同纤维发育阶段的表达来看,CesA4不是一个纤维特异性基因。该基因在海岛棉Giza75和陆地棉SG747的叶片和蕾中有较高的表达;在海岛棉Giza75的蕾中表达量最高,而在陆地棉SG747的叶中表达量最高。
Ghi.249.1.A1_at编码一个α-扩张蛋白(α-expansin),与细胞壁扩张和纤维细胞的伸长密切相关[27]。α-expansin通过破坏纤维素微丝之间的氢键来调节细胞壁的扩张,在棉纤维伸长过程中发挥作用。Harmer等[27]研究了6个α-expansin基因(GhExp1-GhExp6)。其中,GhExp1和GhExp2为纤维特异性表达基因。GhExp1可能是纤维细胞伸长的关键基因。对正常纤维基因型和粗纤维基因型的基因表达谱的微阵列分析表明,在正常纤维基因型中,α-expansin蛋白表达与纤维长度呈正相关,而在粗纤维基因型中不表达[28]。EST数据库分析表明,4个编码α-expansin的基因在细胞伸长期高表达,但在次生细胞壁成熟时迅速减少[29],这些基因在细胞伸长期起主要作用。Li等[30]通过研究GbEXPATR发现α-expansin通过对细胞壁的疏松进而在纤维发育中起关键作用,GbEXPA2在陆地棉中过表达对成熟纤维长度没有影响,但产生的纤维壁梢厚,结晶纤维素含量增加,而在海岛棉的过表达导致纤维更长、更细、更坚固,细胞壁明显变薄。研究表明,Ghα-expansin在纤维细胞中低表达,而在花中高表达,不是一个纤维特异性基因,且该基因在陆地棉和海岛棉中的表达趋势一致。
微管已经被证实与棉花纤维发育有关[31],微管蛋白(tubulin, Tub)是微管的主要结构组成成分,它由α和β2个保守的亚基组成。在棉纤维细胞中,目前为止已经鉴定出9种α-tubulin和7种β-tubulin蛋白[32]。Li等[33]克隆了GhTUB1基因,该基因在纤维发育快速伸长期8 DPA优势表达。刘迪秋等[34]通过分析20 DPA棉纤维构建的SSH文库发现了3个β-tubulins,推测可能特异地调控棉纤维的纤维素沉积。吴嫚等[16]利用马克隆值存在显著差异的2个陆海回交近交系材料进行高通量基因芯片分析,并结合qRT-PCR分析推测出β-Tub10正向调控棉纤维发育过程,β-Tub1负向调控棉纤维发育过程。研究表明,β-Tub1在花中的表达量最高,而在纤维中10 DPA的表达量最高且在陆地棉中表达量高,表明该基因可能在纤维发育快速伸长期负向调控棉纤维发育过程。
4 结 论
分析了海岛棉Giza75和陆地棉SG747的基因表达谱,获得了3 905个差异表达基因,并对高倍表达基因和纤维发育相关基因进行了定量RT-PCR分析。Gra.2198.1.A1_at正向调控棉纤维发育过程,Gra.85.1.S1_at、Ghi.249.1.A1_at和Ghi.8448.1.S1_x_at负向调控棉纤维发育过程。

