亚麻萌发期耐盐鉴定体系优化及150份种质耐盐性综合评价
李 枭,郭栋良,李恭泽,薛 敏,江海霞,叶佳丽,谢丽琼
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
0 引 言
【研究意义】土壤盐碱化是作物生长发育过程中面临的主要非生物胁迫因子之一[1]。我国盐碱化主要分布在西北、东北、华北及滨海地区[2,3],筛选和培育耐盐作物是应对土壤盐碱化问题最经济有效的办法之一[4]。亚麻(LinumusitatissimumL.)作为一种重要的纤维和油料作物,主要种植于我国西北和华北地区[5],而西北和华北地区又是我国主要的盐碱地分布区。优化亚麻耐盐鉴定体系和筛选耐盐种质对于因地制宜地利用盐碱地、促进盐碱地亚麻栽培具有重要意义。【前人研究进展】有关亚麻萌发期耐盐鉴定体系建立和种质耐盐性评价已有一些研究。郭媛等[6]利用NaCl浓度梯度(0、50、100、150、200、250 mmol/L)处理10个亚麻品种发现200 mmol/L NaCl胁迫下相对发芽率分布最离散。于莹等[7]选用150和250 mmol/L NaCI胁迫16份亚麻品种,发现了高浓度盐溶液才能够有效区分不同品种的发芽率。M.Zaghdoudi等[8]探讨了NaCl浓度梯度(0、200、250和300 mmol/L)胁迫下对2个亚麻品种萌发的影响,在NaCl浓度高于200 mmol/L时才能明显降低发芽率。Datir.S.S等[9]研究了不同浓度的NaCl(0、25、50、75和100 mmol/L)对2种亚麻品种的种子发芽率、活力指数、相对含水量、总长度和淀粉酶的影响。赵玮等[10]利用NaCl浓度梯度(0、50、100、150、200、250 mmol/L)处理了2个亚麻品种,通过发芽率、总鲜重、根长和芽长的生长状况确定亚麻萌发期NaCI溶液的盐胁迫浓度为100 mmol/L并选用该浓度处理并综合评价了28份胡麻种质的耐盐性。【本研究切入点】亚麻萌发期耐盐鉴定体系并没有形成统一标准,并且已建立的体系中,无论从NaCl浓度梯度的设置还是样本数量都不够充分。已有的研究对于盐胁迫浓度的选用展现出不一致的结果,即不同研究中选用的NaCl胁迫浓度差异较大,单个胁迫浓度不能有效区分所有生理指标。有必要对亚麻萌发期耐盐鉴定体系作出优化。【拟解决的关键问题】选用芽长、根长和发芽率作为亚麻萌发期耐盐性鉴定的表型性状。设置13个NaCl浓度梯度(0~ 250 mmol/L)胁迫处理30份亚麻种质,针对每个指标优化盐胁迫的浓度并以此胁迫处理150份亚麻材料并进行萌发期耐盐性综合评价,优化亚麻萌发期耐盐鉴定体系,为耐盐种质资源的筛选和耐盐功能基因研究奠定基础。
1 材料与方法
1.1 材 料
试验于2019年在新疆大学生命科学与技术学院分子育种实验室进行。供试亚麻材料源于该课题组构建的核心种质资源[11],从中选取油用亚麻、纤用亚麻、兼用亚麻各50份,共150份种质。所有材料均由新疆大学生命科学与技术学院分子育种实验室保存。
1.2 方 法
1.2.1 耐盐评价体系建立
从150份种质中随机挑选30个亚麻种质材料,设置0(对照,蒸馏水)、50、75、100、125、150、175 、200、210、220、230、240、250 mmol/L的NaCl梯度盐溶液。每个品种挑选出饱满完整的种子置于1.5 mL EP管中,1%NaClO浸泡10 min,无菌水冲洗2至3次后,放置在垫有2张中性滤纸(φ 9 cm)的1次性塑料培养皿(φ9 cm)中[12],每个培养皿中50粒种子。盐胁迫的培养皿中加入15 mL的NaCl溶液,对照组加入15 mL蒸馏水,置于24±2(℃),光照16 h/黑暗8 h,光照强度为5 000lx的恒温光照培养箱中培养。在培养第3 d补加对应浓度的盐溶液4 mL使培养皿内的各离子浓度保持相对稳定。各处理重复3次。培养7 d后统计各培养皿种子的发芽率(germination rate,GR),同时随机选取10株利用扫描仪结合Image J 1.8.0软件测量亚麻的芽长(shoot length,SL)和根长(root length,RL)。
1.2.2 种质耐盐性筛选
在亚麻萌发期,以相对芽长和相对根长为指标时,适宜的NaCl胁迫浓度为100 mmol/L;而以相对发芽率为指标时,适宜的NaCl筛选浓度为220 mmol/L。用100和220 mmol/L浓度NaCl溶液分别处理150份亚麻材料。
1.2.3 耐盐性综合评价
各指标相对值被用于衡量种质耐盐性的差异,包括相对发芽率(relative germination rate,RGR)、相对芽长(relative shoot length,RSL)和相对根长(relativeroot length,RRL)。发芽率=发芽种子数/参试种子数×100%;盐胁迫下各性状的相对值=NaCl胁迫处理测定值/对照测定值。综合RGR、RSL和RRL计算加权隶属函数值(D值),对供试亚麻种质萌发期的耐盐性进行综合评价。计算D值[13]:
μ(Xi)=(Xi-Xi min)/(Xi max-Xi min) .
(5)
(6)
(7).
式中,Xi表示各材料基于指标i的相对值,Xi max和Xi min分别表示Xi的最大值和最小值,μ(Xi)表示各材料基于Xi的隶属函数值。CVi为μ(Xi)的变异系数,Wi表示μ(Xi)的变异与总变异的比率即权重。D值表示各指标隶属函数值μ(Xi)与其权重Wi乘积的累加,代表多个指标对各品种耐盐性进行综合评价。
1.3 数据处理
利用Excel 2016软件整理试验数据,使用SPSS Statistics 26软件进行数据分析,使用Graphpad prism 5软件绘图。
2 结果与分析
2.1 不同浓度 NaCl胁迫对亚麻萌发的影响
研究表明,随着NaCl溶液浓度逐渐升高,亚麻的生长被明显的抑制。根长和芽长对盐浓度表现出极度的敏感,在低浓度NaCl溶液(50、75和100 mmol/L)胁迫下,芽长分别降低到对照的79%、48%和33%,根长分别降低到对照的71%、43%和18%。当NaCl溶液浓度升高至175 mmol/L,根长和芽长几乎被完全抑制,仅为对照的1%和2%,故高于175 mmol /L NaCl浓度的处理组将不再统计芽长和根长。相较于根长和芽长,发芽率对盐胁迫表现出更高的耐受性。在低浓度NaCl溶液(50、75和100 mmol/L)胁迫下,发芽率与对照相比没有表现出明显差异(均接近100%)。当NaCl溶液浓度升高至175 mmol/L时,发芽率才出现较明显下降。当NaCl溶液浓度达到220 mmol/L时,发芽率降低至对照的一半以下(40%)。不同指标对盐胁迫的敏感度不一样,芽长和根长在较低浓度的盐胁迫下即可表现出明显的抑制,而发芽率在较高浓度的盐胁迫下才能表现出差异。图1,表1
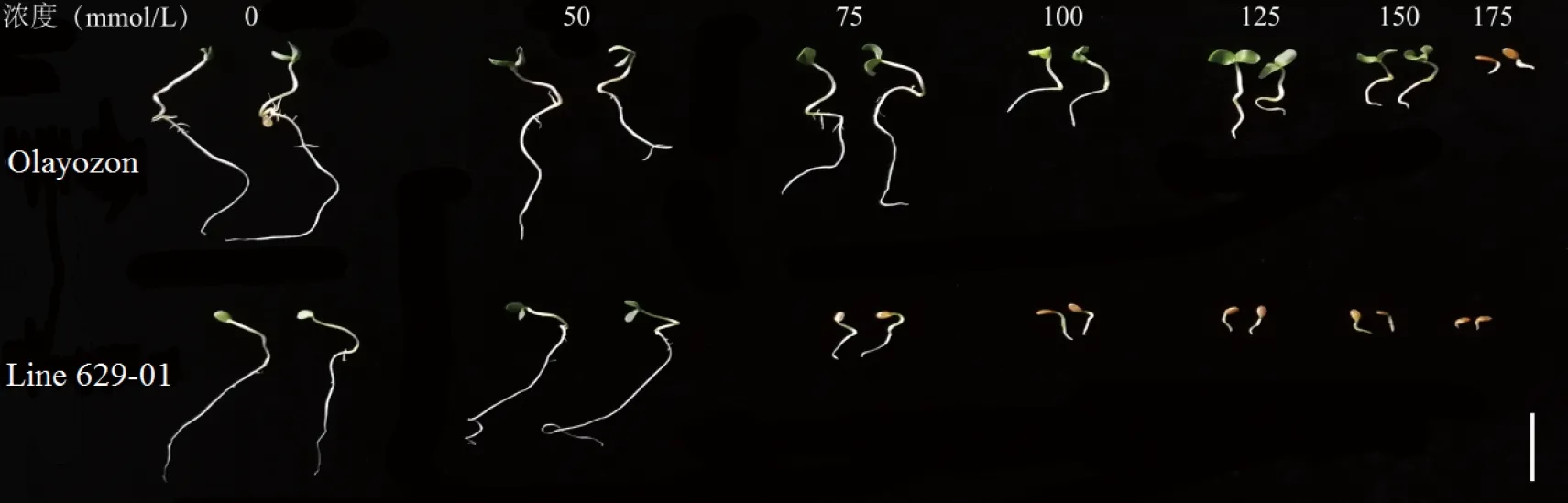
图1 不同浓度NaCl溶液胁迫下2个亚麻种质Olayozon和Line 629-01萌发7 d生长变化(比例尺=1cm)Fig.1 The growth of two flax germplasm Olayozon and Line 629-01 under the stress of different concentrations of NaCl solution after germination for 7 days(bar=1cm)

表1 不同浓度盐胁迫下30份亚麻种质萌发期各指标的耐盐系数变化Table 1 Salt tolerant coefficient of each single index of 30 flax germplasm during germination under different concentrations salt stress
2.2 不同生理指标下NaCl适宜胁迫浓度
研究表明,在50 ~ 175 mmol/L NaCl浓度梯度胁迫下芽长和根长均表现出明显的抑制,RSL和RRL的变异系数(CV)表现为先增高后降低的趋势,且均在100 mmol/L的NaCl胁迫下最大,分别为60.73%和70.59%。以RSL和RRL为指标时适宜的NaCl胁迫浓度为100 mmol/L。在此NaCl浓度胁迫下,种子发芽率与对照相比没有差异(平均RGR≈1),100 mmol/L的NaCl胁迫对发芽率没有影响,该浓度不能有效区分盐胁迫下各种质发芽率的差异。随着NaCl浓度的增加,在220 mmol/L 时,出现受试种子全部不萌发RGR最小值为0的情况,此时部分亚麻种质最大RGR值仍高达0.9,受试群体平均RGR为0.4,变异系数达58.55%。随着NaCl胁迫浓度继续升高至230 ~ 250 mmol/L,越来越多品种RGR趋于0导致RGR的变异系数仍在增大,不过数据的离散程度显著降低,当以RGR为指标时适宜的NaCl筛选浓度为220 mmol/L。不同耐盐指标的最适NaCl筛选浓度不同,同一盐胁迫浓度不能有效区分不同生长指标。表1,图2
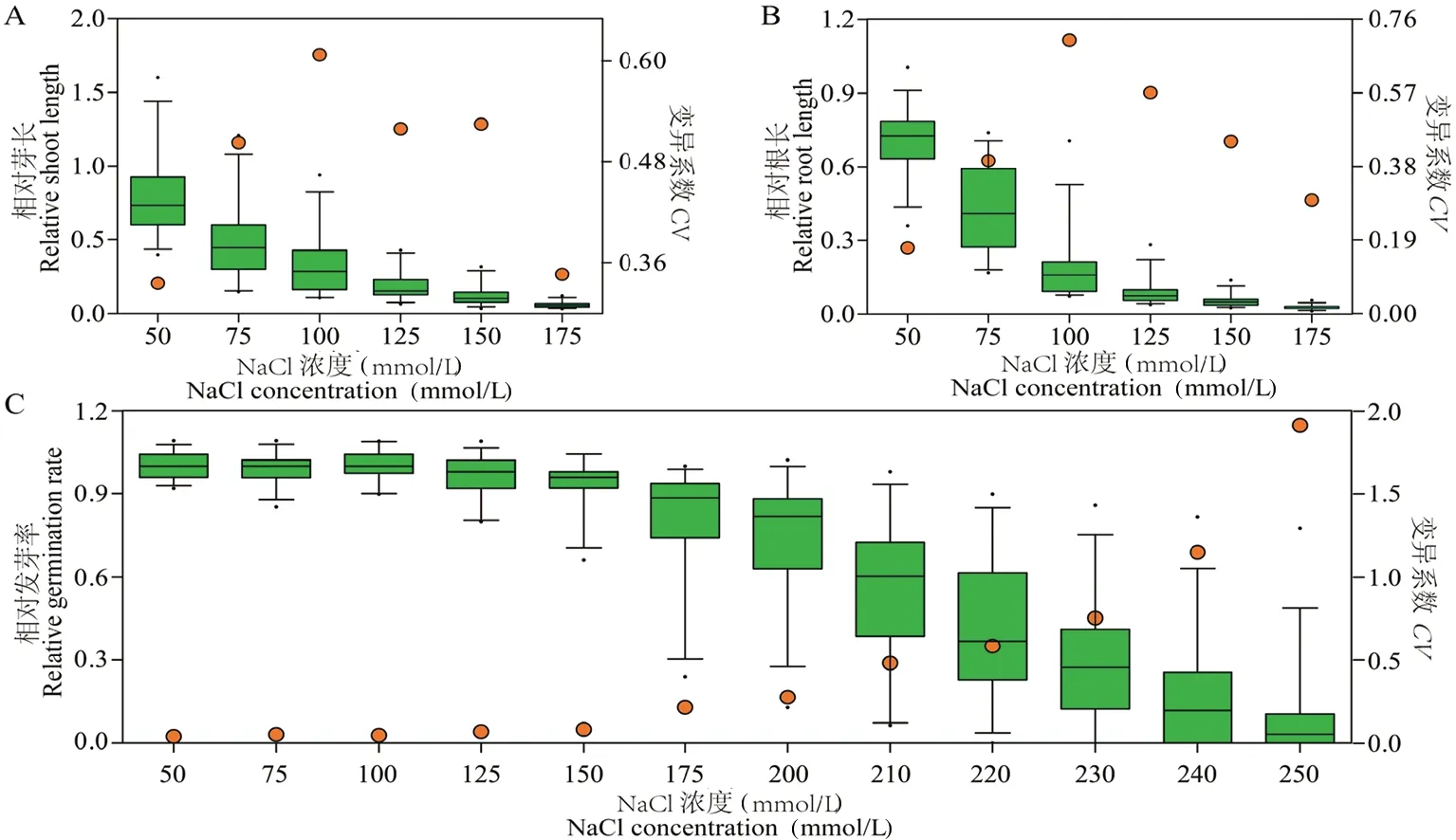
注:在箱线图中,最上方和最下方的线段分别表示数据的最大值和最小值,其中箱线图的上方和下方的线段分别表示第三四分位数和第一四分位数,箱线图中间的线段表示数据的中位数。另外,在最上方和最下方的黑色圆点分别表示样本数据中的极端值。橙色圆点表示变异系数(CV)。下同
2.3 150份亚麻种质萌发期耐盐性综合评价
研究表明,与正常条件相比,盐胁迫下芽长、根长和发芽率都受到显著的抑制。3个鉴定指标 SL、RL和GR在盐胁迫条件下的平均值比对照条件下的平均值分别减小了81.60%、80.62%和39.07%,变异系数为对照的6.67、2.86和5.07倍,优化后的耐盐性鉴定体系能反映NaCl对亚麻种子萌发的抑制效果,基于这些指标可以有效区分不同品种的耐盐性。表2,图3
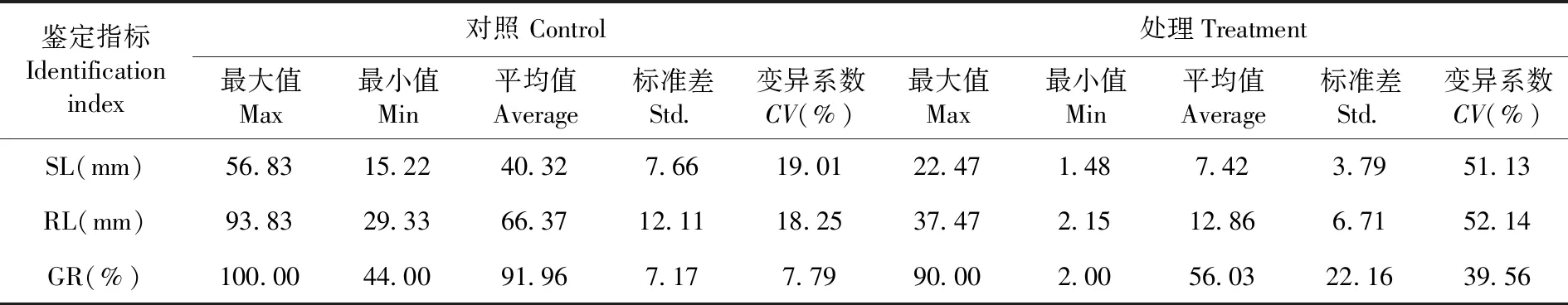
表2 150份亚麻种质在盐胁迫和对照条件下各指标的变异Table 2 Variation analysis of 150 flax germplasm under salt stress and control conditions

图3 盐胁迫下150份亚麻种质芽长、根长和发芽率变化Fig.3 Effects of salt stress on shoot length, root length and germination rate of 150 flaxgermplasm
优化的耐盐性鉴定体系能够使耐盐系数RSL、RRL和RGR呈现出丰富的变异。μ(RGR)的变异系数和权重最小,μ(RSL)和μ(RRL)变异系数和权重相当且都较大。μ(RGR)、μ(RSL)、μ(RRL)和D值进行相关性分析,μ(RSL)和μ(RRL)表现出最高的相关性(R=0.910,P=1.542×10-58),μ(RSL)和μ(RRL)在评价亚麻萌发期耐盐性方面一致性高。而μ(RGR)与μ(RSL)或μ(RRL)表现出低相关(R=0.193,P=0.018;R=0.238,P=0.003,分别),μ(RGR)与μ(RSL)或μ(RRL)在评价亚麻萌发期耐盐性方面一致性低。D值与这些指标隶属函数值均呈极显著正相关(P<0.001),D值可以用来综合评价供试亚麻萌发期的耐盐性。表3,表4
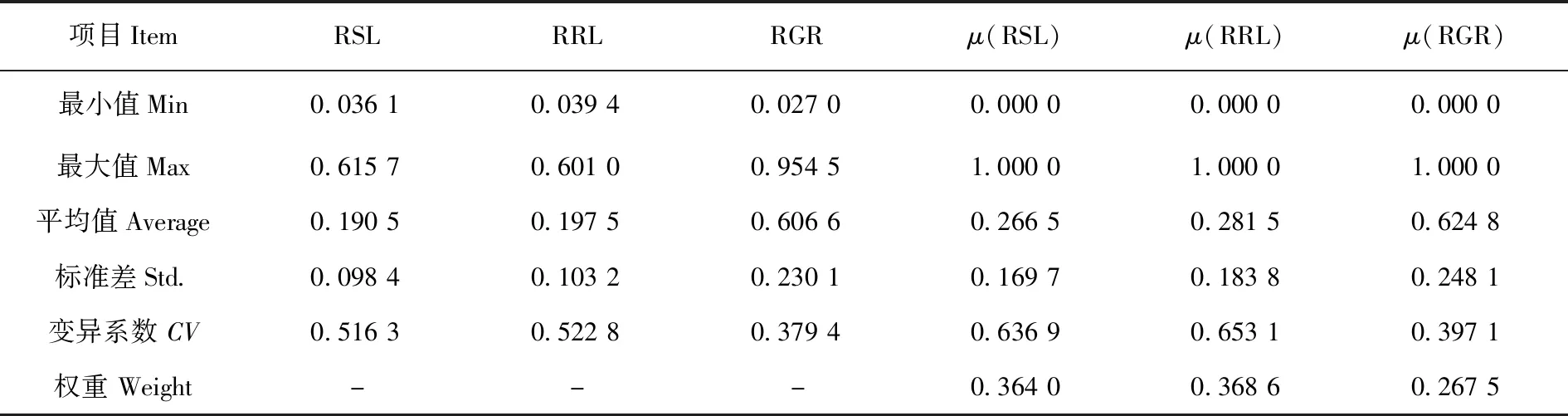
表3 基于不同鉴定指标的耐盐系数和隶属函数值Table 3 Salt tolerance coefficient and membership function values based on different identification indices
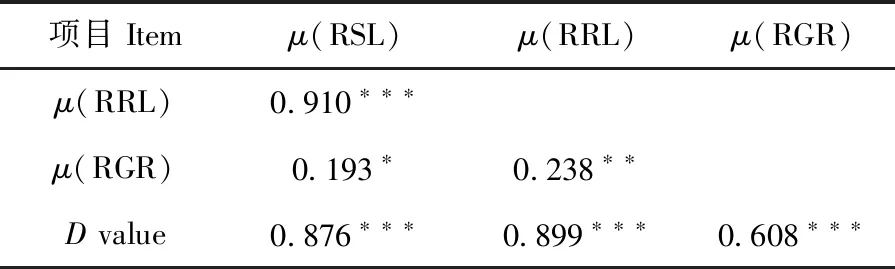
表4 各指标隶属函数值与D值相关性Table 4 Correlation analysis ofeach index membership function value and D value
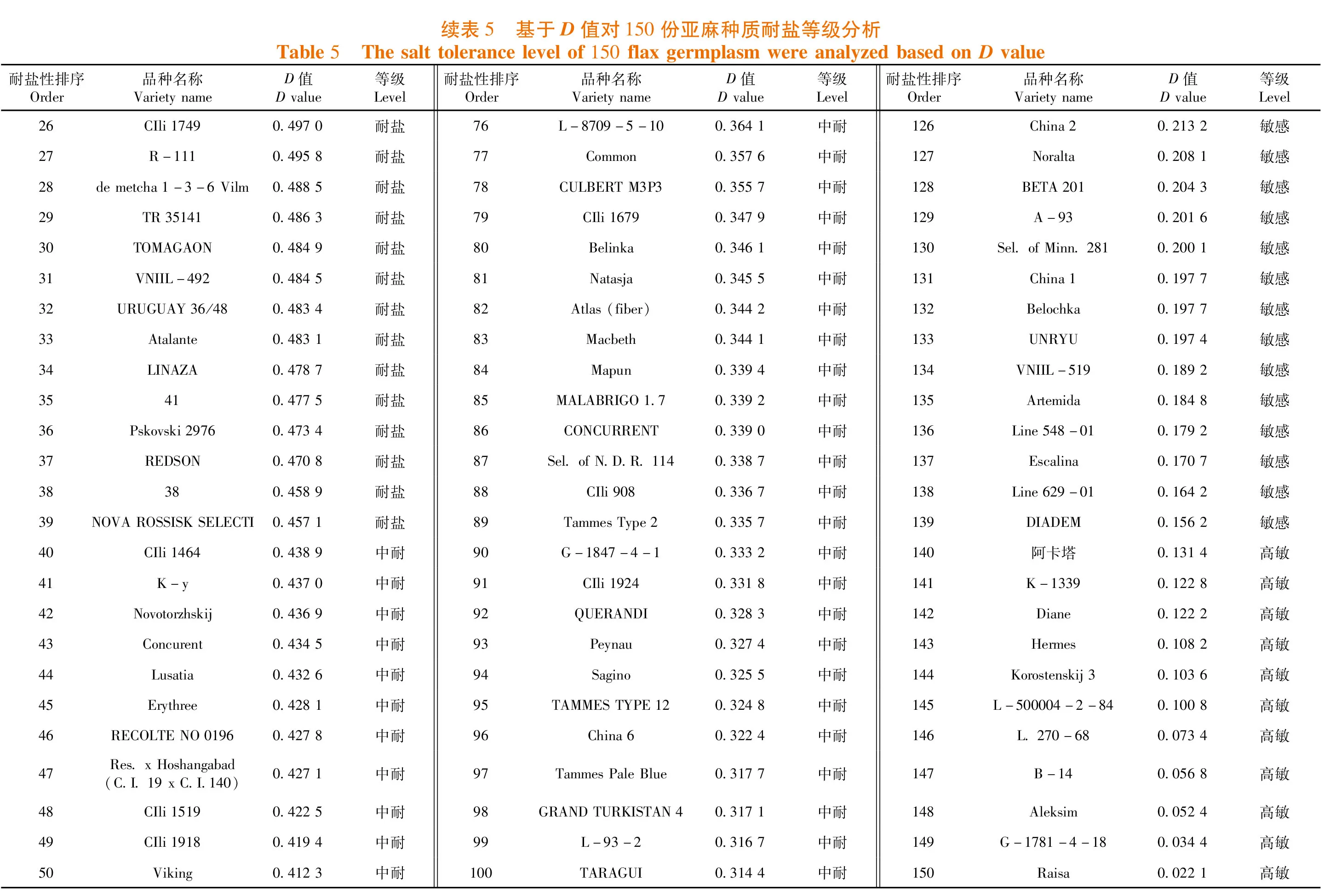
D值变化范围为0.022 1~0.956 7,ALSEE的D值最大为0.956 7,其对盐胁迫的耐受性最强,而Raisa的D值最小为0.022 1,其对盐胁迫最敏感。根据供试亚麻种质的D值进行聚类分析,150份亚麻种质被划分为5个类群,依据D值从大到小对应5个耐盐等级,其中高耐等级种质3份(2%,占总数,下同)、耐盐等级种质36份(24%)、中耐等级种质67份(44.7%)、敏感等级种质33份(22%)、高敏等级种质11份(7.3%)。表5
2.4 亚麻不同亚群间萌发期耐盐性的差异
研究表明,随着耐盐等级的提高,不论是单一指标还是D值,纤用亚麻所占比例都在不断下降,而油用亚麻所占比例都在不断升高,兼用亚麻则居于两者之间。在高耐级别中,除RGR外,其余指标中纤用亚麻占比为0,而油用亚麻占比为100%,在高敏级别中,纤用亚麻占比65%~90%不等,而油用亚麻占比仅为8%~15%。油用亚麻群体中RGR、RSL、RRL和D值均显著高于纤维亚麻和兼用亚麻(除RGR中油用亚麻和兼用亚麻无差异)。油用亚麻对盐胁迫的耐受性要强于兼用亚麻和纤维亚麻,纤用亚麻对盐胁迫的耐受性最差。图4
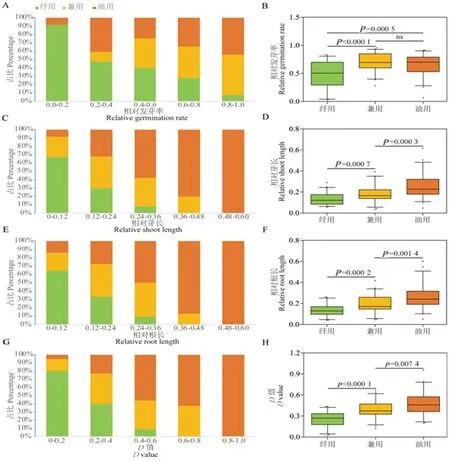
注:(A,C,E,G)亚麻不同亚群盐胁迫下各耐盐系数的分布。(B,D,F,H)亚麻不同亚群间各耐盐系数的箱线图。A和B:相对萌发率;C和D:相对芽长;E和F:相对根长;G和H:D值

3 讨 论
植物的耐盐性是由多个数量性状基因座(QTL)调控的复杂性状[14]。由于植物耐盐机制的复杂性以及遗传基础的多样性,对植物耐盐性作出全面、有效的评价涉及多方面的考虑[15]。以往的研究往往利用多个指标综合评价植物萌发期的耐盐性[10,16-19],但由于不同生理指标间可能存在交互作用导致某一类指标的权重被放大,会使耐盐性评价效果受到影响,指标并不是越多越好[12]。赵玮等[10]利用11个指标对28份胡麻进行耐盐性综合评价,通过主成分分析将11个指标转化成3个主成分(累计贡献率87.213%),分别代表种子萌发情况、下胚轴和胚根长势情况。基于少数生理指标的选择也可以作为作物抗盐胁迫筛选的有效标准[20]。研究选用芽长、根长和发芽率为生理指标来评价亚麻萌发期耐盐性。
亚麻萌发过程中,低浓度的NaCl溶液胁迫能够提高部分亚麻种质的发芽率并促进芽、根的伸长,这与前人研究结果一致[6,10,21]。当NaCl溶液浓度为175 mmol/L时,根长和芽长几乎被完全抑制,而此浓度下发芽率才开始出现较明显下降,当浓度达到250 mmol/L时,个别材料仍保持较高发芽率,芽长和根长对盐胁迫的敏感度远高于发芽率,以发芽率作为亚麻萌发期鉴定指标适宜的盐浓度较高,前人对亚麻的研究中也发现这一现象[6-8]。固定胁迫浓度不适用所有指标的评价,单一浓度胁迫的评价体系可能导致某些指标作用被低估。研究利用13个NaCl浓度梯度(0~250 mmol/L)对30份亚麻种质进行胁迫处理。基于变异系数筛选各鉴定指标适宜的NaCl 胁迫浓度,以RSL或RRL为指标时适宜的NaCl胁迫浓度均为100 mmol/L,与赵玮等[10]的研究结果一致。以RGR为指标时适宜的NaCl筛选浓度为220 mmol/L,与郭媛[6]、于莹[7]、M.Zaghdoudi[8]等的研究结果相当。同时,不同NaCl浓度各指标的变异系数的变化也表明,筛选出的适宜胁迫浓度下的各指标均达到良好评价效果。此外,研究玉米[22]、花生[23]等作物耐盐性时提出,单一浓度难以准确反映各品种的耐盐性强弱,有必要综合几个浓度进行耐盐性评价。
试验结果表明,NaCl 胁迫浓度为100 mmol/L时,RSL和RRL在评价亚麻萌发期耐盐性方面表现出高度的正相关,盐胁迫对于亚麻萌发期生长的影响可能是全面的,萌发期的芽和根对于盐胁迫的耐受表现出一致性。在NaCl筛选浓度为220 mmol/L时,尽管RGR能很好区分不同亚麻种质的耐盐性,但μ(RGR)与μ(RSL)或μ(RRL)表现出低的相关性,盐胁迫下亚麻种子的萌发和胚根、胚芽的生长应对胁迫的机制不同。高盐对植物的损伤主要是渗透胁迫和离子毒害[24],种子萌动时主要受到渗透胁迫,外界环境中高离子浓度形成的低水势抑制了种子的吸胀作用从而抑制了种子萌发[25],而幼苗胚根、胚芽的生长则受到渗透胁迫和离子毒害的协同作用,体内Na+、Cl-等离子富集产生离子毒害并引起体内K+等营养元素失衡而造成幼苗生长受到严重抑制。
油用亚麻亚群中RGR、RSL、RRL和D值均显著高于纤维亚麻亚群和兼用亚麻亚群,这些结果表明,油用亚麻对盐胁迫的耐受性要强于兼用亚麻和纤维亚麻,这与郭媛[6]和郭栋良[12]等的研究结果一致。前人研究认为油用亚麻是栽培亚麻的祖先,兼用亚麻是从油用到纤用亚麻驯化过程的中间型,与纤用亚麻相比,油用亚麻遗传多样性更为丰富[11,26,27]。研究显示在高耐盐材料中(D>0.6),油用亚麻占70%,兼用亚麻占30%,不包含纤维亚麻,盐胁迫抗性位点主要集中在油用亚麻中,这些材料可在亚麻育种中使用。
4 结 论
不同耐盐指标的最适筛选浓度不同。在亚麻萌发期,相较于芽长和根长,发芽率对盐胁迫具有更高的耐受性,确定了当以相对根长或相对芽长作为耐盐性鉴定指标,适宜的NaCl筛选浓度为100 mmol/L;当以相对萌发率作为耐盐性鉴定指标,适宜的NaCl筛选浓度为220 mmol/L。筛选出高耐材料共3份;耐盐材料共36份;中耐材料共67份;敏感材料共33份;高敏材料共11份。3份高度耐盐材料(ALSEE、OLEIFERA和CIli 2038)可用于亚麻耐盐育种。亚麻耐盐能力为油用>兼用>纤用。

