当归补血汤通过miR-27a/TGF-β1/Smad3通路抑制HK-2细胞纤维化作用及机制研究
赵烨,葛凡,李子航,朱景天,薛梅
(1.南京中医药大学药学院,江苏 南京 210023;2.南京中医药大学中医学院·中西医结合学院,江苏 南京 210023)
糖尿病是一种终身代谢性疾病,由多种原因引起,其特征是慢性的高血糖,已知并发症最多。糖尿病肾病(Diabetic nephropathy,DN)是糖尿病发展过程中常见且难治性的微血管并发症[1]。大量临床数据都表明肾间质纤维化是DN肾损伤的重要环节[2]。目前研究证实,肾脏纤维化调控机制涉及多条信号转导通路,其中关注度较高的致纤维化因子是转化生长因子(TGF)-β,而参与肾脏纤维化的因子主要以TGF-β1为主。TGF-β1信号传导包括Smads家族中Smad2和Smad3,在大量肝脏、肾脏以及心脏纤维化研究中,TGF-β1/Smad3信号通路发挥重要作用[3]。有研究表明,miR-27a通过影响肾纤维化、线粒体功能障碍和内质网应激参与DN[4]。体外研究发现miR-27a可通过靶向抑制PPARγ而诱导NRK-52E细胞纤维化,其机制可能与TGF-β1/Smad3通路的激活有关[5]。
当归补血汤是由黄芪和当归以5∶1组成的中医经典方剂,已传承数千年,是主治气血虚发热症的基础要方[6]。药理学研究证实当归补血汤可通过提高机体免疫、改善肾脏组织慢性缺氧状态、调节血管活性物质及细胞因子、抑制高糖下肾组织IRE1α/JNK等通路的表达、减轻高糖下肾脏的内质网应激反应、调控巨噬细胞自噬等机制而发挥对DN的治疗作用[7-9],本课题组前期证明当归补血汤主要吸收成分对GK大鼠具有保护作用,但机制尚不清楚[10]。因此,本研究通过高糖诱导人肾近曲小管上皮细胞(HK-2细胞)纤维化,观察当归补血汤含药血清对HK-2细胞纤维化的作用,深入研究miR-27a对糖尿病肾纤维化的作用机制。
1 材料
1.1 药物与试剂
HK-2购自中国典型培养物保藏中心;黄芪(北京同仁堂,批号:190919001);当归(北京同仁堂,批号:259200103);DMEM/F12(美国GIBCO公司,批号:8119395);胎牛血清(美国GIBCO公司,批号:2275129);D-葡萄糖水合物(上海源叶生物科技有限公司,批号:S18F11H108777);BCA蛋白浓度测定试剂盒(上海碧云天生物技术公司,批号:102511693028);MTT(德国Biofroxx公司,批号:EZ2811F232);miRNA 1st Strand cDNA Synthesis kit(南京诺唯赞生物科技有限公司,批号:7E480H0);miRNA Universal SYBR qPCR Master Mix(南京诺唯赞生物科技有限公司,批号:7E421E0);Smad3-siRNA、con-siRNA、miR-27a-inhibitor、miR-27a-inhibitor negative control(加拿大Applied Biological Materials公司,批号:K21C15MA、K21C15ME、EW8552、EW8552);DNAfectinTMPlus Transfection Reagent、RNAifectinTMTransfection Reagent(加拿大Applied Biological Materials公司,批号:69170008、0155844840003);TGF-β1(美国Proteintech Group公司,批号:0332307MG28);SDS-PAGE凝胶配制试剂盒(上海碧云天生物技术公司,批号:P0012A);β-肌动蛋白(β-actin)抗体、波形蛋白(Vimentin)抗体、Ⅳ型胶原(COL Ⅳ)抗体、α-平滑肌肌动蛋白(α-SMA)抗体、Smad3抗体和TGF-β1抗体(美国Proteintech Group公司,批号:10004156、00098013、000083456、000086138、10004985、10011066);p-Smad3抗体(美国Affinity Biosciences公司,批号:7019561);PVDF膜(美国Millipore公司,批号:R0EB70106)。
1.2 仪器
酶标仪(美国Thermo Scientific公司,型号:GO1510);凝胶成像仪(美国Bio-Rad公司,型号:GelDoc2000);荧光定量PCR仪(美国Applied Biosystems公司,型号:7500)。
2 方法
2.1 细胞培养
HK-2细胞培养于含10%胎牛血清的DMEM/F12的培养基中,37 ℃,5%CO2培养箱培养,细胞融合度达80%以上后,用0.25%EDTA进行消化,2~3 d传代1次。
2.2 细胞分组
HK-2细胞分别设为对照组、高糖组、高糖+空白血清组、高糖+含药血清组。对照组采用DMEM/F12的培养基+10%胎牛血清处理;高糖组采用30 mmol·L-1葡萄糖+10%胎牛血清处理;高糖+空白血清组采用30 mmol·L-1葡萄糖+10%大鼠空白血清处理;高糖+含药血清组采用30 mmol·L-1葡萄糖+10%大鼠当归补血汤含药血清处理。
2.3 当归补血汤及含药血清的制备
按方剂称取黄芪100 g,当归20 g,置圆底烧瓶中,加8倍体积纯水,室温浸泡60 min,煮沸30 min。然后用纱布过滤,滤渣加入6倍体积的纯净水,煮30 min。过滤后,合并2次滤液,放入旋转蒸发仪中,60 ℃旋转浓缩滤液。将浓缩液(100 mL,1.2 g·mL-1)冷冻干燥24 h,制成冻干粉,冻干粉得率(冻干粉量/生药量)为41.52%,冻干粉迅速转移至自封袋中并置于低温干燥避光处保存备用。使用时取冻干粉适量于烧杯中,加入80 ℃热水溶解,配成相当于20 g·kg-1的灌胃汤剂。10只雄性Wistar大鼠,称质量,灌胃当归补血汤(20 g·kg-1),连续3 d,每日2次,第3天灌胃1 h后,眼眶采血,静置1 h后,4 ℃,3 000 r·min-1离心15 min,取上层血清为含药血清,置于-80 ℃冰箱保存。10只雄性Wistar大鼠灌胃生理盐水,连续3 d,每日2次,第3天灌胃1 h后,眼眶采血,后取上层血清为空白血清。
2.4 细胞处理和转染
将细胞接种于6孔板中,37 ℃,5%CO2培养48 h,随后不加TGF-β1或用5、10 ng·mL-1的TGF-β1处理细胞48 h,收集细胞用于后续实验。
转染前18~24 h,以一定密度接种细胞,使它们处于最佳培养条件。实验分为对照组、miR-27a抑制剂组(加入miR-27a-inhibitor)、miR-27a抑制剂阴性对照组(加入miR-27a-inhibitor negative control)、Smad3-siRNA组(加入Smad3-siRNA)、Smad3-siRNA阴性对照组(加入Con-siRNA)。
转染miR-27a抑制剂:在125 μL无血清、无抗生素培养基中稀释8 μL的RNAifectin试剂,加入miR-27a-inhibitor或miR-27a-inhibitor negative control使每孔终浓度为50 nmol·mL-1,室温孵育20 min后每孔加入0.8 mL无血清、无抗生素的培养基,5~8 h后换液为含血清和抗生素的培养基,并加入外源性TGF-β1刺激细胞,48~72 h后提取蛋白质。
转染Smad3-siRNA:将6.0 μL DNAfectin Plus添加到含2 μg Smad3-siRNA或Con-siRNA的200 μL无血清、无抗生素培养基中,室温下稳定3~5 h后转移至6孔板中,12 h后更换培养基,加入外源性TGF-β1刺激细胞,48 h后提取蛋白质。
2.5 MTT法检测细胞增殖率
混悬细胞密度为5×104mL-1,96孔板每孔加入200 μL。5%CO2,37 ℃孵育,细胞贴壁后,按“2.2”项下细胞分组分别处理细胞12、24、48 h。每孔加入20 μL MTT溶液,孵育4 h,每孔加入150 μL二甲基亚砜,然后置于摇床低速震荡10 min,在490 nm处测量吸光度,细胞增殖率=(OD实验组-OD调零组)/(OD对照组-OD调零组)×100%。
2.6 Western blot法检测纤维化相关蛋白的表达
给药48 h后,HK-2细胞用RIPA缓冲液裂解,BCA法测蛋白浓度。通过SDS-PAGE分离并转移到PVDF膜,用5%BSA封闭,与一抗(1∶1 000)4 ℃孵育过夜,TBST洗膜3次后,孵育二抗(1∶5 000)并通过ECL检测蛋白质条带,使用Image J软件分析。
2.7 qPCR检测纤维化相关mRNA表达
给药48 h后,用TRIzol试剂从HK-2细胞中提取总RNA。根据qPCR试剂盒进行转录及扩增。引物序列由镇江爱必梦生物科技有限公司合成,相应的引物序列显示在表1。相对定量采用2-ΔΔCt法,U6或β-actin作为内参。

表1 qPCR引物序列Table 1 Primer sequences for qPCR
2.8 统计学方法
3 结果
3.1 当归补血汤含药血清对HK-2细胞增殖率的影响
分别给药12、24、48 h,结果表明,与对照组相比,高糖组细胞增殖率显著下降(P<0.01),当归补血汤含药血清共培养后增殖率显著升高(P<0.05),且48 h效果最显著(P<0.001)。见表2。

表2 当归补血汤含药血清对HK-2细胞增殖率的影响Table 2 Effect of Danggui Buxue Decoction (DBD) containing serum on HK-2 proliferative
3.2 当归补血汤含药血清对HK-2细胞纤维化相关蛋白表达的影响
给药48 h后,与对照组相比,高糖组Vimentin、α-SMA、COL Ⅳ、TGF-β1、p-Smad3/Smad3蛋白表达升高(P<0.05,P<0.01,P<0.001),当归补血汤含药血清可明显降低纤维化蛋白的表达(P<0.05,P<0.01)。说明当归补血汤含药血清可能通过TGF-β1/Smad3通路抑制高糖诱导的纤维化。见图1和表3。
表3 当归补血汤对HK-2细胞纤维化相关蛋白表达的影响Table 3 Effect of DBD containing serum on the expression of fibrosis-related proteins in HK-2 cells
3.3 当归补血汤含药血清对HK-2细胞miR-27a及纤维化相关mRNA表达的影响
与对照组相比,高糖组miR-27a的表达升高(P<0.01),当归补血汤含药血清可降低miR-27a的表达(P<0.01)。高糖组各纤维化相关因子mRNA的表达升高(P<0.05,P<0.001),当归补血汤含药血清可明显降低这些mRNA的表达(P<0.05,P<0.01)。提示当归补血汤含药血清可能是通过miR-27a抑制细胞纤维化的。见表4。
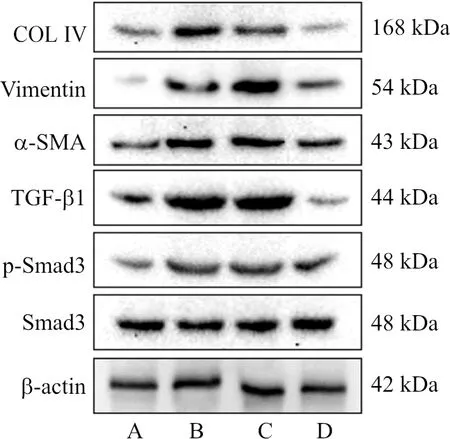
注:A.对照组;B.高糖组;C.高糖+空白血清组;D.高糖+含药血清组图1 当归补血汤含药血清处理HK-2细胞48 h纤维化相关蛋白表达的条带Fig.1 Electrophoresis bands of fibrosis-related proteins in HK-2 cells treated with DBD containing serum for 48 h
表4 当归补血汤对HK-2细胞纤维化相关mRNA表达的影响Table 4 Effect of DBD containing serum on the expression of fibrosis-related mRNA in HK-2 cells
3.4 TGF-β1及当归补血汤处理HK-2细胞对miR-27a表达的影响
向培养基中不加TGF-β1或加入5、10 ng·mL-1的TGF-β1,观察miR-27a表达的变化。结果表明,miR-27a呈剂量依赖式递增(P<0.05,P<0.01),说明5、10 ng·mL-1TGF-β1诱导了HK-2细胞的纤维化,且随着细胞纤维化的加剧,miR-27a的表达增加。见表5。
表5 TGF-β1处理HK-2细胞对miR-27a表达的影响Table 5 The effect of TGF-β1 treatment on the expression of miR-27a in HK-2 cells
向培养基中加入5 ng·mL-1TGF-β1,对照组加入10%空白血清,当归补血汤组加入10%含药血清。与对照组相比,当归补血汤组miR-27a表达降低(P<0.001),说明当归补血汤可降低TGF-β1诱导的纤维化细胞中miR-27a的表达。见表6。
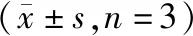
表6 TGF-β1及当归补血汤含药血清处理HK-2细胞对miR-27a表达的影响Table 6 The effect of TGF-β1 and DBD containing serum on the expression of miR-27a in HK-2 cells
3.5 转染Smad3-siRNA及miR-27a抑制剂对TGF-β1处理后HK-2细胞纤维化相关蛋白表达的影响
结果表明,与对照组(不加TGF-β1)相比,采用5 ng·mL-1的TGF-β1处理HK-2细胞后,细胞纤维化蛋白Vimentin、α-SMA、COL Ⅳ和p-Smad3/Smad3表达的升高(P<0.01,P<0.001),转染miR-27a抑制剂后可明显降低TGF-β1诱导的纤维化相关蛋白表达的升高(P<0.05,P<0.01),转染Smad3-siRNA也表现出同样的效果(P<0.05,P<0.01),说明抑制miR-27a和Smad3的表达可抑制细胞纤维化,值得注意的是,miR-27a抑制剂可明显降低p-Smad3/Smad3的表达(P<0.01)。结果表明,当归补血汤含药血清是通过下调miR-27a/TGF-β1/Smad3的表达抑制HK-2细胞纤维化的。见图2。

注:anti-miR-27a.miR-27a抑制剂组;miR-Ctrl.miR-27a抑制剂阴性对照组;Smad3-siRNA.Smad3-siRNA组;Con-siRNA.Smad3-siRNA阴性对照组。组间比较,*P<0.05,**P<0.01,***P<0.001。图2 转染Smad3-siRNA及miR-27a抑制剂对TGF-β1处理后HK-2细胞纤维化相关蛋白表达的影响Fig.2 Transfection of Smad3-siRNA and miR-27a inhibitor on the expression of fibrosis-related proteins in HK-2 cells after TGF-β1 treatment
4 讨论
DN的主要起始机制是高血糖引起的血管功能障碍,但其进展是由氧化应激、炎症和纤维化等不同的病理机制引起的[11]。目前已认识到纤维化在DN进展中的作用似乎对于DN最终进展为肾功能衰竭至关重要[12]。一般来说,DN的独特病理变化包括系膜细胞增殖、系膜增宽和细胞外基质(ECM)异常积聚,导致肾小管间质纤维化,最终导致慢性肾功能衰竭,降低患者的生活质量和危及患者生命[13]。因此,探究DN肾纤维化的作用机制及其治疗对策具有重要意义。当归补血汤在改善纤维化,如肺纤维化、肝纤维化等方面已有多种报道[14-15]。有证据表明,当归补血汤可通过抑制单侧输尿管梗阻大鼠模型中的NLRP3炎性小体减轻肾小管间质纤维化[16]。多项研究指出,miRNAs在肾纤维化中发挥重要作用,如miR-21a、miR-23b和miR-27a等[17-19]。但当归补血汤是否会通过miR-27a及TGF-β1/Smad3通路发挥抗肾纤维化作用还未知。本研究结果表明,当归补血汤含药血清可促进高糖条件下HK-2细胞的增殖,抑制高糖条件下肾纤维化相关标志物α-SMA、Vimentin和COL Ⅳ蛋白及mRNA表达。据报道,大多数研究将纤维化进展中的关键作用归因于TGF-β,它通过激活下游Smad信号通路来执行其生物学功能[20],并且有数据表明Smad3在纤维化发展中具有致病作用。因此,本研究检测了TGF-β1及p-Smad3/Smad3的表达,结果表明,TGF-β1及p-Smad3/Smad3在高糖中被上调,细胞纤维化加重,当归补血汤含药血清可下调TGF-β1及p-Smad3/Smad3的表达,改善细胞纤维化,提示当归补血汤可能是通过TGF-β1/Smad3通路改善肾纤维化的。据报道,miR-27a在糖尿病肾小管间质纤维化中发挥作用[21]。因此我们检测了miR-27a在HK-2细胞中的表达情况。结果表明高糖条件下miR-27a的表达升高,当归补血汤含药血清可抑制miR-27a的表达,提示当归补血汤可能是通过调节miR-27a来改善纤维化的。
TGF-β与多种miRNA相互调节,正向或负向调节肾纤维化的进程[22-23],所以我们采用不同浓度的TGF-β1处理HK-2细胞,以刺激细胞纤维化。结果发现TGF-β1可以促进细胞纤维化,从而上调HK-2细胞中miR-27a的表达,而当归补血汤可以改善这些作用,表明miR-27a可能是TGF-β1在促进肾小管上皮细胞纤维化表型转变中的重要介质。
Smad转录因子位于TGF-β信号通路的中心,已有研究证实在纤维化动物模型及慢性肾病人中TGF-β1通路激活以及Smad2、Smad3蛋白表达升高[20]。有证据表明,Smad3 KO小鼠肾小管间质纤维化程度明显减轻[24],使用Smad3 KO动物等观察到,COL Ⅳ基因表达的调节在肾小球内皮细胞中是Smad3依赖性的[25]。重要的是,通过转录和转录后机制调节miRNA表达可能涉及Smad蛋白。最近的研究表明,Smad3介导的miR-21上调可促进肾纤维化[26]。因此我们在先前的研究基础上,采用Smad3-siRNA、miR-27a抑制剂及5 ng·mL-1的TGF-β1处理细胞,结果表明Smad3的缺失以及miR-27a抑制剂均会降低TGF-β1诱导的HK-2细胞纤维化。
综上所述,本研究发现,细胞中低表达miR-27a可抑制HK-2细胞纤维化,因此当归补血汤通过miR-27a/TGF-β1/Smad3通路可改善高糖诱导的HK-2细胞纤维化。

