麦洼牦牛干扰素-τ基因的克隆及其表达分析
高绍帅,唐紫雯,黎 汕,程华琴,殷 实1a,,李 键1a,
(1 西南民族大学 a畜牧兽医学院,b现代生物技术国家民委重点实验室,四川 成都 610041;2 青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041)
干扰素-τ(IFN-τ)是在反刍动物中发现的一种与妊娠相关的Ⅰ型干扰素,由胚胎滋养层的单核细胞分泌,其产生无需病毒诱导。IFN-τ是雌性反刍动物妊娠的早期信号,在妊娠识别过程中起着重要作用[1-2]。IFN-τ与其他Ⅰ型干扰素有相似的结构和生物学功能[3],如体内抗病毒作用[4-5]、抑制癌细胞增殖作用[6]以及抗炎作用[7-9]。同时,IFN-τ又与其他Ⅰ型干扰素不同,其细胞毒性低于细胞培养和体内产生的其他Ⅰ型干扰素[10-11]。IFN-τ在子宫内膜上皮细胞受体的介导下,能延长黄体发挥作用的时间,从而促进黄体发育及妊娠过程[12]。有研究表明,IFN-τ大量表达于黄牛等妊娠识别阶段,其不仅对妊娠识别过程起决定性作用[13],还在胚胎发育过程中起重要作用[14]。
卵巢是生殖系统的重要器官,雌性反刍动物发情周期不同阶段的卵巢上存在卵泡、红体、黄体等结构,它们可以分泌各种激素来维持其自身的活动以及生殖过程[15-16]。反刍动物排卵后,卵泡内的细胞同血管一起向卵泡腔内塌陷形成皱襞构成红体,残留在其内的细胞分化成粒性黄体细胞和膜性黄体细胞,继而形成黄体。黄体主要通过维持体内孕激素水平,发挥维持妊娠和调节发情周期的作用。反刍动物繁殖力受多种因素限制,其中黄体发育成熟及其功能正常与否与动物繁殖效率有较大关系,有研究表明,河南某地3个肉牛场黄体异常平均发病率为27.1%,新疆石河子地区3个奶牛场黄体异常的平均发病率为4.9%,由此可见黄体异常对母畜繁殖造成了较大影响[17-18]。IFN-τ可通过不同的方式作用于子宫,延缓黄体溶解,形成抗黄体溶解机制,这种机制的失调可能是导致黄体异常从而影响母畜繁殖力的重要因素[19]。机体分泌的IFN-τ可以抑制催产素的表达,继而通过阻断前列腺素F2α(PGF2α)脉冲式释放而阻止黄体退化,维持孕酮(P4)的持续分泌[20]。已有研究表明,IFN-τ可激活子宫腔上皮细胞中的JAK/EGFR/ERK/EGR-1信号通路,从而阻止大部分PGF2α的释放,有利于胚胎的形成[21]。除此之外,IFN-τ还可通过旁分泌的方式作用于子宫内膜,从而诱导黄体中IFN-τ-刺激基因(interferon-τ-stimulated gene,ISG)表达,阻止卵巢黄体的溶解[22]。IFN-τ还可以通过稳定或者上调子宫内膜孕酮受体蛋白的表达而抑制子宫内膜腔的雌性激素受体(ER)和催产素受体(OTR)的转录,使前列腺素的生成量降低,延缓黄体溶解,使维持妊娠的重要孕激素P4持续分泌[23-24]。由此可见,IFN-τ能通过多种途径发挥抗黄体溶解作用,使黄体持续分泌孕酮,从而有利于妊娠的维持。
麦洼牦牛(Maiwa Yak)是分布在四川省阿坝藏族自治州红原县麦洼、瓦切若尔及盖县包座等地区的特色畜种,是该地区牧民重要的肉、奶来源和重要的役用畜种,也是其主要经济来源。然而麦洼牦牛的繁殖力较低,胚胎早期死亡率较高等缺点严重限制了麦洼牦牛种群数量的提高和农牧民经济收益[25]。目前,有关IFN-τ对黄牛等反刍动物黄体功能影响的研究较多,但其对麦洼牦牛的影响尚未见报道。为了探究IFN-τ在麦洼牦牛生长发育,特别是不同发情周期卵巢生长发育中的作用,本研究通过RT-PCR技术克隆获得麦洼牦牛IFN-τ基因序列,并对其进行了分析,预测IFN-τ蛋白序列及功能,构建系统进化树,将该基因序列与其他物种进行对比分析,同时检测麦洼牦牛心、肝、脾、肺、肾、小肠、胃、肌肉组织及卵泡期、红体期、黄体期卵巢组织中的IFN-τmRNA表达水平,以期为研究IFN-τ基因在麦洼牦牛生长发育及生殖过程中的作用提供分子生物学基础。
1 材料与方法
1.1 样本采集
试验样本均采自四川广汉盛大食品有限公司屠宰场。健康麦洼牦牛(3~5岁)宰杀后,立即采集其心、肝、脾、肺、肾、胃、小肠、肌肉组织以及处于发情周期的卵泡期(卵巢表面存在肉眼可见的大卵泡,图1-A)、红体期(卵巢中卵泡内膜毛细血管破裂,血液充满卵泡腔,呈鲜红色或紫红色,图1-B)和黄体期(卵巢中存在明显的成熟黄体,新鲜时呈黄色,图1-C)卵巢。每种组织设3个生物学重复。采集样本经灭菌生理盐水冲洗后,再用消毒的外科手术剪分为约0.5 cm3大小的组织块,装入冻存管,进行标记后置于干冰中带回实验室,-80 ℃保存。
1.2 主要试剂
胶回收试剂盒(货号D2500-01),为北京索莱宝科技有限公司产品;Trizol(货号15596026)、反转录试剂盒(货号RR037A)和ChamQ Universal SYBR qPCR Master Mix(货号Q711-02),为南京诺唯赞生物科技股份有限公司产品;PremixTaqTMDNA 聚合酶(货号PR1001),为北京百泰克生物技术有限公司产品;DNA Marker(货号B500350),为生工生物工程(上海)股份有限公司产品。其他试剂均为国产分析纯试剂。
1.3 总RNA提取及反转录
采用Trizol法分别提取麦洼牦牛心、肝、脾、肺、肾、小肠、胃、肌肉组织和卵泡期、红体期、黄体期卵巢组织样本总RNA。使用核酸分析仪测定RNA浓度、纯度。按照Vazyme反转录试剂盒操作说明将提取的RNA(A260/A280的值在1.8~2.0)进行反转录,获得cDNA,-20 ℃保存备用。
1.4 引物设计及合成
参考GenBank中黄牛IFN-τ基因序列(登录号HQ235019.1)、内参基因GAPDH序列(登录号EU195062.1),通过Primer Premier 5设计克隆引物及定量引物(表1),交由Sangon Biotech公司合成。

表1 本试验所用引物信息
1.5 麦洼牦牛IFN-τ基因的克隆与序列分析
以麦洼牦牛卵巢组织的cDNA为模板,PCR扩增IFN-τ。PCR反应体系(25 μL):上游引物1 μL,下游引物1 μL,PremixTaqTMDNA 聚合酶12.5 μL,模板cDNA 1 μL,ddH2O 9.5 μL。PCR反应程序:94 ℃预变性4 min;94 ℃变性45 s,61 ℃退火1 min,72 ℃延伸45 s,35个循环;72 ℃延伸7 min。将所得到的PCR产物进行凝胶电泳,切取目的片段,按照胶回收试剂盒说明书进行回收。将回收纯化后的扩增产物,连接到载体pMD19-T上,转化至DH5α感受态细胞中,经含氨苄青霉素的固体培养基过夜培养后,挑取白色单菌落接种于含氨苄青霉素的液体培养基中,摇床过夜培养后,进行PCR鉴定,阳性菌液交由生工生物工程(上海)股份有限公司测序。
使用DNASTAR 7.1进行ORF查找、序列翻译及蛋白二级结构预测。使用MegAlign将麦洼牦牛IFN-τ基因序列与大额牛(Bosfrontalis)、山羊(Caprahircus)、黄牛(Bostaurus)、亚洲水牛(Bubalusbubalis)、林麝(Moschusberezovskii)等5种哺乳动物的IFN-τ基因序列(登录号分别为AY665674.1、DQ154135.1、HQ235019.1、AY665673.1、DQ139308.1)进行同源性比对分析,构建系统进化树,并对麦洼牦牛IFN-τ蛋白结构及功能进行预测。使用ExPASY中的SWISS-MODE功能进行蛋白三级结构预测,ProtParam功能进行蛋白理化性质分析,用NetPhos 3.1、NetOGlyc 4.0 Server和NetNGlyc 1.0 Server功能分别进行磷酸化位点预测、O-糖基化位点预测、N-糖基化位点预测。
1.6 IFN-τ在不同组织中的表达水平
以麦洼牦牛心、肝、脾、肺、肾、小肠、胃、肌肉组织cDNA为模板,以GAPDH为内参基因,利用RT-qPCR检测IFN-τmRNA表达量,每个样本重复3次。以肌肉组织表达水平为参照,确定IFN-τmRNA在其他样本中的相对表达水平。
以麦洼牦牛卵泡期、红体期、黄体期卵巢组织cDNA为模板,以GAPDH为内参基因,利用RT-qPCR检测IFN-τmRNA表达量,每个样本重复3次。以黄体期卵巢组织的表达水平为参照,确定IFN-τmRNA在卵泡期、红体期卵巢组织的相对表达水平。RT-qPCR反应体系(20 μL):上游引物0.4μL,下游引物0.4 μL ,SYBR®Premix ExTaqTMⅡ酶10 μL,模板cDNA 1 μL,ddH2O 8.2 μL。RT-qPCR反应程序:95 ℃预变性2 min;95 ℃变性10 s,60 ℃退火30 s,40个循环;72 ℃延伸30 s。
1.7 数据统计分析
RT-qPCR结果采用2-ΔΔCt方法[26]进行分析,差异显著性分析通过SPSS统计软件进行。
2 结果与分析
2.1 麦洼牦牛IFN-τ基因克隆及同源性分析
PCR扩增结果(图2)显示,麦洼牦牛IFN-τ基因克隆目标产物条带长598 bp,与设计引物对应产物结果一致。麦洼牦牛IFN-τ的开放阅读框(ORF)大小为564 bp,编码187个氨基酸,起始密码子为ATG,终止密码子为TGA(图3)。
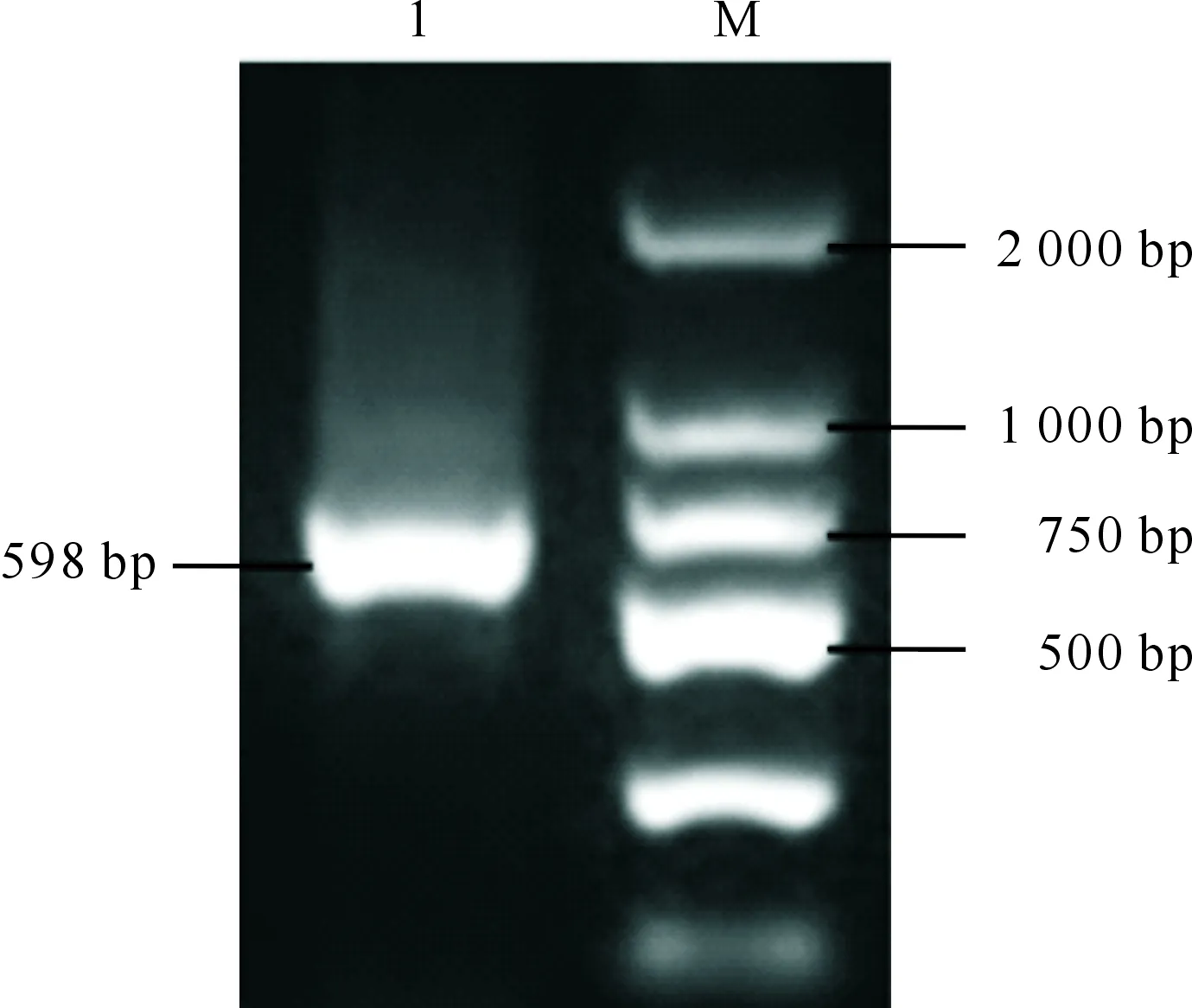
M.2 000 bp DNA分子量标准;1.麦洼牦牛IFN-τ基因扩增产物

ATG为起始密码子;TGA为终止密码子
麦洼牦牛IFN-τ基因序列与大额牛、山羊、黄牛、亚洲水牛、林麝IFN-τ基因的同源性分别为94.00%,90.10%,93.30%,90.60%和85.10%,可见麦洼牦牛IFN-τ基因与大额牛、黄牛的同源性较高。麦洼牦牛IFN-τ基因CDS区核苷酸有较高的保守性,且麦洼牦牛与黄牛、大额牛的遗传关系较近(图4)。结果表明,IFN-τ基因在物种进化过程中表现出相对保守性,且存在的碱基突变多为同义突变。
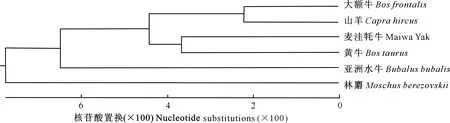
图4 基于IFN-τ基因的麦洼牦牛系统进化树
2.2 麦洼牦牛IFN-τ蛋白结构及功能预测
麦洼牦牛IFN-τ蛋白分子质量为21 124.94 u,分子式为C920H1 455N265O284S11,等电点为5.3,半衰期为30 h,脂肪指数为87.06,不稳定指数为48.14,平均亲水指数为-0.345。麦洼牦牛IFN-τ蛋白含187个氨基酸(表 2),其中Leu、Gly、Gln含量较高,占比分别为15.5%,8.6%和8.0%,带正电荷氨基酸残基(Arg+Lys)有17个;带负电荷氨基酸残基(Asp+Glu)为25个。由此可以推测,麦洼牦牛IFN-τ蛋白整体带负电荷,为不稳定的亲水性蛋白。
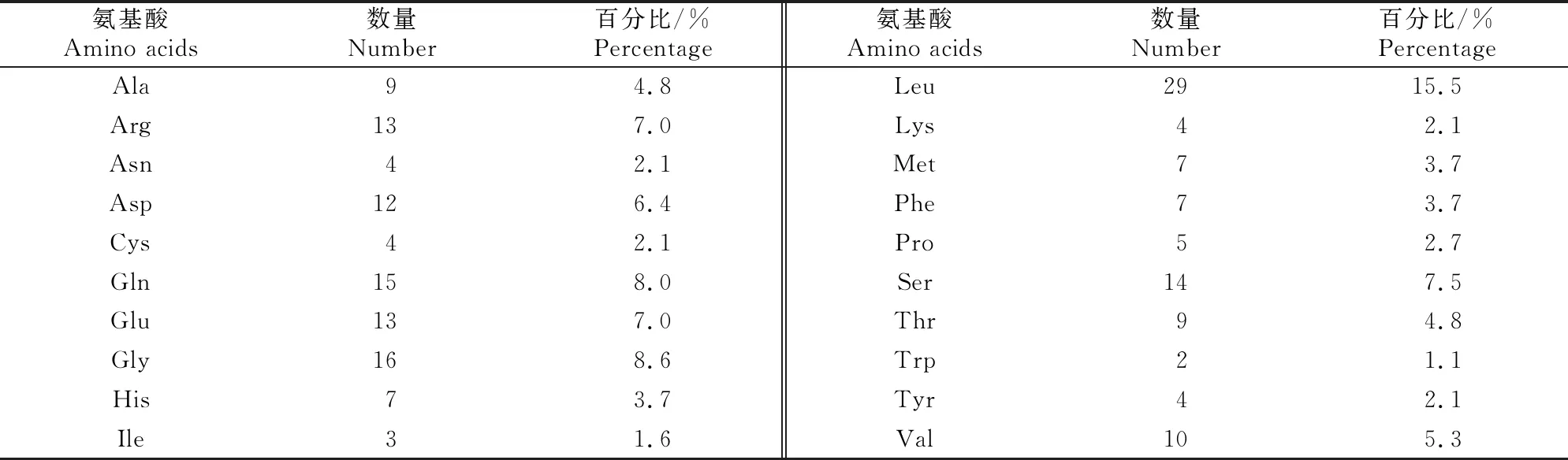
表2 麦洼牦牛IFN-τ蛋白氨基酸组成
麦洼牦牛IFN-τ蛋白的二级结构组成如图 5所示。从图5可知,二级结构中占比最大的为α-螺旋,参与构成α-螺旋的氨基酸有95个(50.8%)。β-转角、β-折叠及无规则卷曲的占比依次减少,参与结构形成的氨基酸分别有44个(23.5%)、32个(17.1%)及16个(8.5%)。三级结构预测结果(图略)与二级结构一致。
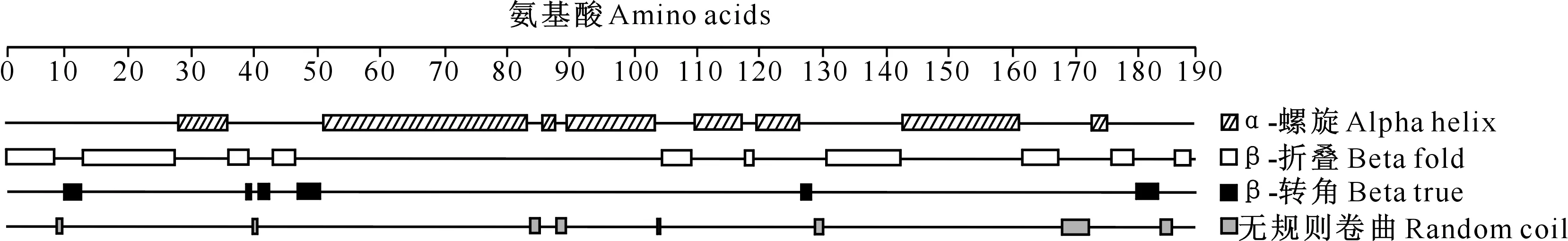
图5 麦洼牦牛 IFN-τ蛋白二级结构预测
磷酸化及糖基化位点预测结果表明,麦洼牦牛IFN-τ蛋白共有多个磷酸化位点,但糖基化位点较少,不存在N-糖基化位点,有1个O-糖基化位点。麦洼牦牛IFN-τ蛋白共有15个磷酸化位点,其中包括丝氨酸磷酸化位点12个,苏氨酸磷酸化位点2个,酪氨酸磷酸化位点最少1个(图 6)。
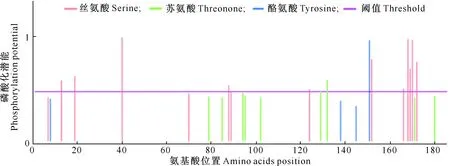
图6 麦洼牦牛IFN-τ蛋白磷酸化位点分析
2.3 麦洼牦牛IFN-τ mRNA的组织表达谱
由图7可知,IFN-τmRNA广泛表达于麦洼牦牛不同组织;IFN-τmRNA在小肠中表达水平最高,显著高于其他7种组织(P<0.05);在肝组织中的表达水平次之,显著高于其他6种组织(P<0.05);其他6种组织表达水平无显著差异。

图柱上标不同小写字母表示差异显著(P<0.05)。图8同
2.4 麦洼牦牛IFN-τ mRNA在不同发情周期卵巢组织中的表达
麦洼牦牛IFN-τmRNA在不同发情周期卵巢组织中的表达水平见图8。
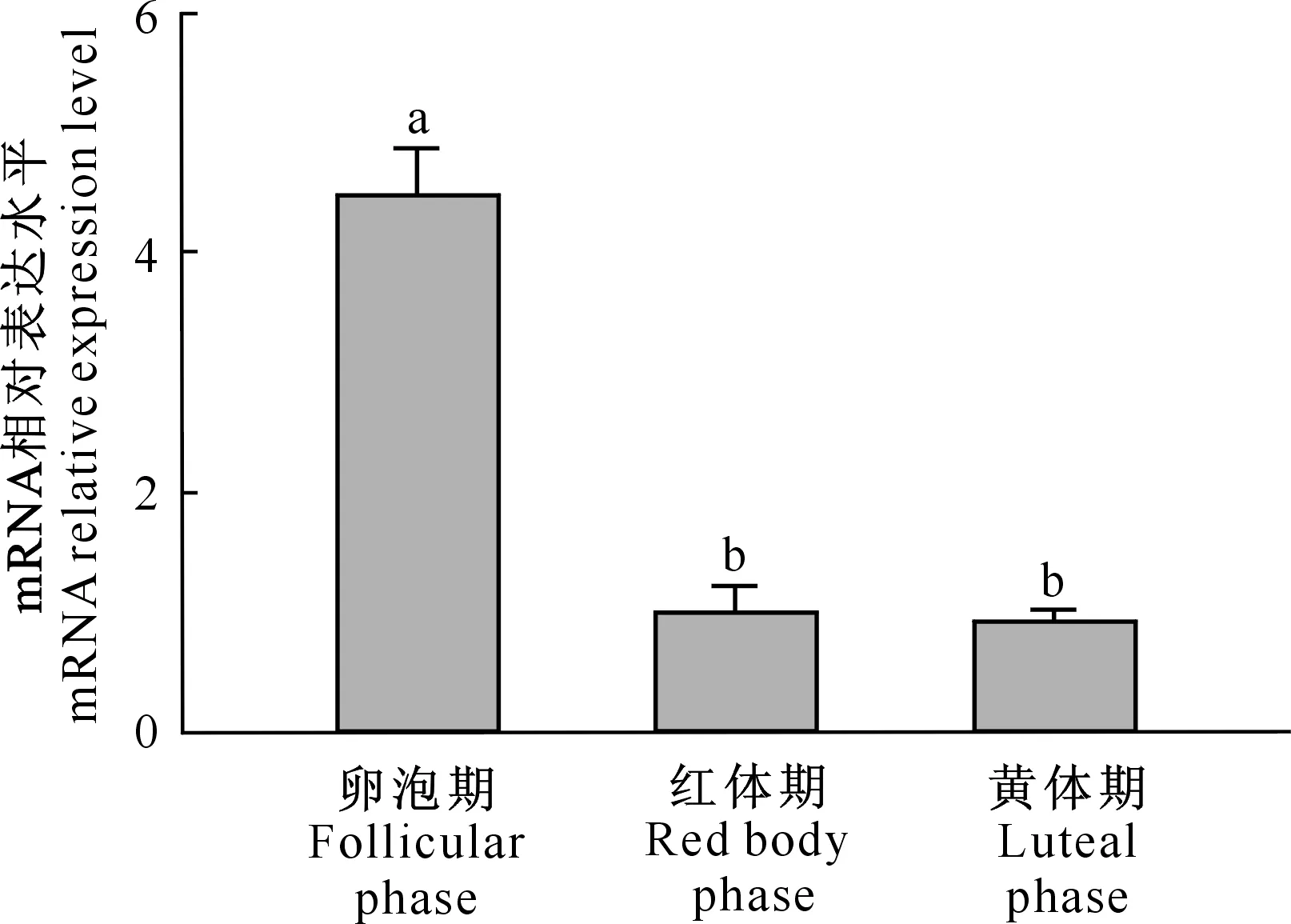
图8 麦洼牦牛IFN-τ mRNA在不同发情周期卵巢组织中的表达水平
图 8表明,IFN-τ mRNA在麦洼牦牛卵泡期卵巢组织中的表达水平显著高于红体期和黄体期卵巢组织(P<0.05);在红体期卵巢组织中的表达水平高于黄体期,但差异不显著。
3 讨 论
IFN-τ是反刍动物所特有的一类蛋白质,是反刍动物妊娠识别过程中重要的胚源性信号,在抑制黄体溶解和妊娠过程中发挥着重要的生物学功能[27-28],除此之外,IFN-τ还具有抑制癌细胞增殖、抗病毒等作用,尤其是其抗病毒作用受到人们的重视,而且有研究表明,即使大剂量使用IFN-τ也无毒副作用,因此,IFN-τ被认为是一种新型的具有发展潜力的药物[29]。目前对麦洼牦牛IFN-τ基因的研究较少,关于麦洼牦牛IFN-τ蛋白的结构、功能及其表达规律缺少系统研究。本研究克隆了麦洼牦牛IFN-τ基因,基因序列对比结果显示,麦洼牦牛IFN-τ基因序列与大额牛IFN-τ基因序列的同源性最高,除林麝外,与其他物种的IFN-τ基因序列同源性都在90%以上,表明IFN-τ基因在物种进化过程中有较高的保守性。麦洼牦牛IFN-τ蛋白二级结构预测结果表明,IFN-τ蛋白二级结构中占比最大的为α-螺旋,参与构成α-螺旋的氨基酸有95个(50.8%),说明麦洼牦牛IFN-τ的结构类似于其他Ⅰ型干扰素,基本结构都基于α-螺旋,其中有两个区域之间存在环状域间隔,对生物活性区和受体相互作用的位点具有重要作用[30]。目前对IFN-τ蛋白磷酸化位点及糖基化位点的报道较少。本研究对麦洼牦牛IFN-τ蛋白的磷酸化位点及糖基化位点进行预测分析,结果表明IFN-τ蛋白有多个磷酸化位点,但糖基化位点较少,这说明该蛋白可能受到翻译后修饰的调控,且复杂修饰较少。本研究中组织表达谱结果表明,IFN-τmRNA广泛表达于麦洼牦牛各组织,且小肠中表达显著高于其他组织。赵建帅等[31]研究了IFN-γ对家兔十二指肠肌电活动的影响,发现IFN-γ可通过神经系统对十二指肠发挥调节作用。另外,有研究通过建立一种可模拟体内肠上皮的体外模型发现,IFN-λ在抗猪流行性腹泻病毒及黏膜免疫的抗病毒机制中发挥重要作用[32]。但目前对IFN-τ在小肠中的影响未知,本研究结果可为研究IFN-τ在小肠中的功能提供参考。
本研究结果表明,IFN-τmRNA在麦洼牦牛卵泡期、红体期、黄体期卵巢组织中的表达水平呈下降趋势,其中卵泡期的表达量显著高于红体期和黄体期,而红体期与黄体期的表达水平无显著差异,提示IFN-τ在发情早期的卵巢中发挥重要作用。IFN-τ是反刍动物妊娠识别的信号,有研究表明胚胎滋养层细胞(ETCs)产生的IFN-τ对奶牛妊娠早期子宫内膜腔上皮细胞(EECs)表达牛白细胞抗原-I(BoLA-I)有一定的影响[33-34]。由此可推测,IFN-τ mRNA在卵泡发育早期大量表达,对麦洼牦牛早期胚胎的建立及妊娠早期的识别具有重要作用。有关IFN-τ在雌性反刍动物卵巢中的功能有待进一步研究。
4 结 论
本研究成功克隆了麦洼牦牛IFN-τ基因完整序列,其开放阅读框大小为564 bp,编码氨基酸187 个。麦洼牦牛IFN-τ基因CDS区核苷酸有较高的保守性,且IFN-τ蛋白为不稳定亲水性蛋白。小肠和肝组织中IFN-τ基因mRNA表达水平显著高于其他组织(P<0.05)。在发情周期不同时期卵巢中IFN-τ基因mRNA表达水平也有差异,表现为卵泡期显著高于红体期和黄体期。

