鼻黏膜复合佐剂LTB-Rg1在小鼠体内对猪繁殖与呼吸综合征病毒灭活疫苗的增强作用及其生物安全性评价
苏菲,薛银,徐丽华,李军星,余斌,袁秀芳*
(1.浙江省农业科学院畜牧兽医研究所,杭州 310021;2.浙江省动物疫病预防控制中心,杭州 310018)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome, PRRS)是由猪繁殖与呼吸综合征病毒(PRRS virus,PRRSV)引起的一种急性接触性传染病,严重影响全世界养猪业的发展[1]。PRRSV主要通过呼吸道入侵猪体内,并且能在猪肺泡巨噬细胞内迅速增殖,从而破坏巨噬细胞免疫体系,造成机体的非特异性免疫功能下降[2]。呼吸道黏膜是防御PRRSV 的第一道屏障,和肌内注射、静脉注射等免疫途径相比,通过鼻黏膜途径免疫能够更有效和更直接地在动物体局部建立起免疫反应,是抵御PRRSV 入侵较为理想的方法。由于黏膜结构的特殊性,黏膜途径免疫对疫苗的稳定性和免疫原性要求较高。尽管PRRSV 灭活疫苗比减毒活疫苗更安全,但是其免疫原性较弱,单独免疫并不能达到理想的保护作用[1,3],因此需要寻找合适的黏膜佐剂来加以辅助。
大肠埃希菌不耐热肠毒素B 亚单位(B subunit of heat-labile enterotoxin, LTB)是一种较好的黏膜免疫佐剂,在小鼠、鸡和猪等动物体内对多种疫苗均具有免疫增强作用[4-6]。研究发现,LTB所诱导的免疫反应与免疫途径有关。REN 等[6]发现:LTB 通过滴鼻途径给药能够显著提高小鼠体内H5N1病毒样颗粒特异性的体液和细胞免疫反应,并且能够在小鼠感染同源或异源毒株后明显提高其存活率;而LTB 通过肌内注射给药只能提高小鼠体内的特异性免疫应答水平,不能保护小鼠免受同源或异源毒株的感染。类似的,LEE 等[7]发现LTB 经滴鼻免疫后能显著提高福氏耐格里阿米巴原虫Nfa1 蛋白的特异性免疫球蛋白G(immunoglobulin G,IgG)和免疫球蛋白A(IgA)抗体水平以及脾淋巴细胞中干扰素-γ(interferon-γ,IFN-γ)和白介素-2(interleukin-2,IL-2)等细胞因子的表达水平,并且能够明显提高小鼠在感染福氏耐格里阿米巴原虫后的存活率。另外,LEI 等[8]也发现LTB 与H5N1 血凝素重组乳酸乳球菌一同滴鼻免疫鸡后,能够显著增强血清中的特异性IgG和鼻黏液中的特异性IgA抗体水平以及中和抗体水平,并且为感染鸡提供100%的保护力。值得注意的是,有研究发现,LTB 作为肺炎支原体黏附素P97 抗原佐剂时,通过肌内注射免疫偏向于增强Th2 型免疫应答,而通过滴鼻途径免疫偏向于增强Th1 型免疫应答[9]。人参皂苷Rg1 属于原人参三醇型皂苷,是人参根和茎叶中的主要皂苷单体[10]。研究表明,人参皂苷Rg1 在动物体内能够调节机体的免疫反应,具有佐剂功能。YUAN 等[11]发现通过皮下注射Rg1 能够明显提高小鼠体内乙肝病毒表面蛋白的特异性IgG 及其亚类IgG1、IgG2b的抗体水平,并提高脾淋巴细胞中IFN-γ、IL-4mRNA 表达水平。本课题组前期研究也发现,Rg1经皮下免疫小鼠后能显著提高小鼠血清中的卵清蛋白特异性IgG、IgG1和IgG2a抗体水平,并促进脾淋巴细胞的增殖和分化,增强Th1 和Th2 型细胞因子和转录因子的表达,并且其作用机制与Toll 样受体4(Toll-like receptor 4, TLR4)信号通路密切相关[12-13]。但是有关Rg1的黏膜免疫佐剂活性尚未见报道。在前期工作中,我们发现LTB 和人参皂苷Rg1 联合滴鼻免疫能够明显提高小鼠血清、阴道灌洗液、支气管灌洗液和胆汁中的抗原特异性IgA 抗体水平,并显著增大脾淋巴细胞中IFN-γ和IL-6mRNA 表达水平[14]。另外,我们还发现LTB 和Rg1联合免疫能够改变白细胞中淋巴细胞和中性粒细胞的比例,但是不改变白细胞总数。这些研究结果表明,LTB-Rg1作为鼻黏膜复合佐剂具有较大的发展空间。
本研究将重组LTB 和人参皂苷Rg1 作为PRRSV灭活疫苗的鼻黏膜复合佐剂滴鼻免疫小鼠,探究其对PRRSV 疫苗诱导的特异性体液和细胞免疫应答的增强作用,明确LTB-Rg1作为鼻黏膜复合佐剂的优势并评估其生物安全性,为进一步研制安全有效的黏膜免疫佐剂提供依据。
1 材料与方法
1.1 主要试剂
人参皂苷Rg1纯度为99.98%,购自成都普瑞法科技开发有限公司;重组LTB 由构建的pPIC9KLTB 质粒在毕赤酵母GS115 上表达产生,具体方法参见文献[9];动物组织总RNA磁珠提取试剂盒,购自济凡生物科技(北京)有限公司;反转录试剂盒(PrimeScriptTMRT Reagent Kit)和实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reation,qRT-PCR)试剂盒(TB GreenTMPremix Ex TaqTM),购自宝生物工程(大连)有限公司;PRRSV抗体检测试剂盒,购自美国爱德士公司;辣根过氧化物酶标记的羊抗鼠IgG 和IgA 抗体,购自美国Santa Cruz公司;丙氨酸氨基转移酶测定试剂盒、碱性磷酸酶测定试剂盒、血尿素氮测定试剂盒和葡萄糖测定试剂盒,均购自浙江省宁波普瑞柏生物技术股份有限公司。
1.2 病毒
PRRSV JXA-1 毒株在Marc-145 细胞上培养,检测到该病毒滴度为1×106TCID50/mL(TCID50为半数组织培养感染剂量)。病毒用0.05%β-丙内酯在4 ℃条件下灭活12 h,并在37 ℃条件下继续放置2 h。灭活后的病毒接种到Marc-145 细胞上,连续盲传3代,观察10 d内是否有细胞病变。
1.3 实验动物
雌性SPF 级ICR 小鼠(18~20 g)购自上海斯莱克实验动物有限责任公司,于浙江省农业科学院实验动物中心饲养,饲喂无菌饲料和水。室内温度为(25±10)℃,相对湿度为(50±10)%。动物实验得到浙江省农业科学院实验动物伦理委员会批准(2020001)。
1.4 动物分组与处理
将325 只ICR 小鼠随机分成5 组,每组65 只。1~5 组小鼠分别滴鼻免疫生理盐水,PRRSV 灭活抗原(1×105TCID50/只),PRRSV 灭活抗原(1×105TCID50/只)混合LTB(20 μg/只)或Rg1(30 μg/只)或LTB-Rg1(20 μg/只+30 μg/只),每次滴鼻总量为50 μL/只。免疫3 次,分别在实验0、7、21 d 进行,免疫前通过吸入异氟烷麻醉小鼠。于第1 次免疫(一免)后0、7、14、21、28、35 d称量小鼠体质量;于一免后2、7、21、35 d每组处死5只小鼠,采集血液用于生化检测;于一免后7、14、21、28、35、42、49、56 d每组处死5 只小鼠,采集血液和支气管肺泡灌洗液用于检测小鼠IgG、IgM 和IgA 抗体水平;于一免后35 d每组处死5 只小鼠,采集其脾脏和肺脏并分离单个核细胞,用于细胞因子mRNA转录水平的检测。每只小鼠用1 mL磷酸缓冲盐溶液灌洗支气管肺泡,所有样品保存于-20 ℃冰箱中,备用。
1.5 生化检测
血液离心后取上清液,分别按照丙氨酸氨基转移酶测定试剂盒、碱性磷酸酶测定试剂盒、血尿素氮测定试剂盒和葡萄糖测定试剂盒的说明书操作,利用LW C400全自动生化分析仪(广东省深圳蓝韵医疗器械公司)检测。
1.6 特异性IgM、IgG 和IgA 抗体水平的检测
参考文献[15],采用美国爱德士公司生产的PRRSV 抗原包被板,利用间接酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检测小鼠血清和支气管肺泡灌洗液中PRRSV特异性IgM、IgG 和IgA 抗体水平。将100µL 小鼠血清(以体积比1∶100稀释)或支气管肺泡灌洗液(以体积比1∶10稀释)加入包被板中,于37 ℃条件下孵育1 h;洗涤后加入100µL 辣根过氧化物酶标记的羊抗鼠二抗,其中IgM 和IgG 抗体均按体积比1∶5 000 稀释,IgA抗体按体积比1∶2 000稀释,室温下孵育1 h;洗涤后加入100 µL 3,3´,5,5´-四甲基联苯胺,室温孵育15 min;加终止液终止反应,于酶标仪中测定450 nm波长下的吸光度值。
1.7 细胞因子mRNA 转录水平的检测
参考文献[12,16],采集小鼠脾脏和肺脏组织并分离出单个核细胞,调整细胞浓度为5×106个/mL,并接种到24孔板中,每孔2 mL,置于37 ℃、5%CO2培养箱中孵育2 h;加入终质量浓度为10 μg/mL 的PRRSV抗原刺激24 h;收集细胞裂解液,按照动物组织总RNA 磁珠提取试剂盒说明书提取总RNA;反转录后利用染料法进行qRT-PCR扩增,详细步骤参照文献[17]。利用软件Primer Express 3.0设计引物序列(表1),并送至生工生物工程(上海)股份有限公司合成。以生理盐水组为校准样本,其他组为待测样本,采用2-ΔΔCT法进行相对定量分析。

表1 引物序列Table 1 Primer sequences
1.8 数据统计与分析
实验结果表示为平均值±标准差,采用GraphPad Prism 5.0 软件中的邓肯多重比较法进行统计分析,以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 LTB-Rg1 对PRRSV 特异性IgM 抗体水平的增强作用
由图1 可知,小鼠滴鼻免疫LTB-Rg1/PRRSV后能够在血清和支气管肺泡灌洗液中迅速产生较高水平的PRRSV 特异性IgM 抗体。在第1 次免疫(一免)后7 d,LTB-Rg1/PRRSV 组小鼠血清中的特异性IgM 抗体水平明显高于PRRSV 单独疫苗组(P<0.001)和Rg1/PRRSV 组(P<0.01);在一免后14 d,除生理盐水组外其他各组小鼠的血清IgM 抗体水平达到峰值,其中LTB-Rg1/PRRSV 组的IgM 抗体水平明显高于PRRSV单独疫苗组(P<0.001),但与LTB/PRRSV 组和Rg1/PRRSV 组相比无明显差异;在一免后21、28 d,LTB-Rg1/PRRSV组的IgM抗体水平均明显高于PRRSV单独疫苗组(P<0.001)、LTB/PRRSV 组和Rg1/PRRSV 组(P<0.01)。相似的,在一免后7 d,LTB-Rg1/PRRSV 组小鼠支气管肺泡黏液中的特异性IgM 抗体水平明显高于PRRSV 单独疫苗组、LTB/PRRSV 组和Rg1/PRRSV组(P<0.01);在一免后14 d,除生理盐水组外其他各组小鼠的支气管肺泡黏液中IgM 抗体水平达到峰值,其中LTB-Rg1/PRRSV 组的IgM 抗体水平明显 高 于PRRSV 单 独 疫 苗 组(P<0.001)、LTB/PRRSV 组(P<0.01)和Rg1/PRRSV 组(P<0.001),并且这种较高的IgM水平一直维持到一免后35 d。
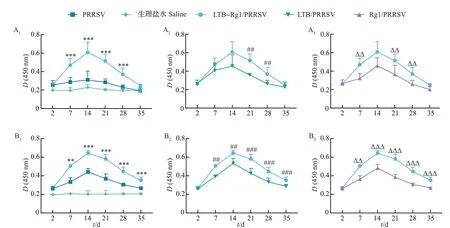
图1 小鼠第1次滴鼻免疫后PRRSV特异性IgM抗体水平Fig.1 PRRSV-specific IgM antibody levels after the first intranasal immunization in mice
2.2 LTB-Rg1 对PRRSV 特 异 性IgG 和IgA 抗 体水平的增强作用
由图2可见,LTB-Rg1/PRRSV能够显著提高小鼠血清中PRRSV特异性IgG抗体水平和支气管肺泡黏液中PRRSV特异性IgA抗体水平。在血清IgG抗体反应中,滴鼻免疫LTB-Rg1/PRRSV的小鼠从一免后14 d 开始产生较高水平的IgG 抗体,并在一免后35 d达到峰值,其抗体水平显著高于PRRSV单独疫苗组(P<0.001)、LTB/PRRSV 组(P<0.01)和Rg1/PRRSV 组(P<0.001),这种较高的IgG 抗体水平一直维持到一免后56 d。在支气管肺泡IgA抗体反应中,滴鼻免疫LTB-Rg1/PRRSV的小鼠从一免后7 d就开始产生较高水平的IgA 抗体,其抗体水平显著高于PRRSV 单独疫苗组和Rg1/PRRSV 组(P<0.05),并且在一免后35 d 达到峰值,此时抗体水平明显高于PRRSV 单独疫苗组(P<0.001)、LTB/PRRSV组(P<0.05)和Rg1/PRRSV组(P<0.01),这种较高的IgA抗体水平一直维持到一免后56 d。上述结果表明,LTB-Rg1作为鼻黏膜佐剂对小鼠全身和局部黏膜中的抗原特异性抗体水平均具有较好的增强作用。

图2 小鼠第1次滴鼻免疫后PRRSV特异性IgG(A1~A3)和IgA(B1~B3)抗体水平Fig.2 PRRSV-specific IgG(A1-A3)and IgA(B1-B3)antibody levels after the first intranasal immunization in mice
2.3 LTB-Rg1 对小鼠脾脏中PRRSV 特异性细胞因子mRNA 转录水平的影响
由图3可知,滴鼻免疫LTB-Rg1/PRRSV能够显著提高PRRSV诱导的小鼠脾脏中IFN-γ、IL-2、IL-5和IL-10的mRNA转录水平。与PRRSV单独免疫组和Rg1/PRRSV组相比,LTB-Rg1/PRRSV能够显著提高IFN-γ(P<0.001)、IL-2(P<0.05)、IL-5(P<0.001)和IL-10(P<0.001)的转录水平,并且LTB-Rg1/PRRSV组的IFN-γ(P<0.001)、IL-5(P<0.001)和IL-10(P<0.001)转录水平明显高于LTB/PRRSV组。
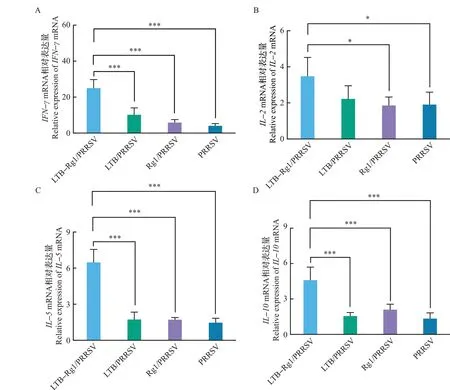
图3 小鼠滴鼻免疫后脾脏中细胞因子相对表达水平Fig.3 Relative expression levels of cytokines in spleen after the intranasal immunization in mice
2.4 LTB-Rg1 对小鼠肺脏中PRRSV 特异性细胞因子mRNA 转录水平的影响
由图4 可见,滴鼻免疫LTB-Rg1/PRRSV 能够显著提高PRRSV 诱导的小鼠肺脏中IFN-γ、IL-2、IL-5和IL-10mRNA 转录水平。与PRRSV 单独免疫组相比,滴鼻免疫LTB-Rg1/PRRSV 能够明显提高小鼠肺脏中IFN-γ(P<0.001)、IL-2(P<0.05)、IL-5(P<0.01)和IL-10(P<0.001)的mRNA 转录水平;与Rg1/PRRSV 组相比,滴鼻免疫LTB-Rg1/PRRSV 能够显著提高小鼠肺脏中IFN-γ(P<0.001)、IL-2(P<0.05)、IL-5(P<0.05)和IL-10(P<0.01)的mRNA转录水平;与LTB/PRRSV组相比,滴鼻免疫LTB-Rg1/PRRSV能够显著提高小鼠肺脏中IFN-γ(P<0.001)和IL-5(P<0.05)的mRNA 转录水平。这表明鼻黏膜佐剂LTB-Rg1 对小鼠体内Th1和Th2型免疫反应均有促进作用。

图4 小鼠滴鼻免疫后肺脏中细胞因子相对表达水平Fig.4 Relative expression levels of cytokines in lung after the intranasal immunization in mice
2.5 LTB-Rg1 对小鼠体质量的影响
由图5 可见,免疫前小鼠的平均体质量为(19.14±1.12)g。除PRRSV 单独免疫组外,其他各组小鼠的体质量在免疫后35 d 内持续增长。LTBRg1/PRRSV 组小鼠的体质量与生理盐水组相比没有明显差异,表明鼻黏膜佐剂LTB-Rg1 对小鼠体质量没有明显影响。在一免后7 d,PRRSV 组小鼠的体质量明显低于LTB-Rg1/PRRSV 组(P<0.05),但是在一免后14 d又恢复增长趋势。
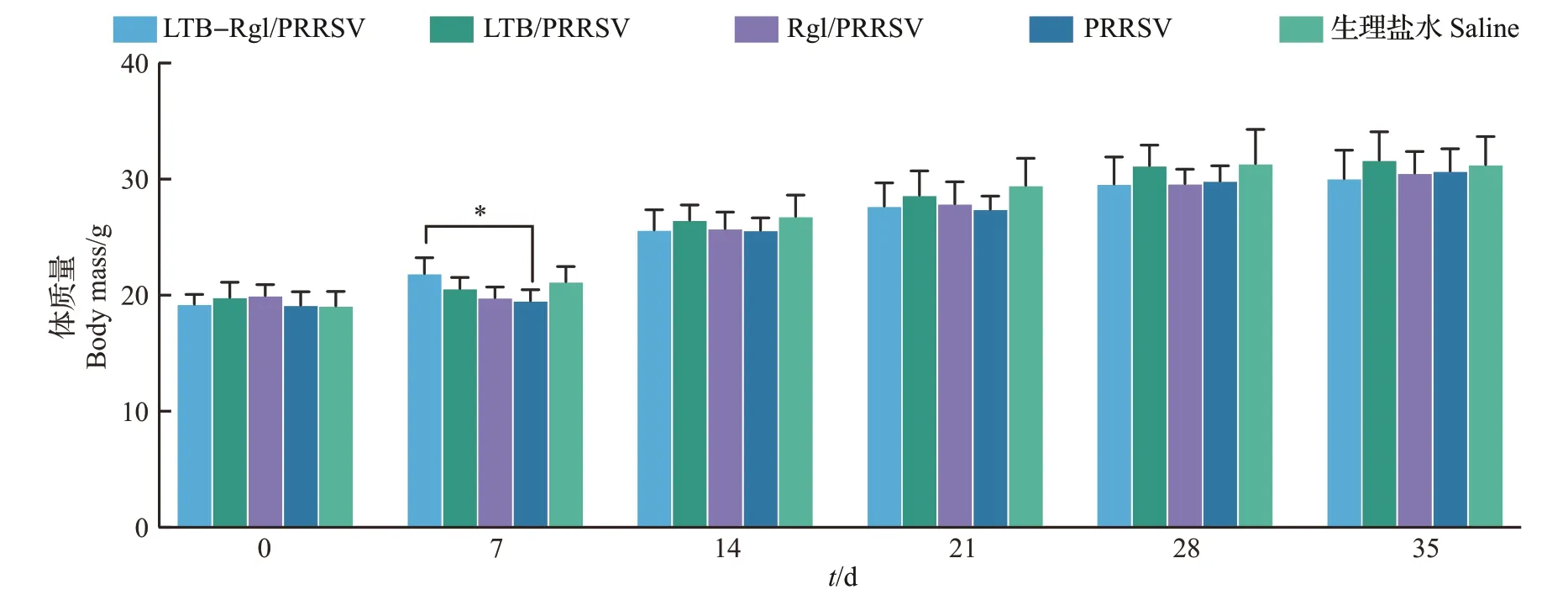
图5 第1次滴鼻免疫后LTB-Rg1对小鼠体质量的影响Fig.5 Effect of LTB-Rg1 on mice body mass after the first intranasal immunization
2.6 LTB-Rg1 对小鼠血清生化指标的影响
为了解LTB-Rg1 对小鼠的肝肾功能是否有影响,采集小鼠血液并检测血清中反映肝肾功能状态的生化指标。由图6可知,各组小鼠血清中的碱性磷酸酶活力、血尿素氮含量、丙氨酸氨基转移酶活力和葡萄糖含量均无明显差异,表明鼻黏膜佐剂LTB-Rg1对小鼠的肝功能和肾功能均没有明显影响。
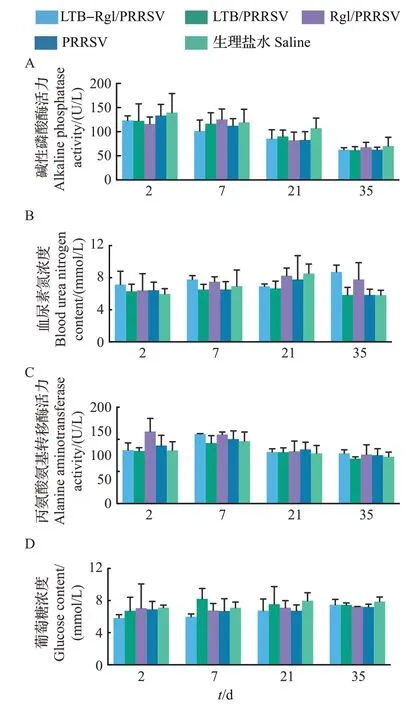
图6 第1次滴鼻免疫LTB-Rg1对小鼠血清生化指标的影响Fig.6 Effect of LTB-Rg1 on serum biochemical indicators in mice after the first intranasal immunization
3 讨论
疫苗是目前防控PRRSV的主要手段。但是,市面上的PRRSV 疫苗往往不能提供足够的免疫保护作用,特别是交叉免疫保护作用,使得疫苗防控PRRSV 的效果非常有限。在疫苗中添加合适的免疫佐剂是解决该问题的有效方法之一。对于防御PRRSV感染来说,在呼吸道黏膜快速产生高度特异性的先天和适应性免疫反应具有重要意义。因此,通过鼻黏膜途径免疫是有效防控PRRSV 较为理想的方法。尽管LTB 已被广泛用作黏膜免疫佐剂[8,18-19],但是其通过滴鼻途径给药的效果仍然饱受争议。在早期动物模型研究中,LTB 滴鼻给药并没有显示出任何不良反应[19],但是据报道人滴鼻LTB后可能会出现短期的Bell麻痹症状[20]。一项研究表明,在小鼠脑内注射低于22.7µg剂量的LTB并不会对其脑组织造成任何伤害[21],但是在前期的研究中,我们发现LTB低于30µg剂量注射时并不能充分发挥其滴鼻佐剂效果[15]。因此,如何在确保安全的前提下发挥LTB的鼻黏膜佐剂作用是本研究的关键所在。在前期研究中,人参皂苷Rg1 已被证实具有较好的佐剂效果[12],但是其黏膜佐剂作用迄今鲜有报道。研究发现,佐剂的联合使用往往比单独使用能够起到更好的免疫效果,因为合适的成分组合可能会使疫苗免疫后机体内Th1和Th2水平调节至最适于机体免疫应答的状态[22]。在本研究中,将安全剂量的LTB(20µg)和人参皂苷Rg1 联合起来作为鼻黏膜复合佐剂,既能保证LTB的剂量使用安全性,又能协同发挥2 种佐剂的免疫增强作用,具有重要的研究价值。
IgA 抗体水平是评价黏膜免疫反应的一个重要指标[23];IgM 抗体是机体接触抗原后首先产生的抗体,局部黏膜中产生的IgM抗体也被认为参与了黏膜免疫应答[24],可作为反映黏膜免疫应答水平的指标。在本研究中,LTB-Rg1 能够迅速诱导小鼠呼吸道黏膜和全身产生高水平的特异性IgM抗体,能够显著提高小鼠呼吸道黏膜中特异性IgA 和血清中的特异性IgG 抗体水平,并且能够有效延长这些抗体在局部黏膜和全身的作用时间,与LTB 和Rg1 单独佐剂组相比具有优势。传统的铝胶佐剂主要偏向于增强Th2 型免疫反应,而对Th1 型免疫应答没有明显作用,这并不适合PRRSV 疫苗。研究表明,猪感染PRRSV 后通常缺乏Th1 型免疫应答,这可能会导致免疫抑制反应时间延长,随后出现抗体反应变弱,病毒血症加重以致病情恶化[25-26]。因此,Th1 型免疫应答在抵御PRRSV 感染过程中至关重要。在本研究中,LTB-Rg1 能够上调脾脏和肺脏中Th1 型(IFN-γ和IL-2)和Th2 型(IL-5和IL-10)细胞因子的mRNA 转录水平,诱导Th1/Th2 平衡型免疫增强反应,对于防御PRRSV 感染具有重要意义。另外,在前期研究中,我们发现滴鼻免疫LTB-Rg1 仅能够增强呼吸道黏膜中PRRSV 中和抗体水平,而对血清中的中和抗体水平无明显影响[15]。值得注意的是,虽然中和抗体水平往往被认为是评价免疫保护作用的一个重要指标[27-28],但是有研究发现猪在缺乏中和抗体的情况下也可以抵御PRRSV感染[29-30]。因此,免疫系统中可能还存在其他因素可以有效控制感染,比如非中和抗体、T细胞反应等。
在本研究中,免疫小鼠未被观察到与复合佐剂相关的临床症状。在一免后7 d,单独疫苗组的小鼠体质量明显下降,但是之后又恢复正常的增长趋势,推测可能是免疫应激造成的;而添加LTB-Rg1佐剂的小鼠在免疫后体质量持续稳定增长,说明该佐剂可能有一定的抗应激作用。另外,LTB-Rg1对小鼠的肝肾功能没有明显影响。因此,LTB-Rg1是一种比较安全且极具潜力的鼻黏膜免疫佐剂,其作用机制有待进一步研究。本研究为研发新型PRRSV 灭活疫苗佐剂提供了依据,也为防控PRRSV提供了新思路。
4 结论
本研究结果表明,滴鼻免疫LTB-Rg1能够促进小鼠血清和呼吸道黏膜表面快速产生较高水平的PRRSV特异性IgM、IgG和IgA抗体,并且能够有效延长这些抗体的作用时间,显著上调PRRSV诱导的小鼠脾脏和肺脏细胞中Th1和Th2型细胞因子的转录水平,增强特异性细胞免疫应答。而且该复合佐剂对小鼠的体质量增长和肝肾功能均无明显影响,是一种比较安全且极具潜力的鼻黏膜免疫佐剂。本研究结果证实了该复合佐剂的优势,为其进一步在猪上开展研究奠定了基础。

