Rufibacter sediminis H-1产胞外多糖发酵条件优化及多糖保湿和乳化性能研究
杨棒棒,周 佳,屈建航,李春雨,罗 宇
河南工业大学 生物工程学院,河南 郑州 450001
天然多糖由10个以上单糖分子通过糖苷键连接而成,呈长链态、聚合状,是结构复杂的碳水化合物[1]。多糖具有抗氧化[2]、抗肿瘤[3]、促进细胞增殖[4]、抗辐射[5]、降血脂[6]、促进肠道菌群平衡和抑制炎症[7-8]等生理功能,此外,也参与生物体细胞识别等一系列生命活动,组成动物或植物的细胞骨架,如纤维素和几丁质等[9]。目前,天然多糖主要来源于植物和微生物,微生物具有发酵条件易控、生长周期短、不受季节和虫害影响等优点,因此微生物多糖在生产、应用等方面具有广阔的前景[10]。
微生物多糖分为胞外多糖、胞内多糖及结构多糖[11]。胞外多糖(extracellular polysaccharides, EPS)是一些特殊微生物在生长代谢过程中分泌到细胞壁外的一种高分子水溶性物质,部分胞外多糖具有保湿和乳化的功能特性[12-13]。Sun等[14]发现Paenibacillussp.产的胞外多糖在相对湿度43%时,保湿率与透明质酸相近,使其可能成为化妆品行业中较昂贵的透明质酸的良好替代品。Zhao等[15]从PseudomonasfluorescensPGM37提取的胞外多糖其保湿性优于甘油,略低于透明质酸。范熠等[16]研究发现,菌株BacillusamyloliquefaciensLPL061发酵产生的胞外多糖对食用油乳化效果较好,乳化指数50%以上。Riaz Rajoka等[17]发现Lactobacillusrhamnosus产生的胞外多糖经分离、纯化后乳化活性为23%~45%。以上研究表明,部分天然微生物胞外多糖具有保湿和乳化特性,并且已经引起国内外研究者的广泛关注。
微生物胞外多糖来源广泛,具有不同的功能特性,但微生物多糖产量的提高和功能的探索,仍是当前该研究领域的前提和关键。作者通过对实验室自主分离、筛选和鉴定的细菌新种RufibactersediminisH-1的研究,发现该菌株可以产生胞外多糖,探究了该菌的最佳产糖条件、胞外多糖的保湿和乳化性能,以期为深化天然微生物多糖的认识及应用开发提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种
河南工业大学生物工程学院环境微生物实验室自主分离筛选和鉴定的细菌新种RufibactersediminisH-1T(= CGMCC 1.162 89T=NBRC 113030T)[18],以下简称菌株H-1。
1.1.2 培养基
R2A培养基:酵母浸粉 0.50 g/L、胰蛋白胨 0.50 g/L、葡萄糖 0.50 g/L、酪蛋白水解物 0.50 g/L、可溶性淀粉 0.50 g/L、 K2HPO4·3H2O 0.30 g/L、MgSO4·7H2O 0.05 g/L、丙酮酸钠 0.30 g/L,固体培养基加入琼脂粉13.50 g/L,pH 7.0,115 ℃灭菌30 min。
1.2 仪器与设备
1.2.1 主要试剂
酵母浸粉、胰蛋白胨、酪蛋白、丙酮酸钠、琼脂粉:分析纯,天津市科密欧化学试剂有限公司。5%苯酚:称取5 g苯酚,蒸馏水定容至100 mL,现用现配。
1.2.2 主要仪器与设备
UV-2450紫外可见分光光度计:日本岛津公司;VS-840-2洁净工作台、BXM-30R立式压力蒸汽灭菌锅、BSD-YX2400智能精密摇床:上海博迅实业有限公司医疗设备厂;RCD-1A高速匀浆机:常州市亿能实验仪器厂。
1.3 方法
1.3.1 菌株H-1的发酵培养
挑取菌株H-1新鲜菌落接种于R2A培养基,28 ℃、150 r/min培养48 h,用作种子液。将种子液以5%(V/V)的接种量继续接入R2A培养基发酵产糖。
1.3.2 生长曲线和产糖曲线测定
参照文献[19]的方法,分别在0、13、30、33、37、48、54、58、61、72、78、84 h取样,在600 nm处测定吸光度,绘制生长曲线,同时取适量样品,测定多糖产量并绘制产糖曲线。采用硫酸-苯酚法绘制葡萄糖标准曲线。
1.3.3 单因素试验
以R2A培养基为基础培养基(初始pH 7、装液量100 mL/250 mL、接种量5%、温度28 ℃、转速150 r/min、发酵时间54 h),分别测定菌株H-1在不同碳源(蔗糖、葡萄糖、果糖、海藻糖、棉籽糖)、氮源(酵母浸粉、酪蛋白、胰蛋白胨、尿素、NaNO3)、初始pH(6.0、6.5、7.0、7.5、8.0)、接种量(1%、3%、5%、10%、15%)和不同发酵温度(10、20、28、37、45 ℃)下的胞外多糖产量。
1.3.4 响应面试验设计
根据单因素试验结果,筛选出对菌株H-1产胞外多糖影响显著的因素作为自变量,通过Box-Behnken的中心组合设计进行响应面试验。
1.3.5 多糖的保湿性
分别称取胞外多糖、甘油和透明质酸0.20 g,加入5 g蒸馏水均匀湿润,于干燥器中25 ℃恒温放置,定时称量样品质量,水分残留率为放置后样品中水分质量与放置前样品中水分质量的比值[20]。
1.3.6 多糖的乳化性
将制备的胞外多糖配成5 g/L的溶液,吐温80作为阳性对照,等量的疏水性底物(橄榄油、汽油、大豆油、菜籽油或二甲苯)与EPS以3∶ 2(V/V)混合,高速匀浆机剧烈旋转2 min,室温静置12、24、36、48 h,乳化率为乳化层体积与总体积的比值[21]。
1.4 数据处理
所有试验设置3组平行,结果以平均值±标准差表示,采用Origin 8.0软件作图,SPSS 26对单因素试验结果进行方差分析,Design Expert 11对响应面试验进行回归分析。
2 结果与分析
2.1 葡萄糖标准曲线及菌株生长、产糖曲线
根据硫酸-苯酚法测定葡萄糖标准曲线,回归方程:y=0.012 5x+0.011 4,R2=0.999 7。
如图1所示,0~33 h 菌株H-1生长迅速,胞外多糖产量逐渐增加,33 h时生长量达到峰值,进入稳定期,54 h时胞外多糖产量最高,为29.46 mg/L,之后多糖产量下降。菌株H-1最佳发酵产糖时间为54 h。

图1 菌株H-1的生长与产糖曲线Fig.1 Growth and sugar production curve of strain H-1
2.2 单因素试验
2.2.1 碳源对菌株H-1胞外多糖产量的影响
碳源对菌株H-1胞外多糖产量的影响见图2。由图2a可知,菌株H-1发酵产胞外多糖的培养基中其他组分不变时,海藻糖与另外4种碳源的多糖产量差异显著(P<0.05),其胞外多糖产量最高,为47.43 mg/L;由图2b可知,随着海藻糖质量浓度的增大,胞外多糖产量先升高再下降,当海藻糖质量浓度为2 g/L时,胞外多糖产量为123.49 mg/L,与其他组差异显著(P<0.05)。碳源对菌株生物量及胞外多糖产量具有显著影响,与以往报道相似[22]。耿晓琦等[23]对透明颤菌研究发现,以海藻糖为碳源时,胞外多糖产量为180 mg/L。蔡静静[24]研究菌株BF66-16的胞外多糖,发现糖产量随蔗糖质量浓度增大先升高再下降,与本研究中海藻糖质量浓度对胞外多糖产量的影响趋势相似。
2.2.2 氮源对菌株H-1胞外多糖产量的影响
氮源对菌株H-1胞外多糖产量的影响见图3。由图3a可知,酵母浸粉与其他氮源的多糖产量差异显著(P<0.05),以酵母浸粉为初始氮源时,多糖产量最高,为35.25 mg/L;如图3b所示,当酵母浸粉质量浓度偏低时,H-1多糖产量相对较低,酵母浸粉质量浓度过高,会对产糖产生负面影响,因此,菌株H-1最适产糖的氮源质量浓度为1.50 g/L,此时多糖产量为39.80 mg/L。酵母浸粉质量浓度对菌株H-1产糖的影响规律在内生真菌链格孢属中也有报道[25]。与无机氮源相比,有机氮源更有利于菌株的产糖发酵,在无机氮源中,“N·O”类最不易被利用,供能后生成的硝态氮对菌株有一定毒害作用,会对菌株的生物量和胞外多糖产量产生抑制作用[26]。

图2 碳源对菌株H-1胞外多糖产量的影响Fig.2 Effects of carbon sources on the yield of EPS of strain H-1

图3 氮源对菌株H-1胞外多糖产量的影响Fig.3 Effects of nitrogen sources on the yield of EPS of strain H-1

图4 温度、pH值和接种量对菌株H-1胞外多糖产量的影响Fig.4 Effects of temperature, pH value and amount of inoculation on the yield of EPS of strain H-1
2.2.3 温度、pH值、接种量对菌株H-1胞外多糖产量的影响
温度、pH值、接种量对菌株H-1胞外多糖产量的影响见图4。菌株H-1产胞外多糖的最佳温度为28 ℃,相应多糖产量为30.13 mg/L(图4a);最适pH为7.0,相应多糖产量为29.59 mg/L(图4b);最适接种量为10%,相应多糖产量为30.37 mg/L(图4c)。培养温度较低时,细胞内酶促反应速率下降,导致菌体生长代谢缓慢;培养温度过高,细胞内酶活性受到抑制,使代谢产生的多糖含量降低[27]。初始pH值能够促使细胞膜功能改变,使细胞的形态和结构发生变化,改变细胞对营养物质的摄取,从而影响细胞代谢产物的分泌[28]。唐少军等[29]对粗毛纤孔菌在不同pH值下培养,当初始pH值为6.50时,多糖产量达到1.12 g/L。不同接种量也会对多糖产量产生影响[30],当接种量为4%时,L.plantarumLPC-1 胞外多糖产量最高达到1.67 g/L。
2.3 方差分析
在单因素试验基础上,通过方差分析确定各因素对H-1胞外多糖产量的影响,结果见表1。酵母浸粉质量浓度、海藻糖质量浓度、接种量、温度均对菌株H-1产胞外多糖量有极显著影响。
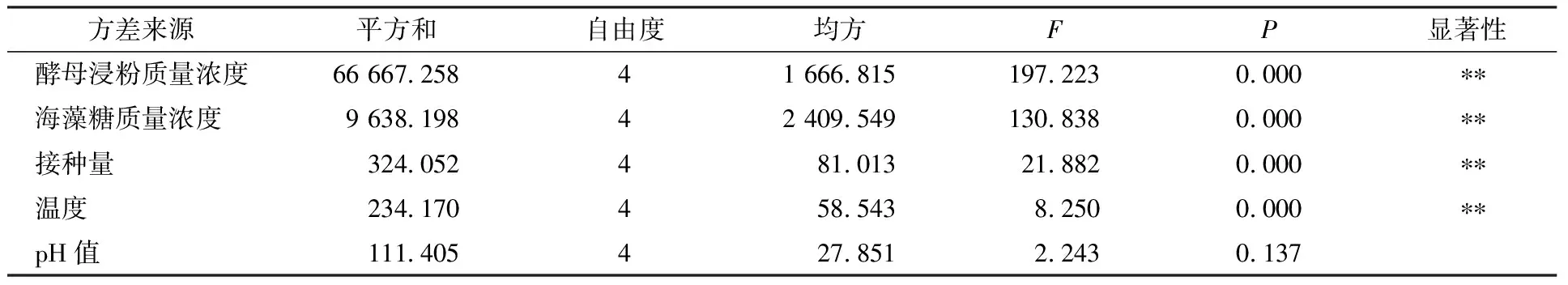
表1 方差分析Table 1 Analysis of variance
2.4 响应面试验
氮源一般不提供能源,供能后生成的硝态氮对菌株有一定毒害作用,氮源质量浓度过高会抑制胞外多糖的产生,因此最终选取海藻糖质量浓度、温度、接种量进行三因素三水平的响应面试验。因素与水平见表2,试验结果见表3。

表2 响应面试验因素与水平Table 2 Factors and levels in response surface methodology

表3 响应面试验设计与结果Table 3 Response surface test design and results
2.5 响应面分析
2.6 验证试验
通过响应面分析并结合实际操作,确定H-1菌的最佳产糖条件:发酵温度27.5 ℃,接种量8.5%,海藻糖质量浓度2.6 g/L,其他条件为酵母浸粉质量浓度1.50 g/L、pH 7.0,发酵时间54 h,预测多糖产量为138.46 mg/L。该条件下,经验证试验测得胞外多糖产量为140.49 mg/L。
2.7 多糖的保湿性
由图5可知,H-1菌株所产的胞外多糖具有良好的保湿率,在24 h内保湿率接近甘油和透明质酸,48 h时该多糖保湿率仍为82%,而甘油保湿率为83%,透明质酸保湿率为80%;随着时间推移,三者保湿率均逐渐减小,最后趋于稳定。
2.8 多糖的乳化性
菌株H-1胞外多糖的乳化性如表5所示,在室温48 h时,菌株H-1胞外多糖对橄榄油、汽油、大豆油的乳化率分别为92.85%、97.43%和98.57%,均高于吐温80的乳化率69.43%、67.43%和64.29%,但胞外多糖对二甲苯和菜籽油的乳化率分别为50.28%和34.28%,低于吐温80的乳化率62.44%和69.43%。以上数据表明,胞外多糖对部分烃类和植物油具有乳化作用,但乳化率存在差异。据Niknezhad等[21]报道,菌株Pantoeasp. BCCS 001 GH的胞外多糖对橄榄油和汽油的乳化率分别为57.80%和44.70%,弱于菌株H-1胞外多糖的乳化率。

表4 回归模型的方差分析Table 4 Analysis of variance (ANOVA) for response surface model

图5 菌株H-1胞外多糖的保湿性Fig.5 Moisturizing properties of EPS
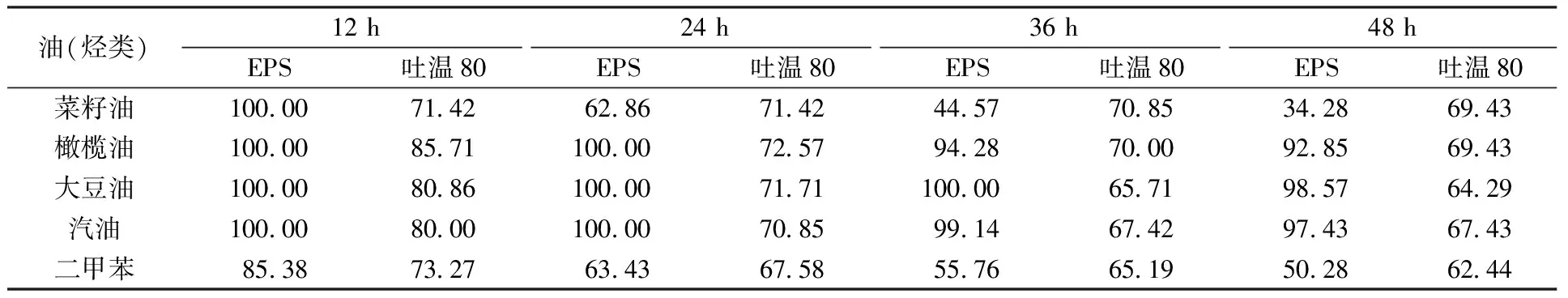
表5 菌株 H-1胞外多糖(5 g/L)对不同类型植物油和烃类的乳化率Table 5 Emulsifying rate of EPS (5 g/L) of strain H-1 on different types of hydrocarbons and vegetable oils %
3 结论
通过单因素和响应面试验,获得了菌株RufibactersediminisH-1产胞外多糖的最佳条件,即海藻糖2.6 g/L、酵母浸粉1.50 g/L、K2HPO4·3H2O 0.30 g/L、MgSO4·7H2O 0.05 g/L、丙酮酸钠0.30 g/L、pH 7.0、发酵温度27.5 ℃、接种量8.5%,在此条件下,胞外多糖的产量进一步提高,为后续菌株H-1发酵生产胞外多糖的应用提供了的依据。菌株H-1的胞外多糖在水分保持和乳化方面具有一定的开发价值,但需关注该多糖的食品安全性。在此基础上,结合多糖的细胞试验,探究该多糖的其他活性功能,将会为深化天然微生物多糖的认识及应用开发提供借鉴和参考。

