等离子体多尺度氧化对展青霉素降解的影响
成军虎,温 馨,孔繁津,李孟轲,王一杰
1.华南理工大学 食品科学与工程学院,广东 广州 510640 2.华南理工大学 现代食品工程研究中心,广东 广州 510006
中国是世界第一大苹果生产国,亦是第一大苹果汁生产国和出口国,每年90%以上的苹果汁出口到世界市场[1]。但是近些年我国苹果汁在国际市场上的竞争优势不足,质量与安全性成为约束产业发展的重要因素,其中,展青霉素超标是苹果汁的主要质量问题之一[2]。
展青霉素(PAT)是一种真菌毒素,主要由扩展青霉产生,具有水溶性和酸性环境中的热稳定性,极易存在于果蔬汁制品中。长期接触PAT会给动物组织和细胞带来细胞毒性及急性、慢性毒性等多种毒性,并有潜在的致癌风险。因为PAT具有广谱毒性,各国对食品中其残留量都有严格的规定。尽管如此,水果及制品中的PAT污染在发展中国家仍比较普遍。Ji等[3-5]分别调查了国内外销售的多种水果及水果产品,结果均表明有部分样品超出了所在国家的最大残留限量。因此,控制PAT的含量,对于果汁产业的发展和水果产品的营养与安全具有非常重要的现实意义。
降解或去除食品中PAT的方法主要有物理法、化学法和生物法。近年来,紫外线辐射、脉冲电场、脉冲光、高静水压处理和低温等离子体处理等食品非热加工技术作为热加工的替代技术在食品加工保藏领域广泛应用。低温等离子体技术是一种安全、高效、环保的高级氧化技术,在降解农药残留、毒素等方面也备受关注。在降解PAT方面,Xue等[6]采用低温等离子体对PAT进行脱毒处理,在16 kV的电压下处理30 min,PAT降解效率达到93%,矿化效率达到74%,并在此基础上提出了该低温等离子体处理过程中的PAT分解路径;马亚云[7]采用辉光放电等离子体降解山楂汁、梨汁和葡萄汁中的PAT,发现在一定范围内,电压越高、处理时间越长,3种果汁中 PAT 降解效果越好,且等离子体处理对果汁理化性质不会造成显著影响。
等离子体对有机物的氧化并非以单一方式进行,在放电过程中会产生多种活性成分,形成复杂的等离子体氧化体系,不同活性成分对处理对象的氧化机理不同,对氧化体系的贡献亦不同。为了探究低温等离子体的作用机制,需要构建基于自由基清除剂的多尺度氧化体系,对不同活性物质进行屏蔽,根据屏蔽前后等离子体处理情况的变化推断出该活性成分的作用机制,进而推断等离子体氧化体系的作用机制。作者以PAT溶液为研究对象,通过构建等离子体多尺度氧化体系的方式探索低温等离子体降解PAT的机理,并评价其脱毒效果,为其应用于实际生产过程中降解PAT提供理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
大肠杆菌(E.coliO157∶ H7):广东省食品微生物安全工程技术研究开发中心;LB肉汤培养基:广东环凯微生物科技有限公司;0.22 μm孔径尼龙滤膜:天津市津腾试验设备有限公司。
展青霉素标准品(HPLC级):上海源叶生物科技有限公司;乙腈(HPLC级)、冰乙酸(HPLC级)、乙酸钠(AR级)、二氧化锰(AR级)、叔丁醇(AR级)、对苯醌(99%):上海麦克林生化科技有限公司;磷酸二氢钠(AR级):上海阿拉丁生化科技股份有限公司;超纯水:实验室制备。
1.2 主要仪器与设备
CTP-2000k DBD等离子体装置:南京苏曼等离子体有限公司;HR2000+发射光谱仪:Ocean Optics公司;FE28-Meter pH计、AL204电子天平:Mettler-Toledo(上海)有限公司;ACQUITY®ArcTM高效液相色谱仪:Waters公司;UV-1800分光光度计:Shimadzu公司;SPX-150生化培养箱:中仪科(北京)科技有限公司;JW-3024HR高速冷冻离心机:安徽嘉文仪器装备有限公司;BSC-11000 Ⅱ B2-X生物安全柜:济南鑫贝西生物技术有限公司。
1.3 方法
1.3.1 PAT溶液的制备
PAT储备液的制备:将1 mg PAT标准品溶解于乙腈并定容至10 mL,得到100 mg/L的PAT储备液,于-20 ℃冰箱储存备用。
PAT工作液的制备:取1 mL PAT储备液,用pH 4.0的乙酸-乙酸钠缓冲液稀释至10 mL,得到10 mg/L的PAT工作液,于4 ℃冰箱储存备用。
PAT样品液的制备:取0.5 mL PAT工作液,用超纯水稀释至10 mL,得到500 μg/L的PAT样品液,备用。
1.3.2 PAT标准曲线的绘制
以 PAT质量浓度和峰面积分别作为横坐标和纵坐标绘制 PAT标准曲线。
PAT的HPLC检测方法依据GB 5009.185—2016中的方法并稍做修改。采用T3色谱柱(250 mm×4.6 mm×5 μm);流动相A为水,B为乙腈;采用梯度洗脱的方式,洗脱条件:5% B(0~13 min),100% B(13~15 min),5% B(15~30 min);流速0.3 mL/min;色谱柱柱温40 ℃;每次进样20 μL,用紫外检测器进行检测(λ=276 nm)。
1.3.3 发射光谱的测定
参照Pan等[8]的方法,使用光学发射光谱仪(OES)对DBD等离子体激发时产生的活性物质进行测定。光谱仪装载0.22 μm光纤,光纤与电弧的距离控制在1~2 mm,获取波长200~1 100 nm的光谱。将光谱与已有研究结果进行比较,对峰及活性物质进行识别。
1.3.4 pH值的测定
在室温条件下,使用pH计对经DBD处理0、1、2、3 min的样品液进行测定,重复进行3组试验。
1.3.5 降解率的测定
DBD等离子体处理条件:电压50 kV,电流1.5 A,两极板间距10 mm。每组7个样品,每个样品取10 mL样品液,加入直径6 mm的一次性培养皿中,等离子体处理时间(t)分别为0、30、60、90、120、150、180 s。处理后用HPLC检测PAT残留量并计算降解率,重复进行3组试验。
DR=Ct/C0×100%,
式中:DR(degradation rate)为经DBD等离子体处理t后PAT的降解率;Ct为经DBD等离子体处理t后PAT样品液的质量浓度,μg/L;C0为PAT样品液的初始质量浓度,μg/L。
1.3.6 等离子体多尺度氧化体系对PAT降解的影响
1.3.6.1 H2O2对PAT降解的影响
将二氧化锰作为H2O2清除剂。在PAT样品液中分别添加二氧化锰至浓度分别为0、10、20、30、40、50、60 mmol/L,进行2 min DBD等离子体处理,处理完成后用HPLC检测PAT残留量并计算降解率。重复进行3组试验。
1.3.6.2 ·OH对PAT降解的影响
将叔丁醇作为·OH清除剂。在PAT样品液中分别添加叔丁醇至浓度分别为0、50、100、150、200、250、300 mmol/L,后续处理同1.3.6.1。
1.3.6.3 O2-对PAT降解的影响
将对苯醌作为O2-清除剂。在PAT样品液中分别添加对苯醌至浓度分别为0、1、2、3、4、5、6 mmol/L,后续处理同1.3.6.1。
1.3.7 PAT降解产物对E.coliO157∶ H7的生长抑制作用
参照Zhu等[9]的方法并进行改进,采用E.coliO157∶ H7,用细菌悬浮液在600 nm处的光密度值(OD600)评价低温等离子体处理后PAT降解产物的毒性。吸取100 μLE.coliO157∶ H7种子液,加入20 mL LB肉汤培养基中,37 ℃摇床培养,当其OD600达到0.3时停止培养,在高速冷冻离心机中离心(8 000 r/min,4 ℃,5 min),弃上清液,保留菌体。向试管中加入无菌水再次离心并弃掉上清液,重复2次。最后加入无菌水,制备菌悬液,于4 ℃冰箱中储存备用。
1.3.7.1 等离子体处理后的超纯水对E.coliO157∶ H7的生长抑制作用
用1.3.5的方法分别处理超纯水0、1、2、3 min,各取2 mL分别加入20 mL LB肉汤培养基中,然后向每个培养基中加入20 μL菌悬液,37 ℃摇床培养,测定其培养0、2、3、4、5、6 h 时的OD600。重复进行3组试验。
1.3.7.2 等离子体处理后的PAT溶液对E.coliO157∶ H7的生长抑制作用
用1.3.5的方法分别处理PAT样品液和对照液(0.5 mL乙酸-乙酸钠缓冲液用超纯水稀释至10 mL)0、1、2、3 min,后续处理同1.3.7.1。
1.3.7.3 不同质量浓度的PAT溶液对E.coliO157∶ H7的生长抑制作用
配制50、150、250、500 μg/L的PAT溶液,后续处理同1.3.7.1。
1.4 数据处理与分析
所有数据均以平均值±标准差表示,使用Origin 2021制图。
2 结果与分析
2.1 DBD等离子体理化性质分析
DBD等离子体装置激发空气产生的OES光谱如图1所示,特征峰主要分布在紫外区域(300~400 nm),与Pan等[8]和Wan等[10]的检测结果类似,这些特征峰主要为活性氮(RNS)成分。除活性氮之外,还观察到部分活性氧(ROS)成分的特征峰,如319 nm附近为·OH的特征峰,390 nm附近的弱峰为O3,407 nm附近为OH+的峰。ROS的特征峰不明显,这可能与在空气中O(3P)和(5P)的淬灭有关[8]。OES光谱表明,DBD等离子体在气相中可以产生大量的ROS和RNS,这些活性物质进入液相后会迅速与水反应产生多种自由基,形成复杂的反应体系,自由基与有机化合物反应,破坏了分子间及分子内相互作用力,导致了有机物的降解和变性[11]。
PAT样品液的pH值随等离子体处理时间的变化如图2所示,经180 s的处理后,溶液的pH值逐渐下降,从最初的4.11±0.01下降到1.96±0.06(P< 0.05)。由于大量活性物质进入水中与水反应,产生了大量酸性离子,从而导致溶液pH值下降。由于PAT在酸性条件下稳定,故pH值的下降不会导致PAT降解[12]。
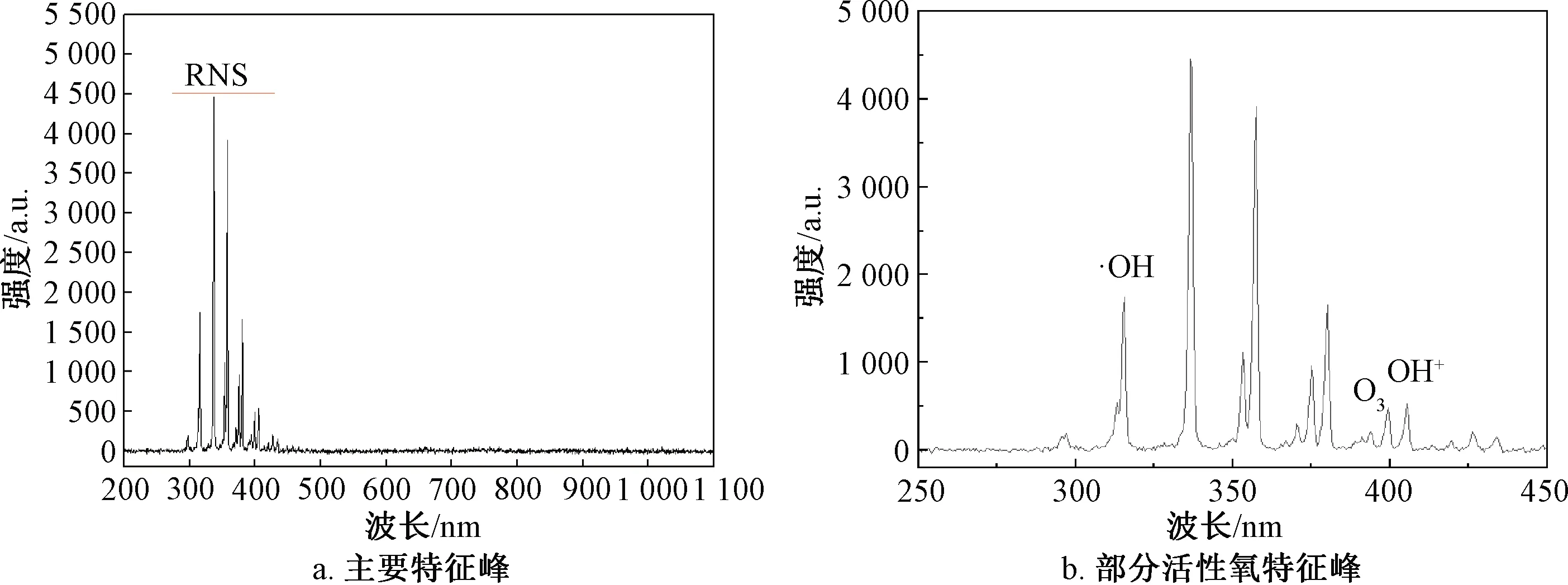
图1 DBD等离子体OES光谱图Fig.1 OES spectrum of DBD plasma

图2 DBD等离子体处理时间对PAT的 pH值的影响Fig.2 Effect of DBD plasma treatment time on pH value of PAT
2.2 DBD等离子体处理降解PAT
2.2.1 PAT标准曲线的绘制
以PAT标准品质量浓度与对应峰面积为横、纵坐标绘制标准曲线,得到线性方程:Y=103.58X+395.29 (R2=0.999 5),表明在检测范围内,PAT质量浓度与峰面积有良好的线性关系。
2.2.2 DBD等离子体处理对PAT的降解效果
图3为DBD等离子体处理时间对PAT质量浓度和降解率的影响。溶液中残留的PAT随处理时间的延长越来越少,降解率越来越高,处理180 s时,PAT降解率高达(90.92±1.98)%,质量浓度从(510.39±1.79) μg/L下降到(46.33±10.19) μg/L(P<0.05),低于国家标准的最大残留限量。由于本研究所用的液体体系比较简单,因此PAT的降解率较高。在此基础上,可进一步构建等离子体多尺度氧化体系,探究低温等离子体降解PAT的机制。

图3 DBD等离子体处理时间对PAT 质量浓度和降解率的影响Fig.3 Effect of DBD plasma treatment time on the concentration and degradation rate of PAT
2.3 多尺度氧化体系对PAT降解率的影响
2.3.1 H2O2对PAT降解率的影响
二氧化锰是一种催化剂,已被证明可以有效地清除H2O2[13]。加入了不同浓度二氧化锰的PAT样品液经DBD等离子体处理2 min后,PAT质量浓度及降解率的变化如图4a所示。随加入的二氧化锰浓度增加,溶液中PAT质量浓度逐渐升高,降解率逐渐降低。PAT质量浓度从(145.64±8.91) μg/L升高至(277.34±3.65) μg/L,降解率从(71.51±1.91)%下降到(45.77±0.61)%(P<0.05)。当二氧化锰浓度增加至50 mmol/L后,PAT质量浓度不再显著变化。Ma等[13]研究二氧化锰作为H2O2清除剂对等离子体降解壳聚糖效率的影响时发现,二氧化锰浓度上升,壳聚糖降解量下降,特性黏度升高。
在处理过程中发现,随着二氧化锰浓度的增加,DBD处理2 min后的样品液中残留的二氧化锰增加。如图4b所示,圆圈中为残留的二氧化锰,当二氧化锰浓度为0、10、20、30 mmol/L时,经DBD等离子体处理2 min,溶液内没有黑色的二氧化锰残留。当浓度达到40 mmol/L时,溶液中出现了微量的二氧化锰,当浓度达到50、60 mmol/L时,溶液中出现明显的黑色颗粒物,此时PAT质量浓度也不再显著变化。因此推测,经DBD等离子体处理后,二氧化锰转变为Mn2+。在中性环境下,二氧化锰作为催化剂催化H2O2分解产生水和氧气,但由于DBD等离子体处理产生了大量的H+,H+与催化过程中的中间产物Mn(OH)2反应生成Mn2+,因此黑色的二氧化锰逐渐溶解消失。综上可知,在加入二氧化锰之后,二氧化锰与H2O2反应消耗了大量H2O2,使其不能参与对PAT的氧化降解,因此PAT降解率下降,质量浓度升高,说明H2O2是DBD等离子体处理过程中对PAT降解产生贡献的活性物质之一。
虽然加入二氧化锰后,PAT的降解被抑制,但是,降解率下降了35.99%。马亚云[7]通过测含有PAT以及不含PAT的降解液中的H2O2发现,两种降解液中H2O2浓度差异不明显,说明降解PAT的过程中基本不消耗H2O2。H2O2是一种长寿命的活性物质,·OH、O2-等短寿命活性物质极易反应产生H2O2。因此,二氧化锰抑制PAT降解率的原因可能是二氧化锰消耗H2O2,使产生H2O2的反应向右进行,消耗·OH和O2-,间接影响了两种自由基对PAT的降解。
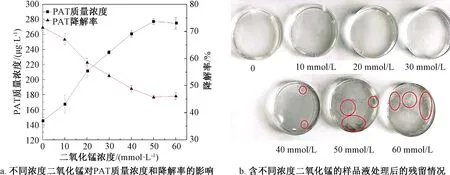
图4 不同浓度二氧化锰对PAT的影响Fig.4 Effects of different concentrations of manganese dioxide on PAT
2.3.2 ·OH对PAT降解率的影响

图5 不同浓度叔丁醇对PAT质量浓度 和降解率的影响Fig.5 Effects of different concentrations of tertiary butanol on the concentration and degradation rate of PAT
·OH是一种短寿命的活性物质,通常需要利用正丁醇、叔丁醇、水杨酸等间接表征其变化[14]。本研究利用叔丁醇作为·OH的清除剂,探究·OH对DBD等离子体处理过程中PAT降解的影响。由图5可知,随加入的叔丁醇浓度的增加,溶液中PAT质量浓度逐渐升高,降解率逐渐降低。当叔丁醇浓度从0增加到300 mmol/L时,PAT质量浓度从(145.64±8.91) μg/L升高至(296.35±6.77) μg/L,降解率从(71.51±1.91)%下降到(41.84±1.32)%(P<0.05),下降了41.49%,说明·OH对PAT降解的贡献大于H2O2。加入叔丁醇可以抑制DBD等离子体对PAT的降解,主要原因为叔丁醇屏蔽了等离子体产生的·OH,使其无法再氧化破坏PAT。·OH是DBD等离子体处理过程中对PAT降解产生贡献的活性物质之一。·OH非常活跃,会破坏并氧化PAT中的内酯环[6]。马亚云[7]的研究也显示,不含PAT的降解液中的·OH浓度远高于含有PAT的降解液,说明PAT降解过程中消耗了大量·OH。
2.3.3 O2-对PAT降解率的影响
O2-是一种短寿命的活性物质,很难利用直接方法进行检测,通常使用对苯醌、苯甲酸等作为捕捉剂对O2-进行捕捉,间接测定其含量[15]。本研究利用对苯醌作为O2-的清除剂,探究O2-对DBD等离子体处理过程中PAT降解的影响。由图6a可知,随加入的对苯醌浓度增加,溶液中PAT质量浓度逐渐升高,降解率逐渐降低。PAT质量浓度从(145.64±8.91) μg/L升高至(318.00±3.95) μg/L,降解率从(71.51±1.91)%下降到(37.82±0.94)%(P<0.05)。当对苯醌浓度增加到5 mmol/L后,PAT质量浓度不再显著变化。
图6b显示了加入不同浓度对苯醌的PAT样品液经DBD等离子体处理2 min后颜色的变化。随着对苯醌浓度增加,经等离子体处理后的溶液颜色逐渐变深。对苯醌为金黄色棱柱状结晶,溶于热水,因此溶液颜色加深可能是由于等离子体处理后对苯醌溶解度上升所致[15]。此外,O2-与对苯醌的不饱和双键极易反应,使之形成对苯二酚和三羟基苯等产物,也可以使溶液颜色加深[16]。加入对苯醌可以抑制DBD等离子体对PAT的降解,主要原因为对苯醌捕捉清除了等离子体产生的O2-,使其无法再氧化破坏PAT。O2-是DBD等离子体处理过程中对PAT降解产生贡献的活性物质之一。
在等离子体放电过程中,高能粒子冲击水并产生H·,H·迅速与氧反应生成HO2·以及与HO2·构成酸碱平衡的O2-。加入清除剂对苯醌对O2-进行清除后,PAT降解率下降了47.11%。O2-主要通过攻击不饱和双键的方式对有机物进行破坏,Wang等[17]利用脉冲放电等离子体降解疏浚泥沙中的对硝基苯酚,仅在反应体系中加入0.8 mmol/L的对苯醌,就可以使对硝基苯酚降解率从84.1%下降至52.0%。

图6 不同浓度的对苯醌对PAT的影响Fig.6 Effects of different concentrations of para benzoquinone on PAT

图7 不同浓度磷酸二氢钠对PAT质量浓度 和降解率的影响Fig.7 Effects of different concentrations of dihydrogen phosphate on the concentration and degradation rate of PAT
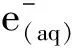
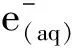
2.4 PAT降解产物对E.coli O157∶ H7的生长抑制作用
PAT具有细胞毒性、急性毒性、慢性毒性等多种毒性,通过对DBD等离子体处理后的PAT溶液进行安全性评价,将有助于了解PAT降解产物的毒性作用。在现有的研究中,大肠杆菌、酵母细胞、人体细胞、拟南芥都曾被用于PAT降解产物安全性评价[7,9,20]。本研究选用E.coliO157∶ H7,以OD600为指标,研究PAT降解产物对大肠杆菌的生长抑制作用。
2.4.1 等离子体处理后的超纯水对E.coliO157∶ H7的生长抑制作用
经DBD等离子体处理0、1、2、3 min的超纯水对E.coliO157∶ H7的影响如图8所示。随着培养时间的增长,OD600均呈现S形增长趋势。但加入培养基中的超纯水被等离子体处理的时间越长,OD600越小,对E.coli的生长抑制越明显。等离子体活性水已被证明可以抑制E.coli的生长[21],与本研究结果一致。
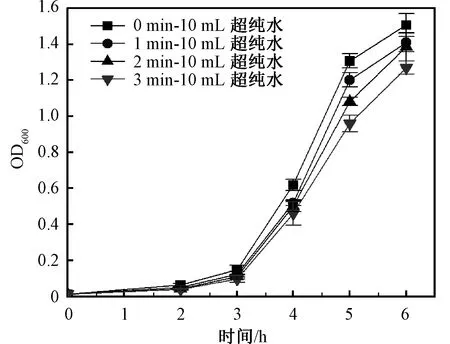
图8 DBD等离子体处理的超纯水对E.coli O157∶ H7的生长抑制作用Fig.8 Inhibition effect of UP water treated by DBD plasma on the growth of E.coli O157∶ H7
2.4.2 等离子体处理后的PAT溶液对E.coliO157∶ H7的生长抑制作用

图9 DBD等离子体处理后的PAT溶液 对E.coli O157∶ H7的生长抑制作用Fig.9 Inhibition effect of PAT solution treated by DBD plasma on the growth of E.coli O157∶ H7
经DBD等离子体处理0、1、2、3 min的PAT 样品液对E.coliO157∶ H7 OD600的影响如图9所示。其中,对照组为0.5 mL乙酸-乙酸钠+9.5 mL超纯水,试验组为0.5 mL PAT工作液+9.5 mL超纯水。加入培养基中的样品液被等离子体处理的时间越长,OD600越小,对E.coli的生长抑制越明显。对比相同处理时间下试验组和对照组发现,试验组的OD600低于对照组的,说明溶液中未降解的PAT对E.coli的生长产生了抑制作用。处理时间越长,对照组和试验组的OD600差异越小,说明溶液中PAT对E.coli的毒性作用不断降低。
2.4.3 不同质量浓度PAT溶液对E.coliO157∶ H7的生长抑制作用
PAT质量浓度对E.coliO157∶ H7 OD600的影响如图10所示。OD600与PAT质量浓度呈负相关,质量浓度越高,OD600越小,对E.coliO157∶ H7的生长抑制越明显。当PAT为50 μg/L时,OD600与2.4.2中处理0 min的对照组相近,说明此时PAT已无明显毒性作用。

图10 不同质量浓度PAT溶液对E.coli O157∶ H7的生长抑制作用Fig.10 Inhibition effect of PAT working solution with different concentrations on the growth of E.coli O157∶ H7
通过研究发现,等离子体处理的超纯水和PAT样品液都可以抑制E.coliO157∶ H7的生长,且PAT样品液的抑制作用比相同处理时间的超纯水更明显。等离子体处理产生的活性水主要通过其中含有的活性物质对E.coli的生长进行抑制[21]。相比之下,在PAT样品液中,除了活性物质产生作用之外,还有其他作用抑制了E.coli的生长。由于E.coli生长的适宜pH值为4.5~8.0,PAT样品液经等离子体处理后的pH值极低,可能影响了E.coli的生长。通过对比PAT样品液试验组与对照组对E.coliO157∶ H7生长的影响发现,虽然处理时间越长OD600越小,但相同处理时间下对照组和试验组间的差距随处理时间延长越来越小,说明PAT造成的影响越来越小。通过比较不同质量浓度的PAT溶液对E.coliO157∶ H7生长的影响发现,溶液中PAT质量浓度与E.coliO157∶ H7生长情况呈负相关,与PAT样品液的结果相印证。在早期的研究中,Zhu等[9]利用E.coliDH5α研究PAT降解产物的安全性,发现PAT降解产物对E.coli无毒性作用,甚至其可以作为E.coli的营养物质。郑青峰[22]的研究也认为,PAT的降解产物不影响E.coli的生长。
3 结论
本研究以PAT为研究对象,利用DBD等离子体处理技术和构建多尺度氧化体系,推测出DBD等离子体降解PAT的可能机制:DBD等离子体激发产生大量复杂的短寿命活性物质,这些物质会攻击PAT的内酯环及不饱和双键,在开环后不断将其降解为小分子有机物,最终将PAT降解为二氧化碳和水。除此之外,通过3组试验相互对比得知,PAT会抑制E.coliO157∶ H7的生长,但PAT降解产物对E.coliO157∶ H7的影响较小。但是在等离子体体系中,活性物质以及pH值都会对E.coli的生长造成影响,如何减小这些影响,需要后续进一步研究。

