冷冻温度及龙柏叶抗冻蛋白对小麦淀粉结构和理化特性的影响
马 豪,刘 玫,郑学玲,李利民,刘 翀
河南工业大学 粮油食品学院,河南 郑州 450001
冷冻处理常用于淀粉基食品的加工和保存。冷冻面团作为速冻发酵面制品的关键技术,具有良好的发展前景,然而,在冻结过程中冰晶生长和重结晶导致面团特性改变、产品品质劣变[1]。淀粉作为面团中占比最大的组分,在决定面团特性方面起着重要的作用[2-4]。在冻结过程中,冰晶挤压淀粉颗粒,导致其损伤、结构弱化、回生趋势增加,加速了淀粉及面团制品的回生[5-6]。因此,抑制冻结过程中冰晶对淀粉颗粒的损伤对于冷冻面团及其他冷冻淀粉基食品的品质改良至关重要。
抗冻蛋白能够与冰晶结合,修饰冰晶形态并抑制重结晶,较好地降低冰晶对冷冻食品品质的不利影响[7]。目前,已经有较多研究报道了植物抗冻蛋白对冷冻面团的品质改良,添加抗冻蛋白后,冷冻面团的水分迁移率降低、可冻结水含量减少[8-9]、发酵能力提高[10-11]、面筋网络结构的损伤减小[12-13],所制面包或馒头的比容和质构也得到明显改善[12-14]。然而,抗冻蛋白对冷冻面团中淀粉的结构和理化特性的影响目前尚未见报道。
作者前期通过筛选和优化,获得了龙柏叶抗冻蛋白(Sabinachinensis(Linn.) Ant. cv. Kaizuca leaves antifreeze protein, ScAFP),并初步分析了其抗冻能力和对冷冻面团的品质改良效果。本研究主要聚焦于ScAFP及冷冻温度对小麦淀粉水合特性、粒径、晶体结构、糊化特性和热特性的影响,以期从淀粉组分的角度进一步揭示ScAFP对冷冻面团及其制品品质影响的内在机制,为抗冻蛋白在淀粉基食品中的应用提供理论依据。
1 材料与方法
1.1 材料
小麦淀粉:上海绿宛淀粉有限公司;龙柏叶抗冻蛋白:实验室自制,即利用丙酮沉淀法得到粗ScAFP,将其水浴加热及电泳蛋白条带回收可得到具有一定热稳定性的电泳纯抗冻蛋白,热滞活性0.44 ℃。
1.2 仪器与设备
SHZ-B水浴恒温振荡器:上海博迅医疗生物仪器股份有限公司;低温试验箱:郑州格美制冷设备有限公司;DW-FL450A1超低温冷冻储存箱:中科美菱低温科技股份有限公司;DW-86L416 G低温保存箱:青岛海尔生物科技有限公司;艾本德5804R台式高速冷冻离心机、BT-9300 H激光粒度分析仪:丹东市百特仪器有限公司;RVA-4快速黏度分析仪:澳大利亚Newport Scientifi公司;Q20差示扫描量热仪:美国TA公司;D8-Advance X-射线衍射仪:德国Bruker AXS仪器公司。
1.3 冷冻小麦淀粉的制备
准确称取30 g小麦淀粉,将其加入溶有150 mg ScAFP的45 mL蒸馏水中,混合搅拌1 h。将制好的淀粉乳分别置于-20、-40、-80 ℃低温冷冻机中冷冻2 h,取出置于-18 ℃冰箱贮藏1周,在室温下完全解冻。3 000g离心15 min后,倒掉上相溶液。取沉淀部分加蒸馏水搅拌,重复离心2次,去除淀粉中的抗冻蛋白。将取出的淀粉冷冻干燥后过100目筛,备用。
1.4 溶解度和溶胀度测定
准确称取淀粉样品(m1,干基)加入去离子水,配制质量分数2%的淀粉乳,在85 ℃水浴中振荡30 min,取出冷却至室温,3 000 r/min离心20 min。将上清液倒入已烘干称质量的铝盒(m2),记录沉淀的质量(m3)。然后,将上清液在105 ℃烘箱中烘干至恒质量(m4),计算溶解度(SB)和溶胀度(SP)。
1.5 粒径分析
使用激光粒度分析仪测定淀粉颗粒的大小和分布。去离子水中加入淀粉样品,边搅拌边超声以分散样品,使遮光率达到10%,测定淀粉样品的粒径分布和大小,得到D10、D50和比表面积。
1.6 晶体结构分析
采用X-射线衍射仪对淀粉样品进行分析测定,设置参数:射线源Cu Kα,电压40 kV,电流35 mA,扫描范围4°~40°,扫描速度4°/min。使用软件 Jade5.0 计算样品的相对结晶度。
1.7 糊化特性测定
用快速黏度分析仪测定淀粉样品的糊化特性,参数设置参照GB/T 24853—2010。
1.8 热力学特性测定
准确称取 2.5 mg 淀粉样品于坩埚中,按m(样品)∶m(水)=1∶ 3加入去离子水,密封后置于室温隔夜平衡 24 h,备用。扫描温度范围 20~90 ℃,扫描速率 10 ℃/min,氮气流速 50 mL/min,取空铝盒做参照,得到DSC热效应特征值。
1.9 数据处理与分析
所有试验均重复进行3次,数据用SPSS 25软件进行方差分析,采用Origin 2018软件制图。
2 结果与讨论
2.1 溶解度和溶胀度
由表1可知,与原淀粉相比,小麦淀粉经冷冻处理后溶解度显著增加;随着冷冻温度的降低(从-20 ℃到-80 ℃),淀粉溶解度显著增加。淀粉的溶解度与淀粉的破损程度密切相关[15]。冻结过程中冰晶对淀粉的破坏主要表现为淀粉颗粒整体结构被破坏、小破损颗粒或可溶物的形成(如破损严重,冷冻处理后离心时可被除去)。当冷冻温度为-20 ℃时,冰晶生长速率最慢,形成的冰晶体积最大,挤压造成的微机械力对淀粉结构的破坏最大,形成的小破损颗粒或可溶物最多,其可能在随后的离心时溶于上清液而被除去,导致淀粉冻干后在85 ℃加热时可再次溶出的物质含量最低,表现为溶解度最低;当冷冻温度为-80 ℃时,冰晶对淀粉的破坏程度最小,使淀粉在冷冻及解冻过程中可溶物浸出损失较小,导致其在85 ℃加热时可产生更多溶出物,表现为溶解度最高。因此,随着冷冻温度的降低,溶解度逐渐升高。加入ScAFP后,当冷冻温度为-20 ℃时,与未添加ScAFP的淀粉相比,冰晶对淀粉的破坏程度降低,导致小破损颗粒或可溶物在冷冻、解冻及离心过程中损失较少,而在85 ℃加热时大量溶出,表现为溶解度升高;当冷冻温度为-80 ℃时,与未添加ScAFP的淀粉相比,加入ScAFP后冰晶对淀粉的破坏程度进一步降低,淀粉结构完整性和稳定性最强,抑制了其在冷冻解冻及85 ℃加热时内部物质的溶出,表现为溶解度最低。

表1 不同冷冻温度下原淀粉和添加ScAFP淀粉的溶解度和溶胀度Table 1 Solubility and swelling power of starches added with ScAFP under different freezing temperatures
由表1可知,在较低冷冻温度(-40 ℃和-80 ℃)处理后,淀粉溶胀度显著增加。这可能与冷冻过程中无定形区物质的损失及冰晶对淀粉有序结构的损伤有关。淀粉溶胀度与淀粉颗粒的大小分布、支链淀粉含量、直链淀粉和支链淀粉的比例以及形态结构有关[16-17]。支链淀粉是影响淀粉颗粒溶胀的重要因素,而直链淀粉和脂类抑制淀粉颗粒的溶胀[18]。在-40 ℃和-80 ℃冷冻过程中冰晶可能对淀粉颗粒产生损伤致使淀粉无定形区游离的直链淀粉、脂质和蛋白等物质浸出,这导致在加热过程中支链淀粉更自由溶胀。在-20 ℃冷冻处理后,淀粉溶胀度无显著性变化,这可能是由于此时较慢的冷冻速率导致冰晶形成较大,不仅导致淀粉颗粒损伤无定形区物质浸出,且可能破坏了淀粉内部的有序结构,导致淀粉溶胀度较低。添加ScAFP后,冷冻淀粉的溶胀度都显著减小,这可能是由于ScAFP与冰晶结合,改变了冰晶形貌,从而降低了冰晶对淀粉颗粒的损伤,减少了无定形区游离物质的浸出,抑制了支链淀粉的溶胀。
2.2 粒径
冷冻温度和ScAFP对冷冻淀粉粒径的影响如表2所示。D10和D50分别代表淀粉颗粒累积体积达到总体积10%和50%时的粒径。比表面积是指物质单位体积的总表面积,综合反映颗粒尺寸和分布、形状、表面结构以及颗粒或团聚体内部的空隙等相关参数[19-20]。
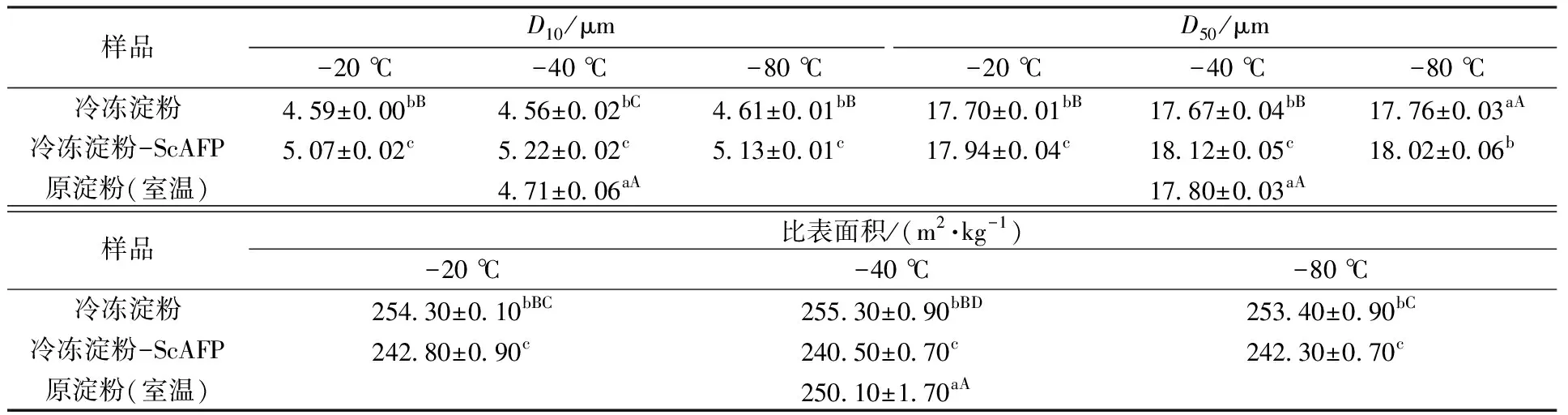
表2 不同冷冻温度下原淀粉和添加ScAFP淀粉的粒径Table 2 Particle sizes of starches added with ScAFP under different freezing temperatures
由表2可知,经冷冻处理后,淀粉D10、D50显著减小,比表面积显著增加,可能是由于冷冻过程中淀粉外部的水变成冰,体积增大挤压淀粉颗粒,致使其表面凹陷,内部无定形区被压实,导致淀粉颗粒变小[21-22]。-80 ℃冷冻处理后的淀粉粒径减小程度最小,表明较快的冷冻速率导致淀粉颗粒外部形成的冰晶较小,对淀粉颗粒产生的挤压较小;-40 ℃冷冻处理后的淀粉粒径最小,可能是由于此时外部冰晶对淀粉颗粒的挤压较大;与-40 ℃冷冻处理后的淀粉相比,-20 ℃冷冻处理后的淀粉粒径更大,可能是由于较慢的冷冻速率导致淀粉颗粒内部游离水形成大冰晶,产生向外的压力,致使淀粉颗粒略有膨胀[6]。添加ScAFP后,淀粉D10、D50显著增加,比表面积显著降低,表明淀粉粒径增大,可能是由于ScAFP与冰晶结合,改变了冰晶形貌,使淀粉外部冰晶较小,降低了冰晶对淀粉颗粒的挤压,而淀粉内部的冰晶导致淀粉颗粒发生膨胀。
2.3 晶体结构
如图1所示,所有淀粉样品呈现典型的A型晶体结构,即在衍射图谱的15°、17°、18°、20°、23°处有较强衍射峰,表明冷冻温度不改变淀粉的晶体类型,这与前人研究结果一致[6]。然而不同冷冻温度处理后的淀粉与原淀粉相比,相对结晶度有显著差异。

注:-20、-40和-80分别为-20 ℃、-40 ℃和-80 ℃处理下的小麦淀粉;-20(ScAFP)、-40(ScAFP)和-80(ScAFP)分别为 -20 ℃、-40 ℃和-80 ℃处理下添加ScAFP的小麦淀粉。图1 不同冷冻温度下原淀粉和添加ScAFP淀粉的XRD衍射图Fig.1 XRD pattern diagrams of starches added with ScAFP under different freezing temperatures
原淀粉的相对结晶度为20.1%,-20 ℃冷冻处理后的淀粉相对结晶度(18.5%)显著降低,可能是由于慢的冷冻速率导致形成的冰晶尺寸较大,不仅使淀粉无定形区物质浸出,而且破坏了淀粉分子间和分子内氢键,淀粉有序分子结构趋向无序化,淀粉微晶被破坏[23-24];添加ScAFP后的淀粉相对结晶度(22.9%)显著增加,表明其降低了冰晶对淀粉微晶的损伤,但可能并未减弱冰晶对淀粉颗粒的损伤、减少无定形区物质的损失,导致淀粉结晶区比例增加。
-40 ℃冷冻处理后,淀粉相对结晶度略有增加,为21.1%,而添加ScAFP后淀粉相对结晶度略有降低,为20.1%。整体而言,-40 ℃冷冻处理后淀粉结晶度变化较小,可能是由于冷冻过程中冰晶仅对淀粉颗粒结构产生显著损伤,致使无定形区物质浸出,淀粉结晶区比例相对增加,而对淀粉有序结构无显著影响。添加ScAFP后其降低了冰晶对淀粉颗粒的损伤,有效抑制了无定形区物质的浸出[24]。
-80 ℃冷冻处理后,淀粉相对结晶度略有增加,为20.7%,低于-40 ℃时的相对结晶度,可能是由于此时冰晶对淀粉颗粒结构损伤较小,冷冻过程中无定形区物质损失较少,导致淀粉结晶区比例增加较小。添加ScAFP后淀粉相对结晶度显著增加,达到25.3%,可能是由于ScAFP降低了冰晶对淀粉颗粒的损伤,且ScAFP可能提高了体系浓度,促进了淀粉颗粒的脱水,导致淀粉链间距离缩短,颗粒更致密,可能促进了解冻后支链淀粉重排,将亚结晶转变为结晶区,形成更有序和稳定的结晶结构,从而提高了结晶区比例[6]。
2.4 糊化特性
淀粉的糊化特性受颗粒形态、支链淀粉和直链淀粉、淀粉结合蛋白和脂类等影响,可用峰值黏度、崩解黏度、回生黏度等指标来反映[18,25-26]。因此,考察了不同冷冻温度下原淀粉和添加ScAFP淀粉的糊化特性。
峰值黏度是指淀粉颗粒膨胀到最大体积时的黏度,可反映淀粉颗粒的溶胀能力[19]。淀粉经冷冻处理后,峰值黏度均显著升高,可能是因为冷冻处理后无定形区的直链淀粉、脂质等物质浸出,支链淀粉比例增加,从而导致淀粉颗粒溶胀能力增加,体现在峰值黏度升高。与未添加ScAFP相比,添加ScAFP后冷冻淀粉的峰值黏度显著增加,这可能是由于ScAFP能够作用于淀粉颗粒外部的冰晶,从而降低冰晶对淀粉内部结构的挤压,且内部冰晶生长导致此时淀粉颗粒尺寸较大(表2),淀粉溶胀后占据的体积增大,从而峰值黏度升高[27-28]。
冷冻处理后,淀粉的崩解黏度显著增加,说明经过冷冻处理后淀粉糊的热稳定性更低,可能是由于冷冻处理后支链淀粉比例增加,淀粉糊化后的峰值黏度较高,导致其溶胀颗粒破裂后支链淀粉溶出率更高,黏度下降更大,崩解黏度增加。添加ScAFP后,淀粉崩解黏度无显著变化。
与原淀粉相比,冷冻处理后淀粉的回生黏度显著增加,可能是由于冷冻处理后直链淀粉浸出,支链淀粉重排形成更有序的双螺旋结构,加剧淀粉的回生倾向,在-80 ℃冷冻处理后淀粉的回生黏度增加更为显著,可能是由于较低冷冻温度更有利于淀粉链的重排,结构更有序[6]。添加ScAFP后,在-20 ℃冷冻处理的淀粉,回生黏度进一步增加,可能是由于此时ScAFP仅降低了冰晶对淀粉有序结构的损伤,并未能降低无定形区物质的损失,这与XRD结果一致;在-40、-80 ℃冷冻处理后,淀粉回生黏度显著降低,可能是由于此时ScAFP抑制了冰晶对淀粉颗粒的损伤,减少了内部脂质、蛋白等物质的损失,在回生过程中与直链淀粉结合抑制了淀粉的短期回生,从而延缓了淀粉的回生。

表3 不同冷冻温度下原淀粉和添加ScAFP淀粉的糊化特性
2.5 热力学特性
原淀粉的起始温度、峰值温度和终止温度分别为52.68、61.20、68.00 ℃。在-20 ℃冷冻处理后,起始温度显著下降,糊化焓低于原淀粉。淀粉糊化的热转变温度代表了双螺旋顺序的完美程度,糊化焓代表了双螺旋的含量[6,17]。热转变温度和糊化焓的降低说明冰晶破坏了淀粉的有序结构。添加ScAFP后,冷冻淀粉的糊化起始温度和糊化焓显著增加,表明ScAFP降低了冰晶对淀粉有序结构的损伤。
在-40、-80 ℃冷冻处理后,未添加ScAFP的淀粉起始温度、峰值温度、终止温度和糊化焓都显著增加,这可能是由于在冷冻过程中,淀粉颗粒损伤,无定形区物质损失,低温诱导内部淀粉分子发生重排,淀粉链之间的结合增强,双螺旋数量增加,有序性增强,因此糊化所需的能量增加。添加ScAFP后,冷冻淀粉的起始温度、峰值温度显著降低,终止温度无显著变化,淀粉糊化温度范围变宽,可能是由于ScAFP降低了冰晶对淀粉颗粒结构的损伤,减少了无定形区物质的损失,限制了支链淀粉的流动性,从而减少了淀粉链之间的结合,导致双螺旋结构的有序性相对较低[22]。糊化焓显著升高,这可能是由于ScAFP降低了冰晶对淀粉颗粒的损伤,在一定程度上保护了淀粉的完整性、稳定性,因此糊化所需的能量更高。

表4 不同冷冻温度下原淀粉和添加ScAFP淀粉的热力学特性Table 4 Thermal properties of starches added with ScAFP under different freezing temperatures
3 结论
探究了冷冻温度和龙柏叶抗冻蛋白对小麦淀粉水合特性、粒径、晶体结构、糊化特性和热力学特性的影响。结果表明:冷冻温度较高时,形成的冰晶对淀粉颗粒产生的机械破坏较大,导致淀粉颗粒结构损伤,无定形区物质损失及部分有序结构被破坏,糊化焓降低,而添加ScAFP可以有效抑制冰晶对淀粉有序结构的损伤,提高淀粉糊化的热转变温度和糊化焓;冷冻温度较低时,形成的冰晶小,仅导致淀粉颗粒表面损伤,无定形区游离物质浸出,而对淀粉内部有序结构无显著损伤,且低温诱导淀粉链重排,有序结构有所增加,淀粉回生趋势增加,而添加ScAFP可以有效降低冰晶对淀粉颗粒的损伤,降低内部物质浸出,减缓冷冻小麦淀粉的短期回生。因此,在不同冷冻温度下冷冻小麦淀粉时,ScAFP均可以有效降低冰晶对小麦淀粉的损伤,且在较低冷冻温度冷冻时,能够抑制冷冻淀粉的回生,并有可能改善冷冻淀粉基食品的老化。本文主要对淀粉体系进行了研究,而冷冻面团及其他冷冻淀粉基食品具有复杂的组分体系,在这种情况下,龙柏叶抗冻蛋白是否会与其他组分相互作用以及这种作用是否会影响其对食品组分及食品整体品质的改良还有待进一步的探究。

