11β-羟基类固醇脱氢酶1/2在激素性与酒精性股骨头坏死患者骨组织中的差异表达
何晓铭,何敏聪,林天烨,陈镇秋,张庆文,何伟,魏秋实
过量激素和酒精刺激骨髓间充质干细胞(bone marrow stromal cells,BMSCs)成骨能力减弱、成脂能力增强是导致股骨头坏死(osteonecrosis of the femoral head,ONFH)的主要原因[1,2],其调控机制尚未明确。最近研究发现,外源性激素对骨代谢的影响与骨组织中11β-羟基类固醇脱氢酶(11β-hydroxysteroid dehydrogenase,11β-HSD)1活性调控的局部内源性激素水平有关[3];酒精也可引起局部内源性激素水平升高,应用11β-HSD抑制剂后可减少小鼠对酒精的摄取量[4]。11β-HSD1是激素前受体信号的调控因子,可使无生物活性的皮质醇转化为有生物活性的皮质醇从而增加细胞内源性激素的水平[5],而内源性激素的活性水平与BMSCs成骨、成脂能力密切相关。基于11β-HSD1的活性与内源性激素水平的相关性,推测内源性激素在ONFH 的发病过程中起重要作用,在激素、酒精与BMSCs活性变化之间可能存在11β-HSD1调控的内源性激素代谢途径参与ONFH的发病过程。11β-HSD2是11β-HSD家族的另一成员,研究发现11β-HSD2转基因鼠的骨形成率明显增高[5]。既往研究主要集中在11β-HSD与内源性激素的相互作用,尚未将其与疾病的发生发展建立联系。因此,深入研究11β-HSD家族蛋白在不同病因导致ONFH发病中的作用,将对了解ONFH的发病机制具有重要意义。本研究通过组织病理学、分子生物学技术观察激素性与酒精性ONFH患者骨标本中11β-HSD1/2蛋白的表达差异。
1 资料与方法
1.1 一般资料
从2015 年8 月至2016 年4 月行全髋关节置换术(total hip arthroplasty,THA)切除下来并储存于广东省中医骨伤研究院的ONFH 患者股骨头标本中,随机选取酒精性及激素性ONFH 标本各15 例,收集其相应的临床和影像学资料。激素组:男10 例,女5例;年龄44~56 岁,平均(49.8±5.3)岁;体重指数(body mass index,BMI)为21.2~23.1 kg/m2,平 均(22.1±0.9)kg/m2;ARCO Ⅲ期8 例,ARCO Ⅳ期7例。酒精组:男12 例,女3 例;年龄46~57 岁,平均(50.1±4.3)岁;BMI 为21.9~22.9 kg/m2,平均(22.4±0.4)kg/m2;ARCO Ⅲ期7 例,ARCO Ⅳ期8 例。两组患者的年龄、BMI 和性别分布无明显统计学差异(P>0.05),具有可比性。
本研究已通过医院伦理审查委员会审批(伦理批号:【2019】072),并在中国临床试验注册中心注册(ChiCTR-RPC-15006290),患者均签署知情同意。
1.2 试剂与仪器设备
主要试剂有甘油醛3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(杭州华安生物技术公司,货号:ET1601-4),RIPA裂解液(上海碧云天生物技术公司,货号:P0013B),多聚甲醛溶液(广州四和生物科技股份有限公司,货号:SH268C),乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)脱钙液(广州四和生物科技股份有限公司,货号:SH5546),二甲苯透明剂(广州罗恩生物科技有限公司,货号:R017750),11β-HSD1、11β-HSD2抗体(英国Abcam公司,11β-HSD1抗体货号:ab141454,11β-HSD2抗体货号:sc-365529)。
主要仪器设备有Leica 组织切片机、Leica TP1020 自动组织处理机、Leica Autostainer XL 自动染色机、Leica 自配图像分析软件等;Odyssey 红外激光扫描成像系统(LI-COR公司,美国);光学电子显微镜DP70(Olympus公司,日本)。
1.3 病理学观察
应用硬组织切片机按照10 mm厚度从前向后将股骨头标本切成不同面积的冠状位切片,分别选取两组股骨头样本中面积最大及其前后各1 个切片中坏死区、硬化区和正常区最完整的骨组织(即每个区域各3个切片,10 mm×10 mm×3 mm)置于4%多聚甲醛溶液固定24 h,EDTA 微波脱钙,经75%、85%、95%、100%的酒精梯度脱水,二甲苯透明,石蜡包埋,5 μm厚切片,常规HE染色。由2名研究者独立计算10倍镜下5个随机视野的空骨陷窝数、切片的总空骨陷窝数,若两名研究者计算的空骨陷窝数存在差异则重新计算,直至结果一致,空骨陷窝率=5个随机视野的空骨陷窝数/总空骨陷窝数。
1.4 蛋白质印迹法检测
先进行样品制备,从液氮中取出股骨头不同区域(坏死区、硬化区、正常区)的骨组织称重后放至已预冷的研磨钵,迅速将其研磨至粉末状,按50 mg 骨组织取200 μl RIPA 裂解液提取骨组织总蛋白,蛋白质定量试剂盒测量总蛋白浓度。随后分别制备10%分离胶及5%浓缩胶,每组取30 μl样品,与适量比例的缓冲液充分混匀,置于100°C沸水浴中加热2~3 min,100 V电泳。经过转膜、封闭、抗体孵育,采用Odyssey红外激光扫描成像系统进行扫膜,并用Image J软件对条带灰度的数据采集并分析,将11β-HSD1/GAPDH,11β-HSD2/GAPDH的比值作为蛋白表达水平的参数,对两组不同区域的股骨头组织进行相对定量分析。
1.5 免疫组织化学染色技术
将包埋的石蜡切成厚4 μm 的薄片,常规脱蜡至水,微波抗原修复,使用En Vision两步法对不同区域的骨组织进行免疫组织化学染色技术,检测11β-HSD1和11β-HSD2的表达。使用光学电子显微镜,在200倍光镜下观察结果,并进行图像采集。采用Image J软件对免疫组织化学染色结果进行定量分析,以阳性区域百分比(%Area)作为11β-HSD1、11β-HSD2的量化指标并进行比较。
1.6 统计学方法
使用SPSS 24.0 软件进行统计学分析,数据以均数±标准差表示。组间数据比较采用独立样本t检验,P<0.05为有统计学差异。
2 结果
2.1 大体标本观察
激素组(图1A、B)与酒精组(图1C、D)患者骨组织切片大体观察,可以将内部结构分为坏死区、硬化区和正常区。两组的共同特点是均有骨小梁连续性中断,骨小梁吸收区域有囊变被肉芽组织取代,坏死区(1区)为淡黄色致密组织,硬化带为灰白色坚硬组织,硬化区(2 区)下方为正常组织区(3 区)。激素组坏死区与硬化区之间有坏死骨吸收、肉芽组织形成及血管新生的痕迹,坏死区被软骨和硬化区所包绕,硬化区下方为正常组织区。酒精组坏死区与硬化区之间有坏死骨吸收,吸收区内填充纤维组织,血管新生痕迹不明显。
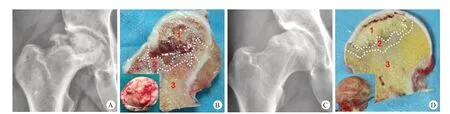
图1 激素组(A、B)与酒精组(C、D)患者髋部正位X线片及股骨头大体标本的冠状切面(1.坏死区;2.硬化区;3.正常区)
2.2 病理学观察
激素性与酒精性ONFH骨组织切片坏死区、硬化区和正常区不同放大倍数的HE 染色结果可见两组均有坏死区骨质结构紊乱、骨髓坏死、骨陷窝空虚,激素组骨小梁结构和连续性破坏更严重;硬化区骨质连续,但不规则,可见骨髓细胞,骨陷窝内填充骨细胞,酒精组骨小梁更粗,连续性更好;正常区脱钙后骨质较少,可见骨髓细胞,骨陷窝内填充骨细胞(图2)。激素组坏死区的空骨陷窝率明显高于酒精组坏死区(P<0.05,图3)。
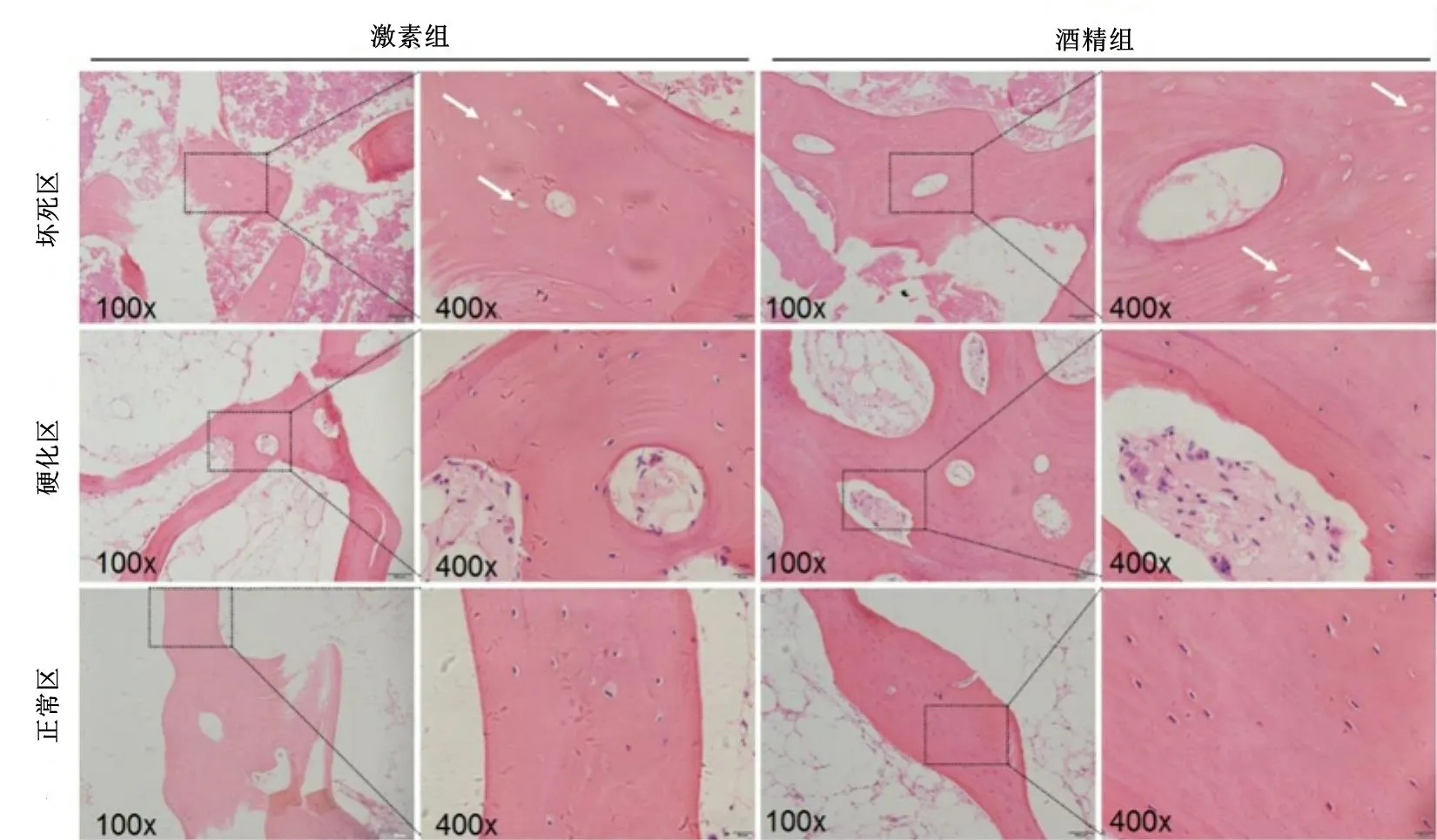
图2 激素组与酒精组患者股骨头标本坏死区、硬化区、正常区的HE染色
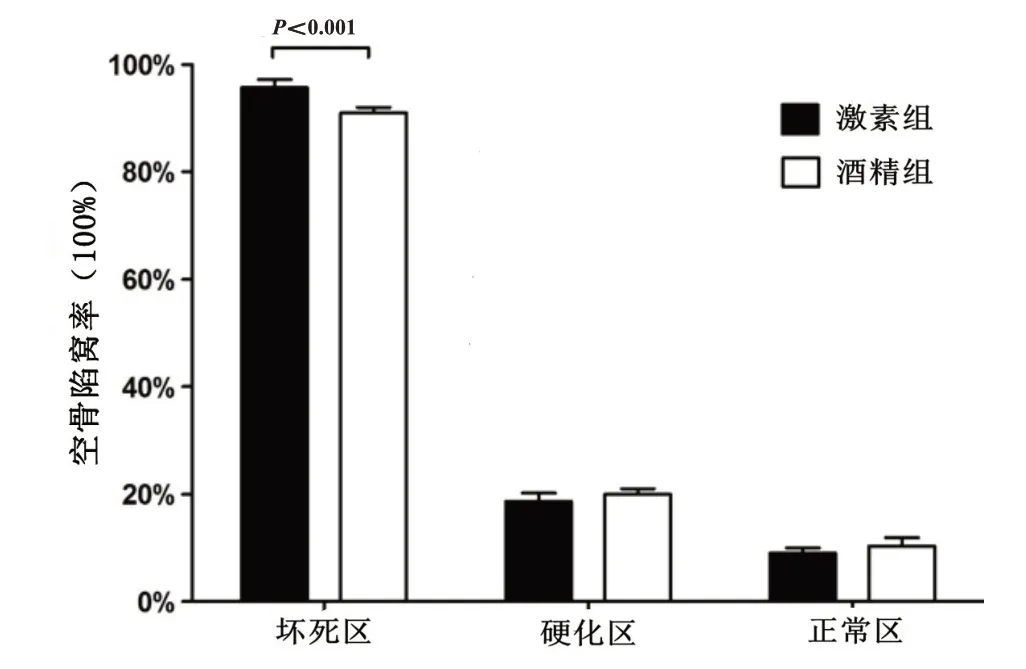
图3 激素组与酒精组患者股骨头标本不同区域的空骨陷窝率
2.3 蛋白质印迹法定量分析
应用蛋白质印迹法定量分析激素组与酒精组患者股骨头坏死区、硬化区和正常区的11β-HSD1、11β-HSD2表达情况(图4)。

图4 激素组与酒精组患者股骨头组织中11β-HSD1/2蛋白表达
经灰度值计算后对激素组与酒精组患者股骨头组织不同区域的11β-HSD1/GAPDH、11β-HSD2/GAPDH进行比较。酒精组患者股骨头组织的坏死区、硬化区和正常区的11β-HSD1/GAPDH 均高于激素组(图5A);酒精组患者股骨头组织的坏死区、硬化区和正常区的11β-HSD2/GAPDH均高于激素组(图5B)。
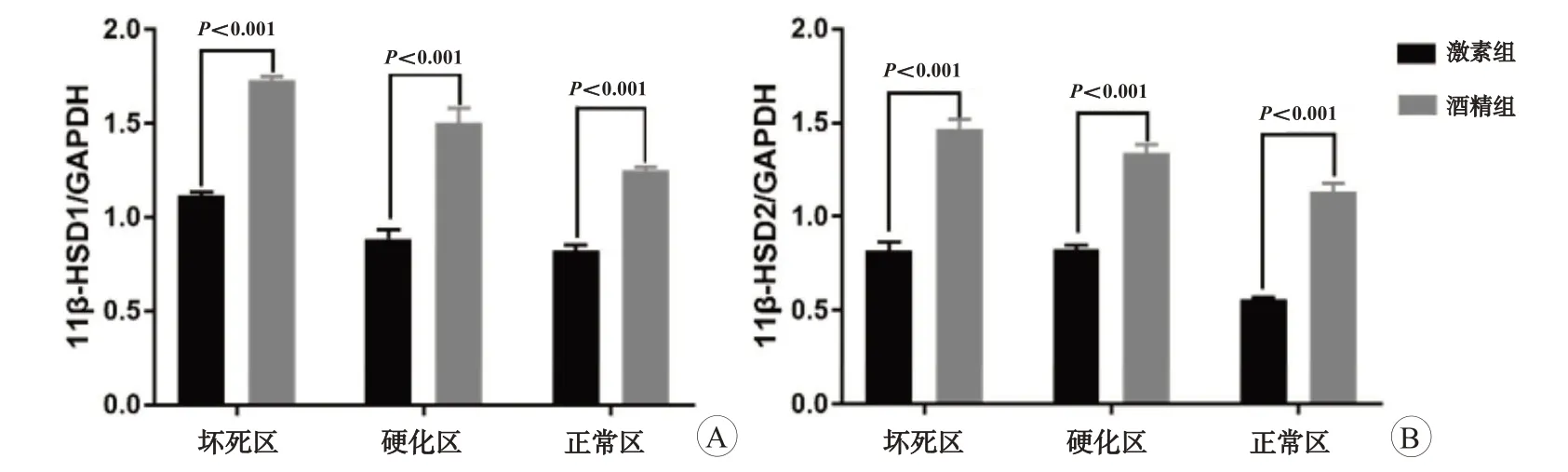
图5 激素组与酒精组患者股骨头组织中11β-HSD1/GAPDH(A)、11β-HSD2/GAPDH(B)的比较
2.4 免疫组织化学染色结果分析
光镜下,11β-HSD1、11β-HSD2 主要存在于骨组织细胞中,酒精组坏死区骨组织细胞中11β-HSD1的阳性区域百分比(%Area)大于激素组(P<0.001),两组的硬化区、正常区的11β-HSD1表达比较无统计学差异(P>0.05),两组的坏死区、硬化区及正常区的11β-HSD2表达差异无统计学意义(P>0.05,图6、7)。
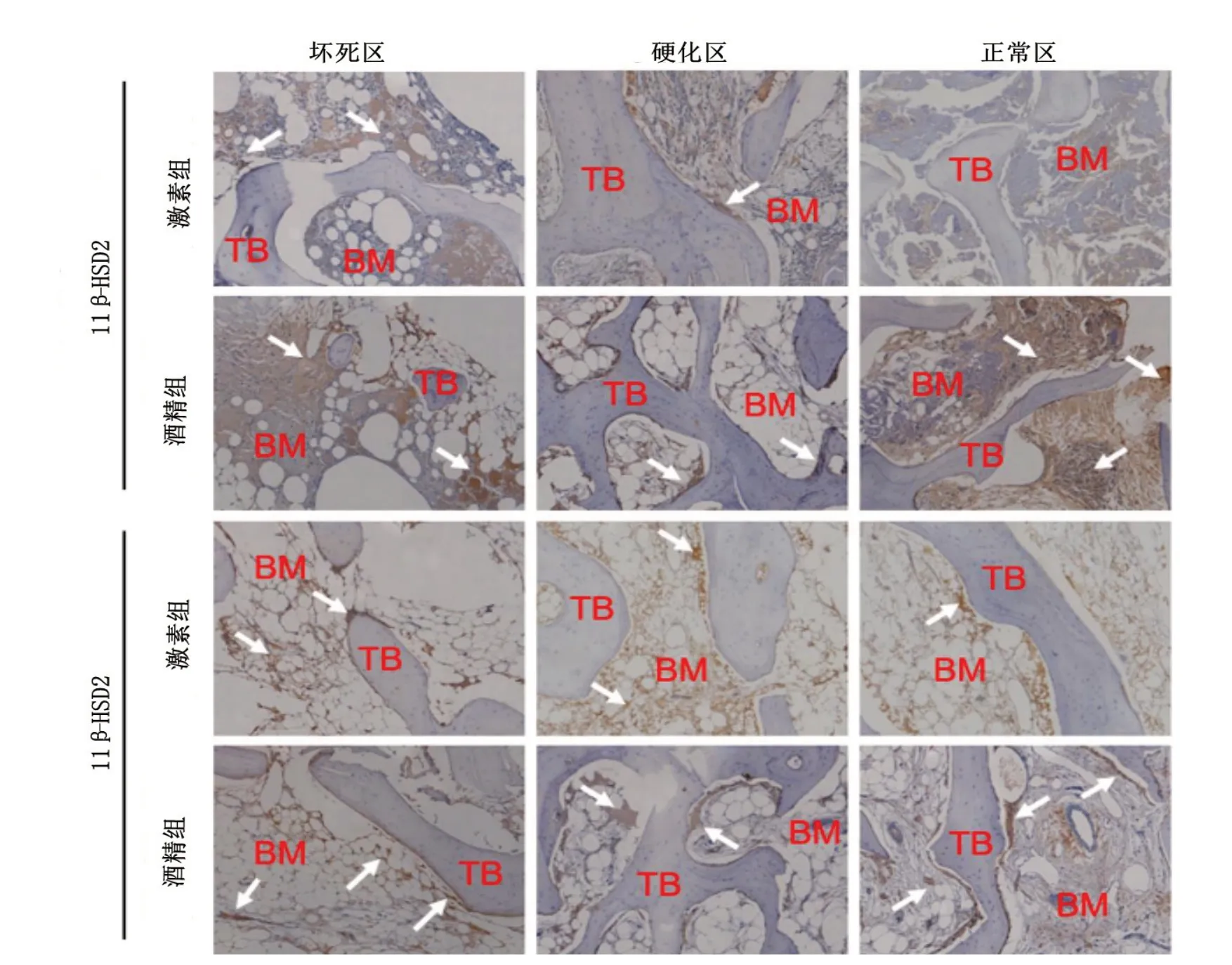
图6 免疫组织化学染色结果分析激素组与酒精组患者股骨头组织中11β-HSD1/2蛋白表达
3 讨论
3.1 外源性激素和酒精通过影响BMSCs 参与ONFH的病理进程
长期大剂量、不规范地应用激素可导致ONFH[6],其过程隐匿,致残率较高[7]。BMSCs 上存在激素受体[8],激素通过这些受体对BMSCs 进行调控,可诱导BMSCs自噬、抑制BMSCs向成骨细胞分化并促进其凋亡、促进脂肪细胞分化等[9,10]。Sheng 等[2]发现激素诱导BMSCs 成脂肪分化能力增强、成骨能力减弱而引起的脂肪代谢紊乱可能是导致ONFH 的主要原因之一。有研究表明,酒精以剂量依赖性的方式诱导BMSCs的过早衰老,引起其成骨分化减弱,加速骨量丢失[11]。同时,酒精亦可导致局部内源性激素水平升高,抑制BMSCs的活性,有学者通过应用11β-HSD抑制剂后可减少小鼠对酒精的摄取量,减小酒精对BMSCs的副作用[4]。源于BMSCs的成骨细胞数量相对减少、活性下降及脂肪细胞数量增多是ONFH发病过程中的主要病理改变[12],但体内激素代谢的作用机制仍不清楚。
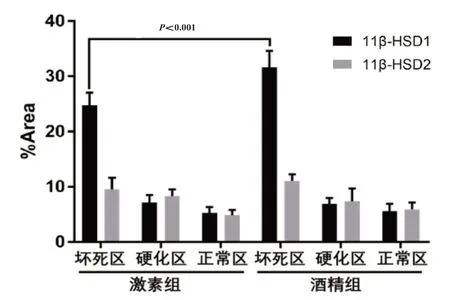
图7 激素组与酒精组患者股骨头组织中11β-HSD1/2蛋白的定量分析
3.2 11β-HSD1 可能通过影响BMSCs 的成骨分化参与激素性和酒精性ONFH的病理进程
11β-HSD1 作为激素前受体信号的调控因子[13],是体内重要的微粒体酶,在众多组织(骨、脂肪、皮肤、肌肉、滑膜、肝组织等)中发挥调节激素代谢的作用[14]。外源性激素对骨代谢的影响与骨组织中的11β-HSD1 活性调控局部内源性激素水平有关[15],11β-HSD1 活性过高时可导致内源性激素过量,引起体内炎症反应[12]及炎症介导的骨丢失[3,16,17]。Morgan等[5]通过剔除小鼠体内11β-HSD1 基因可实现服用特定类型激素药物治疗伴有高血压、肥胖症等疾病的患者免于副作用的影响。Wu 等[18]研究发现高剂量的激素可抑制前成骨细胞分化,11β-HSD1 的过表达可明显抑制脱氢皮质酮促成骨分化能力,而11β-HSD1 抑制剂BVT.2733 几乎可完全消除这种抑制作用,这与Park 等[19]的研究认为11β-HSD1 抑制剂可促进干细胞的成骨能力一致。由此可见,无论是应用有活性的激素还是无活性的激素治疗疾病,引起副作用的核心在于使11β-HSD1 的活性过度表达[20]。11β-HSD2 具有单一氧化脱氢作用,可使细胞内部功能活跃的具有生物活性的皮质醇转变为无生物活性的皮质酮,以降低糖皮质激素的作用。研究发现11β-HSD2 转基因鼠的骨形成率明显增高,在成骨细胞中,白介素1β(interleukin 1β,IL-1β)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)可刺 激11β-HSD1 表达,下 调11β-HSD2 表 达[21],在Col2.3-11β-HSD2 转基因小鼠的成骨细胞过表达11β-HSD2 可明显减少骨关节炎的范围[22]。由此可见,11β-HSD1 和11β-HSD2 通过特有的代谢途径均可对成骨能力产生影响,过表达11β-HSD1 可抑制成骨,而11β-HSD2 的作用相反。
有研究通过观察病理标本发现激素性ONFH 的骨质破坏特点为溶骨性破坏,而酒精性ONFH的骨质破坏特点则为凝固性骨质坏死[23],本研究发现激素组患者股骨头的骨小梁结构和连续性破坏均较酒精组严重,激素组坏死区的空骨陷窝率明显高于酒精组;蛋白质印迹法定量分析结果提示酒精组患者股骨头骨组织的坏死区、硬化区和正常区的11β-HSD1、11β-HSD2的表达均高于激素组;免疫组织化学染色结果提示两组患者坏死区骨细胞中的11β-HSD1存在差异,酒精组患者坏死区的11β-HSD1 高于激素组,而两组的11β-HSD2在坏死区、硬化区和正常区中无明显差异。综上,可推测11β-HSD1 在激素性与酒精性ONFH 患者骨组织中有特异性的表达,酒精组患者坏死区的11β-HSD1表达高于激素组。外源性激素治疗疾病的作用途径非常复杂,主要与受体结合发挥作用。根据本研究结果推测,酒精及外源性激素引发的副作用是由11β-HSD1驱动的内源性激素积聚所引起的。成骨减弱或成骨不全是ONFH的一个病理特点,而长期大剂量摄入酒精、激素可激活11β-HSD1,其过表达引起BMSCs 的生物活性改变,导致机体成骨减弱,因此11β-HSD1、ONFH、成骨减弱之间可能存在因果联系。有研究认为在激素性ONFH中可能存在循环:过量激素可激活11β-HSD1,从而导致BMSCs的生物活性改变,成骨信号通路受到抑制,同时激活成脂信号通路,引发成骨减弱、成脂增强,最终导致ONFH[24]。再结合酒精对BMSCs 生物活性抑制与11β-HSD1 有关,故推测11β-HSD1通过影响成骨活动紧密参与激素性和酒精性ONFH 的病理进展。激素性ONFH 的骨质破坏特点为溶骨性破坏,与破骨异常相关,而酒精性ONFH 的骨质破坏特点则是凝固性骨质坏死,与成骨异常相关。考虑11β-HSD1、酒精性ONFH 与成骨的关系更紧密,可能是酒精性ONFH 骨组织中11β-HSD1 的表达高于激素性ONFH 的原因,然而其具体机制尚不明确,这也正是今后的研究方向。哪些信号分子或代谢因子参与11β-HSD1、11β-HSD2的代谢与调控仍是未知,其具体机制亦尚未明确,需更深入研究以证实11β-HSD1、11β-HSD2与ONFH病理进程的相关性。
3.3 本研究的局限性
首先,本研究受客观条件的影响,缺乏正常的股骨头组织作为空白对照组;其次,尚缺乏细胞层面的实验验证本研究的结果。本课题组将在今后的工作中开展更进一步的研究。
4 结论
激素性与酒精性ONFH患者骨组织中11β-HSD1、11β-HSD2的表达存在差异,11β-HSD1在激素性与酒精性ONFH 患者骨组织中的特异性高于11β-HSD2,酒精性ONFH 患者坏死区的11β-HSD1 表达高于激素性ONFH。长期应用激素和饮酒所致ONFH 的效应可能与其调控11β-HSD1的表达有关。11β-HSD1、ONFH、成骨减弱三者之间可能存在因果联系,深入研究11β-HSD1介导的内源性激素代谢途径在ONFH发生发展中的作用对了解ONFH 的发病机制具有重要的现实意义。
【利益冲突】所有作者均声明不存在利益冲突

