肿瘤浸润淋巴细胞在三阴性乳腺癌中的浸润情况及意义
王 艳,许 波,刘先富
三阴性乳腺癌(triple negative breast cancer,TNBC)特指雌激素受体(ER)、孕激素受体(PR)表达均为阴性,且人表皮生长因子受体(HER-2)表达缺失的一种复杂难治的乳腺癌亚型[1]。在ECOG-2100试验中,TNBC的发生率为32%,在RIBBOn-1和AVADO试验中,TNBC的发生率分别为23%和22%。TNBC侵袭性高,易发生内脏转移和神经系统转移[2]。除了手术、化疗、放疗,缺乏有效的靶向治疗,同时由于TNBC表现出来的临床和遗传特征,有效低毒的化疗方案选择有限,有必要寻找到新的评估预后的方法和治疗手段。有报道[3]称在黑素瘤、乳腺癌、结肠癌中肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)的存在与对免疫疗法的增强反应有关,肿瘤淋巴细胞浸润和活化是宿主抗肿瘤免疫应答的关键组分,是预后良好的标志。本研究主要探讨TILs在TNBC中的浸润情况及其与预后的关系。现作报道。
1 资料与方法
1.1 标本来源 收集2017年1月至2018年6月在蚌埠医学院第一附属医院甲乳病区就诊的45例女性TNBC病人的临床和病理资料,统计肿瘤的位置、肿块大小、阳性淋巴结个数、组织学分级、临床分期、手术方式、化疗方案、基质中和癌巢的TILs浸润情况等数据。所有病人的手术均由同一治疗团队完成。入组的所有病人在手术前均未进行过辅助性的化疗、放疗及靶向治疗。用苏木精-伊红染色法检测TNBC瘤巢和基质内的TILs表达情况。截至2021年10月,随访39~57个月,中位随访年龄50岁。
1.2 TILs在TNBC中的表达 TILs浸润程度在0%~10%之间为低表达,11%~40%为中表达,41%~100%为高表达(见图1)。此过程由病理科2位高年资医生双盲完成。
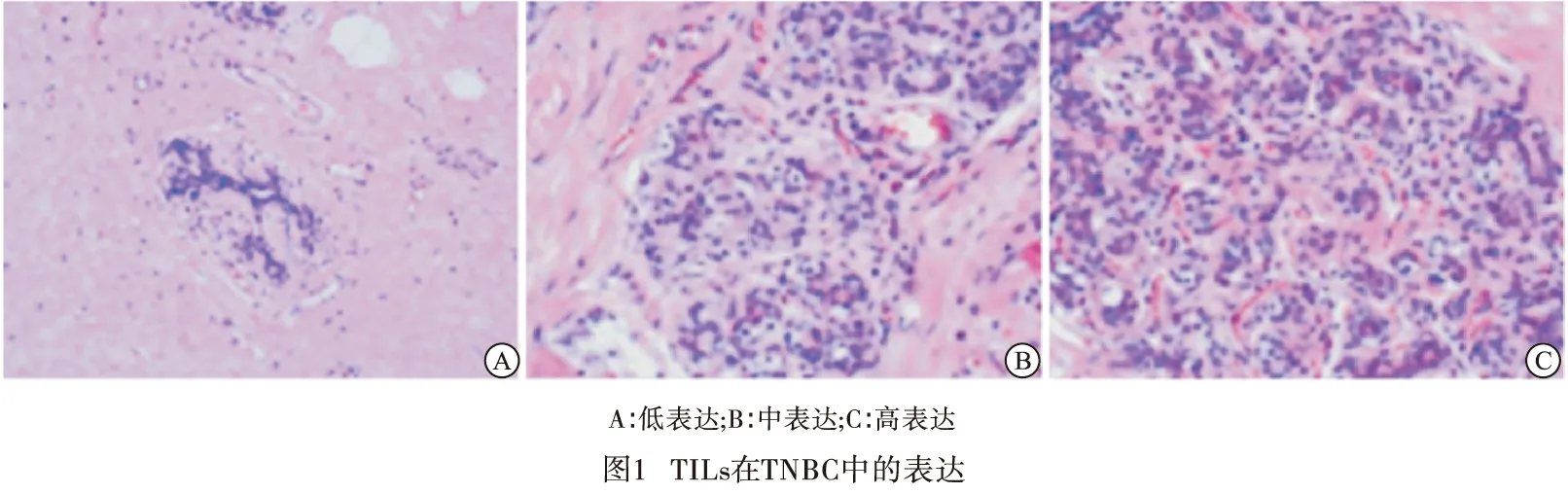
1.3 随访 使用电话询问和门诊随访形式,术后病人依照乳腺癌CSCO指南进行治疗。末次化疗结束后病人遵照指南前两年每3个月复查一次,第3年每半年复查一次,之后若无病情变化可一年复查一次。常规复查首先需对患侧胸壁、对侧乳房、双侧腋窝、双侧锁骨上淋巴结区域及肝脏部位进行彩超评估,并进行血常规、CA153、胸部CT检查,头颅磁共振1年一次。TNBC转移复发作为研究终点。
1.4 统计学方法 采用Spearman秩相关性检验、Kaplan-Meier分析。TNBC预后相关因子用COX比例风险模型进行单变量和多变量分析。
2 结果
2.1 ITILs在TNBC中的表达情况 根据TNBC标本原发灶中基质中TILs(STILs)和癌巢内TILs(ITILs)的表达情况,按照浸润水平的高低进行统计分类,整体TILs取ITILs和STILs的平均值见表1。
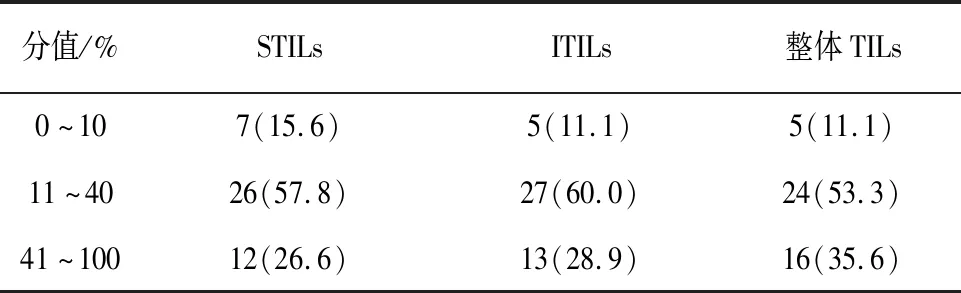
表1 TILs在TNBC基质和癌巢中的表达分布情况[n;百分率(%)]
2.2 TNBC 总生存率(OS)和无病生存率(DFS)影响因素的单因素分析 用不同病人的临床病理参数作为自变量,用OS及DFS作为因变量,进行COX单因素分析,结果显示,淋巴结阳性的个数多少和临床分期是OS、DFS的相关因素;STILs、ITILs、ITILs也是OS、DFS的相关因素(见表2)。
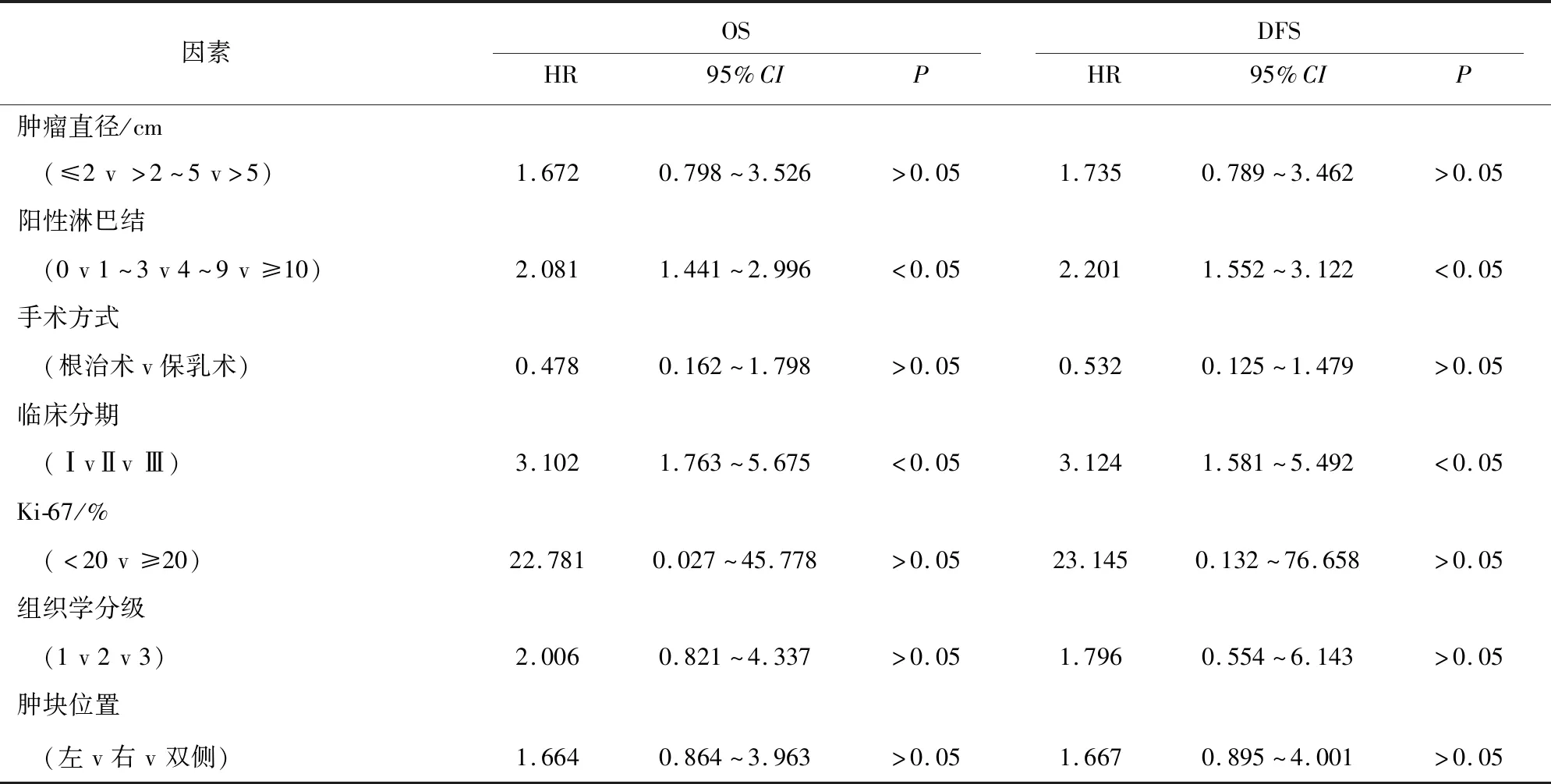
表2 TNBC OS和DFS影响因素的单因素分析
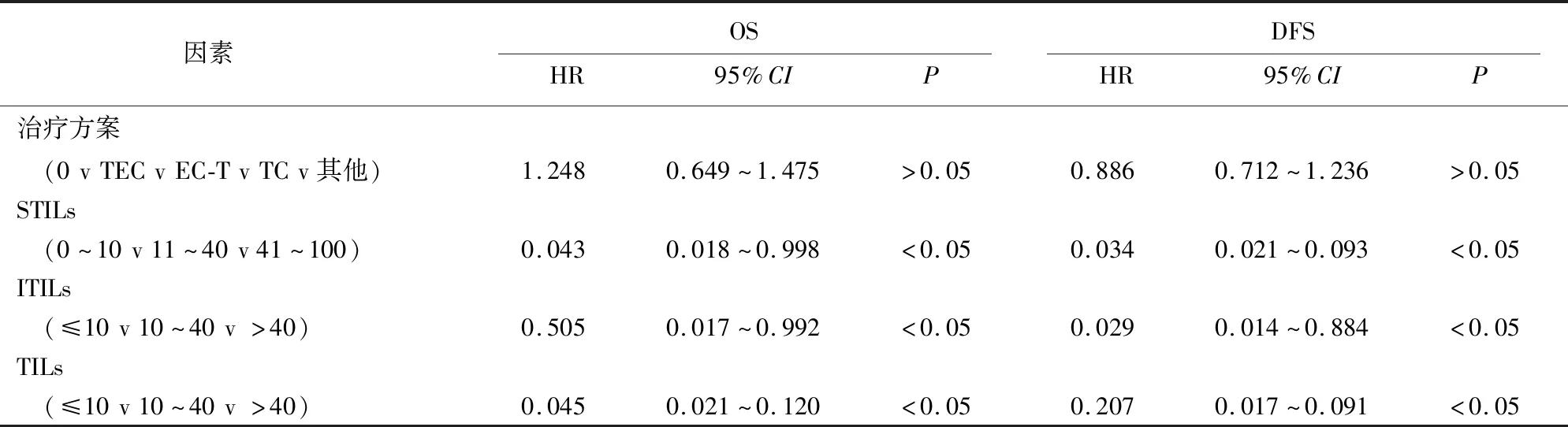
续表2
2.3 TNBC OS及DFS影响因素的多因素分析 把P<0.05认定为有统计学意义,把COX单因素分析筛选出来的5个指标进一步进行多因素分析,可以得出以下结论: STILs、ITILs、ITIL是OS、DFS的保护因素。STILs、ITILs、ITIL的表达水平越高,病人的OS和DFS越高,病人预后越好(见表3)。
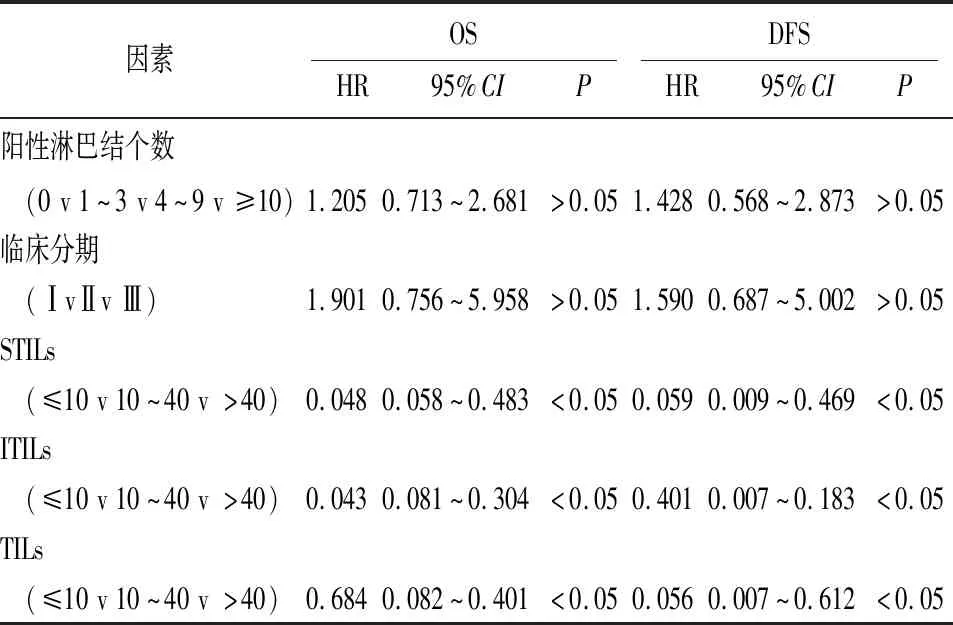
表3 TNBC OS和DFS影响因素的多因素分析
3 讨论
乳腺癌是女性最主要的肿瘤类型,是女性与肿瘤相关的死亡的第二大原因。虽然进行了几十年的流行病学和临床研究,乳腺癌的发病率仍在持续上升。乳腺癌是一组疾病的集合,浸润性导管癌和浸润性小叶癌是比较常见的类型。根据激素受体表达情况乳腺癌可分为LuminalA型、LuminalB型、HER2阳型、三阴性四种亚型。LEHMANN等按照基因表达的不同进一步将TNBC细分为基底样1、基底样2、管腔雄激素受体亚型以及以肿瘤浸润淋巴细胞和肿瘤相关间充质细胞为特征的M型四种分子亚型。这种组织病理学的分型是对乳腺癌实施精准治疗的第一个关键步骤。TNBC中ER、PR、HER-2表达均为阴性,多为高级别浸润性导管癌,早期复发率高,常伴有远处转移,绝经前女性常见,在非裔美国人的后代中更普遍[4]。虽然手术、化疗、放疗、靶向治疗、内分泌治疗等手段联合明显改善了乳腺癌总体的预后,但是TNBC的临床结果仍然不容乐观。TNBC比其他乳腺癌亚型早期复发率更高,约1/3的病人会在确诊5年内复发。转移性TNBC的总生存时间约为18个月[5]。这一事实更凸显了为TNBC病人开发更有说服力的预后标志物和更有效的治疗方法的迫切性。
既往观念一直认为乳腺癌是低免疫原性肿瘤,但近年来越来越多的学者在乳腺癌的样本中发现了免疫浸润。宿主微环境是预测免疫检查点反应的一个重要因素,尤其是TILs作为免疫原性指标备受关注。TILs主要是指浸润在癌巢周围和周边间质里的一组淋巴细胞[6],被认为是离开血液进入肿瘤的单核免疫细胞,是多种T细胞、B细胞、自然杀伤细胞、Treg细胞等跟炎症相关的一系列免疫细胞的混合物,同时包括在原发性乳腺癌肿瘤和周围微环境中发现的B细胞和调节性CD4+T细胞[7]。TILs是肿瘤微环境的重要组成部分,它们在肿瘤微环境中的作用可以用免疫编辑理论解释。2010年DENKERT首次报道了TILs与乳腺癌预后相关,尤其是CD8T细胞和基于蒽环类/紫杉的NAC方案的临床疗效是线性相关的。一项大型临床试验数据证实在TNBC中,TILs水平的升高和复发生存率的改善之间存在很强的线性关系[8]。另一项关于TNBC病人的前瞻性数据的综合分析显示,高数量的TILs表明获得免疫反应具有相对良好的预后[9]。TNBC暂时没有发现特异性的靶点,找到与预后相关的评价指标在评估、制定方案方面具有极其重要的意义。
本研究一共筛选了45例病人,随访39~57个月,中位随访年龄50岁。从STILs、ITILs、TILs在TNBC中的浸润分布可以看出,TNBC中肿瘤浸润淋巴细胞低表达者较少,中、高表达者较多。BIG 02-98实验进一步分析可发现在三阴性亚组里LPBC的预后明显优于非LPBC,在其他亚型的乳腺癌里并没有发现同样的规律。ECOG2197同样证实了肿瘤浸润淋巴细胞与预后相关。有学者在TNBC新辅助治疗的研究中发现CD8+TIL、Foxp3+TIL与病理缓解率正相关,但也有学者得出Foxp3+TIL与病理缓解率负相关的结论。TILs可以细分为多种类型的淋巴细胞,不同淋巴细胞在疾病中的功能可能有所不同。TNBC病人STILs、ITILs以及TILs的浸润水平可能是TNBC改善预后的重要靶点,这为研发针对TILs的新的免疫靶向治疗药物提供了新的思路。临床上有必要常规检测TNBC病人的TILs的表达情况。TNBC病人的OS和DFS影响因素的多因素分析显示,STILs、ITILs、TILs在原发灶中的浸润表达越高,病人的OS和DFS便越好。LOI收集了9项研究的2 148例病人的信息建立了一个多变量模型,在该模型中,STILs每增加10%,IDFS、DDFS、OS事件发生的风险分别降低10%、14%、12%。对来自6个新辅助化疗联合随机临床试验的数据进行分析后发现,低、中、高表达的TILs的病理缓解率分别为31%、31%、50%。ECOG1199试验得出的结论是TNBC中与DFS和OS有关的指标只是基质中的TILs,我们的结果与之不一致。分析原因一方面是因为研究对象不同,不排除不同人种间存在一定差异;二是本研究样本量较少,试验结果存在一定局限性;最后可能与检测方法不同有关,ECOG1199选用的是免疫组织化学的方法,而本研究应用的是苏木精-伊红染色法。
TILs是抗肿瘤免疫反应的重要组成部分[10]。近年来已被提出在恶性黑素瘤、胃肠道癌中有预后价值[11]。高水平的TILs特异性表型(CD4、CD8、FOXP3)对TNBC的远期预后有积极的预测作用[12]。TNBC异质性强,具有肿瘤相关巨嗜细胞微环境和独特的TILs表达,TILs是肿瘤微环境中的重要因子,在肿瘤的发生和发展中发挥重要作用[13],TILs甚至被用来预测新辅助治疗后残留疾病的预后。这可能与TILs支持B细胞激活和浆细胞产生抗体的综合反应的抗肿瘤反应有关。TNBC目前的难题在于缺乏评估预后的指标和靶向治疗[14-15]。本研究证实了STILs、ITILs、TILs与预后正相关。此结论尚需进一步开展大型研究验证。TILs作为评估预后的指标具有简便、获得成本低等特点,临床容易推广。免疫治疗作为TNBC常规治疗的一部分,关于TIL的相关问题未来需要进一步探索研究,并结合临床实际情况提出更多新的问题。

