炎症微环境下骨髓间充质干细胞上清液内细胞因子表达及其对成骨分化的影响
李晨晨,吴亚星,刘翠翠,孟 箭,张 静,,3
牙周组织的慢性、持续性炎症导致牙槽骨病理性吸收,最终造成牙齿松动甚至脱落,为成年人失牙的主要原因[1-2],如何促进牙周骨组织再生成为目前研究的热门话题。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)具有取材方便、易在体外培养、扩增等优势,在一定条件下具有成骨分化的潜能,是组织工程技术常用的种子细胞[3-4]。
大量文献[5-6]显示炎性环境下BMMSCs具有免疫调控功能,通过与免疫细胞相互作用,分泌多种具有生物活性的细胞因子,如白细胞介素(IL)-6、IL-8、IL-1β、转化生长因子-β(TGF-β)等,参与不同的信号通路。当处于炎症环境时,BMMSCs通过减少炎症因子分泌、调节局部炎症微环境发挥其抗炎及免疫抑制作用[7-8]。在BMMSCs进行成骨诱导时,碱性磷酸酶(ALP)、Runx相关转录因子2(Runx 2)、骨钙素(OCN)等成骨相关蛋白表达增高。但是,炎症环境下BMMSCs成骨相关蛋白表达及骨向分化机制尚不完全清楚。本研究拟通过检测炎性环境下BMMSCs各成骨相关蛋白表达、上清液内相关细胞因子的表达以及这些炎症因子对BMMSCs骨向分化中的影响。现作报道。
1 材料与方法
1.1 仪器和材料 人骨髓间充质干细胞(ScienCell,美国);DMEM培养基(Gibco,美国);人肿瘤坏死因子-α(TNF-α)(Peprotech,美国);胎牛血清(Fetal bovine serum,FBS,杭州四季青生物公司);酶联免疫检测仪(Bio-Tek,美国);BCA蛋白浓度试剂盒(碧云天);化学发光Western blotting试剂盒(Pierce公司);ELISA检测试剂盒(R&D Systems,美国);BCA细胞蛋白提取试剂盒(碧云天);ALP抗体(Santa Cruz Biotechnology,美国);Runx 2抗体(Millipore,美国);HRP标记抗鼠二抗(博士德,武汉);OCN抗体(Santa Cruz Biotechnology,美国);HRP标记抗兔二抗(Promega,美国)。
1.2 方法
1.2.1 Western blotting检测炎性环境下BMMSCs内成骨相关蛋白(ALP、OCN、Runx2)的表达 将2×104细胞密度的BMMSCs细胞悬液接种于25 cm2培养瓶中,分为4组:空白对照组(仅更换培养液);成骨诱导组(osteogenic medium,OM);TNF-α炎症刺激组;TNF-α刺激+OM组。10 %FBS的DMEM 培养,待细胞汇合至50 %时空白对照组仅更换培养液,OM组换矿化诱导液(含有50 μg/mL维生素C、10 % FBS的DMEM培养液、10 mmol/L β-甘油磷酸钠、1×10-8mol/L地塞米松),炎症因子刺激组为培养液内加入100 ng/mL TNF-α,第4组更换矿化诱导液,同时加入100 ng/mL TNF-α,每3 d换液1次,7 d 后提取细胞总蛋白,GAPDH为内参,采用 Image J对成骨相关蛋白(ALP、OCN、Runx2)的表达进行条带灰度分析,计算各目的蛋白的相对吸光度值(OD值)=目的蛋白/GAPDH。
1.2.2 ELISA 检测炎性环境下BMMSCs上清液中各细胞因子的表达 BMMSCs以1×105个/孔接种于24孔板中,含10 % FBS的DMEM培养,待细胞贴壁伸展汇合至50 %后弃原培养液,更换为矿化诱导液,实验组同时加入100 ng/mL TNF-α继续培养,2 d后收集各个培养孔内的培养液,离心后取上清液进行ELISA检测。在酶联免疫检测仪上选取450 nm波长进行测定各组OD值并记录检测结果。每组样本设3个复孔,每个实验重复3次。
1.2.3 各炎症因子对BMMSCs骨向分化的影响 将2×104细胞密度的BMMSCs细胞悬液接种于25 cm2培养瓶中,用10%FBS的DMEM 进行培养,待汇合至50%时,更换矿化诱导液,对照组不做处理,实验组分别加入100 ng/mL IL-6、IL-8、IL-1β、TGF-β1、TGF-β2,继续培养,每3 d换液1次,矿化诱导7 d,提取细胞总蛋白,其中GAPDH为内参,检测成骨相关蛋白(ALP、OCN、Runx2)的表达。
1.3 统计学方法 采用单因素方差分析、SNK-q检验和t检验。
2 结果
2.1 炎症环境对骨髓间充质干细胞骨向分化的影响 TNF-α作用7 d时,Western blotting结果显示,成骨诱导组及TNF-α作用下的成骨诱导组中成骨相关蛋白ALP、OCN、RUNX2表达水平均高于相应的对照组(P<0.05);TNF-α作用下的成骨组ALP表达水平较正常条件下的成骨组高,而OCN、RUNX2表达水平却较正常条件下的成骨组低,差异均有统计学意义(P<0.05)(见图1、表1)。

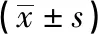
表1 不同培养条件下BMMSCs内ALP、OCN、RUNX2蛋白表达的影响
2.2 炎症环境下BMMSCs上清液中各细胞因子表达 TNF-α作用下BMMSCs上清液中IL-6、IL-8、IL-1β、TGF-β1、TGF-β2细胞因子水平均较对照组增高,差异有统计学意义(P<0.01);而TGF-β1、TGF-β2的表达水平在TNF-α作用后增加幅度较大,其中TGF-β1增幅最大(见表2)。
2.3 不同细胞因子作用下BMMSCs骨向分化蛋白的表达 各细胞因子组中ALP、RUNX2、OCN蛋白表达与对照组相比差异有统计学意义(P<0.05);其中ALP蛋白在TGF-β1组中表达水平均值为0.84±0.03,较IL-6、IL-8、IL-1β组中ALP蛋白表达水平高,较TGF-β2组低,差异均有统计学意义(P<0.05);而RUNX2和OCN蛋白在TGF-β1组中表达最高,且与其他各组相比差异均有统计学意义(P<0.05)(见图2、表3)。
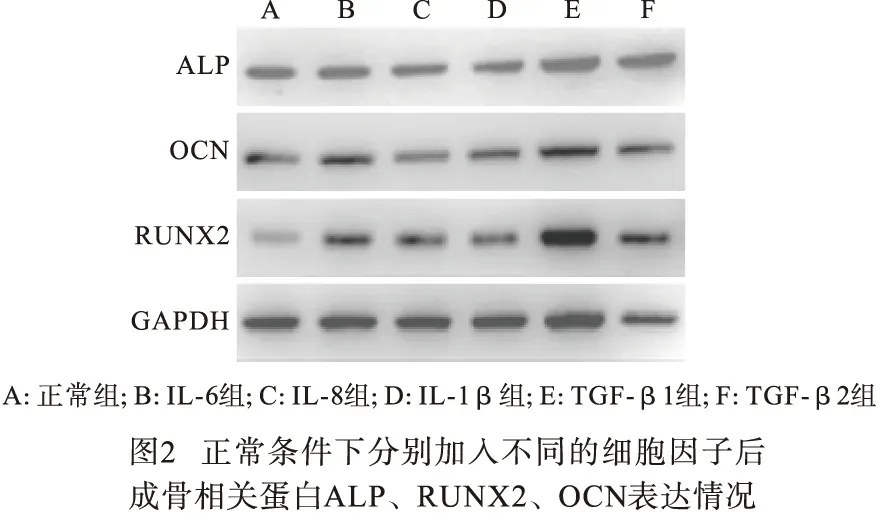
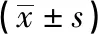
表3 分别加入不同细胞因子对不同组成骨相关蛋白相对表达量的影响
3 讨论
牙周炎主要是革兰阴性细菌细胞壁外壁中脂多糖刺激导致牙周支持组织的破坏[8]。脂多糖诱导产生的多种炎症因子共同参与炎症过程,其中TNF-α是免疫系统细胞分泌的最主要的促炎因子之一[10-11],它可以促进T细胞产生各种炎症因子,进而促进炎症反应的发生。作为机体炎症反应的重要调节因子,TNF-α通过多种复杂的信号转导通路,刺激机体局部炎症反应发生,上调炎症因子的表达,能直接或间接地抑制成骨前体细胞转化为成骨细胞并影响矿化结节的形成[12-13]。ALP是一种具有多种生物学活性的蛋白质,为骨向分化的标志酶,与硬组织钙化和修复有关。ALP的表达与细胞成骨分化状态密切相关,在矿化组织形成中发挥着十分重要的作用[14];Runx2或称核心结合因子(core binding factora1,Cbfa1),因其能激活间充质干细胞向成骨细胞系分化并能调节成骨细胞的成熟,而被作为成骨分化的关键因子,能调控多种成骨细胞标记基因(包括ALP、Col-1、BSP和OCN)的表达及最终矿化的发生[15];同时OCN主要在骨组织矿化形成期出现,被认为是成骨细胞向矿化发生期分化的标志之一。JIANG等[16]研究发现TNF-α刺激后,干细胞成骨分化能力降低,成骨相关蛋白表达降低。相反,TNF-α抑制剂可下调miR-31的表达,直接促进RUNX2的表达,增加干细胞成骨分化[17]。
在炎症因子刺激下,BMMSCs具有抑制适应性免疫应答和固有性免疫应答的功能[18]。当TNF-α等炎症因子刺激后,BMMSCs才表现出其抗炎及免疫调节能力[19]。因此本实验对在炎症微环境中BMMSCs的成骨分化及其调控机制进行研究,结果发现TNF-α作用下成骨诱导组ALP蛋白相对表达较正常环境的成骨诱导组高,但是OCN、RUNX2蛋白相对表达较正常组低,表明TNF-α作用的炎症微环境下BMMSCs成骨分化能力并没有明显减弱,可能由于BMMSCs具有抗炎特性。
炎症环境下BMMSCs可从骨髓中募集,向炎症及损伤部位迁移、增殖并分化为相应的受损细胞,通过分泌可溶性的细胞因子如抗炎因子(IL-10、TGF-β等)、促炎因子(IL-6、IL-8等)、吲哚胺2,3双加氧酶等,发挥其抗炎和免疫调节特性,进而促进牙槽骨的修复再生[20-21]。有研究[22]发现间充质干细胞在炎症刺激后的早期会分泌较多的炎症因子如IL-6、IL-8、IL-1β等,通过不同的信号转导通路,参与破骨分化的过程,促进骨组织吸收,而在炎症刺激后期,为了维持自身免疫稳定,间充质干细胞减少炎症因子分泌,增加抗炎因子的分泌,建立抗炎环境,发挥其免疫抑制作用,由炎症初期以骨吸收为主的破骨过程转化为后期以骨形成为主的成骨过程,促进骨组织生成。为进一步验证BMMSCs是否具有抗炎特性及何种细胞因子主要参与发挥间充质干细胞抗炎功能,我们对正常环境与炎症刺激48 h时BMMSCs的上清液提取并采用ELISA法检测上清液中IL-6、IL-8、IL-1β、TGF-β1、TGF-β2浓度,结果发现炎症组各细胞因子浓度均较正常组高,其中以TGF-β家族尤其TGF-β1增高最为显著,说明炎症刺激后BMMSCs可分泌抗炎因子TGF-β,证实了BMMSCs的抗炎特性,因此我们推测炎性环境诱导BMMSCs分泌的TGF-β(主要为TGF-β1)可能参与了BMMSCs骨向分化过程。为进一步明确不同细胞因子对BMMSCs成骨分化的影响,我们在正常条件下,向各组中分别加入不同的细胞因子,结果显示TGF-β1组成骨相关蛋白表达较高,证实TGF-β1主要参与BMMSCs的抗炎及其骨向分化的调控。
TGF-β是调节细胞生长和分化的TGF-β超家族,在特定的条件下能有效地介导免疫反应,抑制TNF-α表达,发挥抗炎作用,促进BMMSCs骨向分化。其中TGF-β1、TGF-β2都属于TGF-β家族中的成员,功能相似。在本实验中炎症作用下TGF-β1表达增加量较TGF-β2显著,且在正常条件下加入TGF-β1后BMMSCs成骨相关蛋白表达较加入TGF-β2高,表明TGF-β1抗炎能力较TGF-β2强。YU等[23]通过在BMMSCs矿化诱导液中加入TGF-β1和TGF-β2,检测培养液中成骨相关基因的表达情况,发现与TGF-β2相比,TGF-β1可以增加BMMSCs成骨能力;以往也有研究[24]显示TGF-β2抑制剂可使炎症下牙囊干细胞TGF-β1的表达增加,茜素红染色和ALP活性增加,这说明TGF-β1较TGF-β2可以增加炎症环境下干细胞的成骨分化能力。
TGF-β通过参与BMMSCs成骨信号通路、与免疫细胞相互作用、结合相关蛋白等方式诱导成骨。最近研究[25-26]证实在炎症环境下TGF-β诱导产生的Treg细胞具有抑制IFN-γ和TNF-α刺激产生的炎症反应,减少BMMSCs的凋亡,进而促进BMMSCs成骨。同时Treg细胞也可通过调节细胞因子如TGF-β调控干细胞成骨分化的过程[27]。但目前关于炎性环境下TGF-β如何与免疫细胞相互作用促进牙周骨组织再生的机制尚不清楚,仍需进一步研究。

