WASF3反义寡核苷酸对非小细胞肺癌细胞增殖和迁移的影响及其机制
余治国,李延光
非小细胞肺癌(non-small cell lung cancer,NSCLC)传统治疗方式主要包括放疗、化疗、手术等,据统计病人的5年生存率仅约15%[1]。已知NSCLC细胞的迁移和侵袭能力与病人的预后密切相关,因此,有必要深入研究调控NSCLC细胞迁移和侵袭的关键因子,为NSCLC的治疗提供新思路[2-4]。目前已发现许多具有迁移能力的癌细胞都存在Wiskott-Aldrich综合征蛋白家族成员3(WASF3)高表达的情况,WASF3的功能与细胞运动有关,可参与神经元迁移、创伤修复以及细胞应激等过程[5],在正常细胞中处于沉默状态,WASF3基因的异常表达通过调节肌动蛋白细胞骨架重组,诱导了恶性肿瘤的发生、发展[6-7],因此推测该基因或成为降低癌细胞迁移能力的重要靶向目标,目前该基因在NSCLC中的表达及其作用机制目前尚不明确。有研究[8-11]证实,磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)信号通路是促进肺癌细胞间充质转化进程的主要调节途径,可使肿瘤细胞运动及迁移能力增强。本研究选择NSCLC病人A549细胞和正常肺细胞MRC-5为研究对象,比较2种细胞中WASF3表达水平;设计针对WASF3的反义寡核苷酸(WASF3-AS),通过质粒转染A549细胞,观察其对A549细胞增殖和迁移能力的影响,并探讨其作用机制。现作报道。
1 材料与方法
1.1 细胞与试剂 人NSCLC细胞A549和人正常肺细胞MRC-5购自武汉原生原代生物医药科技有限公司。TRIzol和脂质体2000转染试剂购自美国Invitrogen公司;WASF3-NC、WASF3-AS及PCR引物序列均由上海康成生物工程有限公司设计合成,其中WASF3-NC序列为:5′-AGU CAC AAU CCU GAU UAG ACA U-3′,WASF3-AS为:5′-AUC ACU UAC UUA CGA GUG UUG A-3′;胎牛血清、RPMI-1640培养基购自上海玉博生物科技有限公司;RNA提取试剂、PCR试剂盒均购自美国Invitrogen公司;CCK-8试剂购于上海威奥生物科技有限公司;Transwell小室购自美国Millipore公司;鼠抗人磷酸酶和紧张素同系物PTEN、磷酸化蛋白激酶 B(p-Akt)单克隆抗体,兔抗人磷脂酰肌醇-3-激酶(P13K)单克隆抗体,鼠抗人GAPDH单克隆抗体均购自美国Invitrogen公司。
1.2 方法
1.2.1 细胞培养与转染 A549细胞培养于含10%胎牛血清的 RPMI-1640培养基,37 ℃、5% CO2培养箱中孵育,收集对数生长期细胞进行实验。细胞转染使用阳离子脂质体法:将A549细胞分为空白对照组、WASF3-NC组(阴性对照组)、WASF3-AS组(反义寡核苷酸 WASF3组),转染前将细胞接种于6孔板中,培养至70%~80%融合后,按照脂质体2000说明书,使用无胎牛血清的培养基进行转染,转染后孵育6 h,更换为含10%胎牛血清的 RPMI-1640培养基,在培养箱培养48 h,用于后续实验。
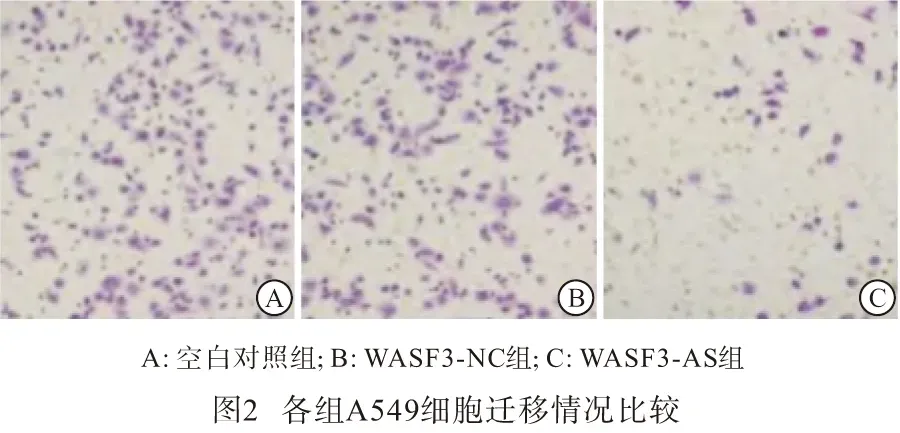
1.2.2 RT-qPCR法 Trizol法提取A549和MRC-5细胞总RNA,逆转录合成cDNA。WASF3、PTEN、PI3K、p-Akt和GAPDH引物序列均由上海康成生物工程有限公司设计合成,WASF3上游5′-GTG GAT CGT ACA TGC G-3′,下游5′-GCA TGC CAT ATG ATT CCG GCC-3′;PTEN上游5′-TCT CCT ATT CGG TGT GGA AGC AC-3′,下游5′-CCT TAC AGT GCA CTT ATA TTA A-3′;PI3K上游 5′-CCT GTT GAC CAG CTA GGT G-3′,下游5′-CAG TCT AGC AGA CAAG AC-3′;p-Akt上游5′-ACA CCG GGA CTT CGT CCG AG-3′,下游5′-TGC TGC TAC ACA GGC TTA TA-3′;内参GAPDH上游5′-GTT CTC TAG GTC GAG AGA G-3′,下游5′-CTT CTC ACG ACT CGA GGA G-3′。反应条件:94 ℃预变性10 min,94 ℃ 30 s,退火延伸30 s,72 ℃ 1 min,32~35个循环后,72 ℃再延伸10 min,中止反应。琼脂糖凝胶电泳,采用凝胶图像分析系统(GENE GENIUS)采集图片,然后应用Quantity one(Bio-Rad,CA)凝胶分析软件得出电泳谱带吸光度值,计算各组目的基因谱带与GAPDH基因谱带吸光度值的比值,并进行基因表达差异分析。
1.2.3 CCK-8法 取对数生长期的3组A549细胞,0.25%胰蛋白酶消化后计数,按1.5×106个/孔,加入96孔板,设4个复孔分别培养24、48、72、96 h,每孔加入CCK-8液10 μL作用2 h,使用酶标仪读取各孔490 nm波长处的吸光度值。
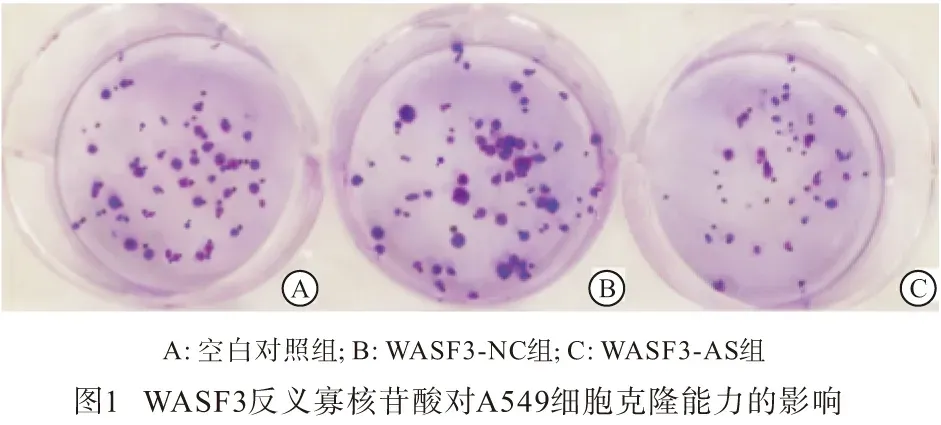
1.2.4 细胞克隆实验 取对数生长期的A549细胞,以400个/孔接种于6孔板,轻微摇晃细胞板,使细胞分散均匀,置于37 ℃、5% CO2培养箱中孵育2~3周,当细胞克隆肉眼可见时终止培养,弃去培养板中培养基,再用磷酸盐缓冲液洗涤3次,甲醛固定15 min,吉姆萨染色20 min,冲洗后干燥,拍照、计数细胞克隆数目,计算细胞克隆形成率=(克隆数/接种细胞数)× 100%。
1.2.5 Transwell细胞迁移实验 取对数生长期各组细胞悬浮液,将细胞浓度调节至5×105/mL,每组设5个复孔。上室中加入200 μL细胞悬浮液,下室加入600 μL含10%胎牛血清的RPMI-1640培养基,常规培养24 h;PBS漂洗去除上室中未迁移的细胞,甲醇固定,0.1%结晶紫染色,显微镜下每孔取 5个视野观察并拍照,统计各组迁移细胞数目。
1.2.6 Western blotting法 A549细胞转染48 h后,加入全蛋白提取液,离心收集上清液,应用BCA法测定蛋白浓度。各组收集等量的目标蛋白样本,行SDS-PAGE凝胶电泳,蛋白转至PVDF膜上,5%脱脂奶粉封闭,加入鼠抗人PTEN单克隆抗体(1∶500稀释)、兔抗人PI3K单克隆抗体(1∶500稀释)、鼠抗人p-Akt单克隆抗体(1∶200稀释)、鼠抗人GAPDH单克隆抗体(1∶1 000稀释),4 ℃过夜。TBST洗膜3次,滴加HRP标记的二抗,室温静置1 h,TBST洗膜3次,每次10 min,ECL显色,暗室中曝光、显影、定影,Quantity one软件对扫描图像进行分析。
1.3 统计学方法 采用方差分析和q检验。
2 结果
2.1 各组细胞中WASF3表达水平比较 RT-qPCR实验结果显示,与人正常肺细胞MRC-5比较,A549细胞各组中WASF3的mRNA相对表达量均增加(P<0.05~P<0.01);空白对照组和WASF3-NC组的WASF3的mRNA相对表达量差异无统计学意义(P>0.05),但均高于WASF3-AS组(P<0.05和P<0.01)(见表1)。
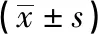
表1 各组细胞中WASF3表达水平比较
2.2 A549各组细胞增殖能力比较 转染后24 h,3组A549细胞增殖水平之间差异无统计学意义(P>0.05);与WASF3-NC组比较,转染后48、72、96 h WASF3-AS组细胞增殖水平明显降低(P<0.05)(见表2)。
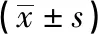
表2 A549各组细胞增殖能力(吸光度值)比较
2.3 A549各组细胞克隆形成率和细胞迁移数目比较 细胞转染14 d后,观察培养皿中克隆形成结果显示,与空白对照组和WASF3-NC组比较,WASF3-AS组细胞克隆形成率和细胞迁移数目均明显降低(P<0.05)(见表3及图1、2)。
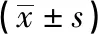
表3 A549各组细胞克隆形成率和细胞迁移数目比较
2.4 各组A549细胞中PTEN、PI3K、p-Akt mRNA和蛋白相对表达量比较 与空白对照组比较,WASF3-NC组PTEN、PI3K、p-Akt mRNA和蛋白相对表达量差异均无统计学意义(P>0.05);与WASF3-NC组比较,WASF3-AS组细胞的PTEN mRNA和蛋白相对表达量明显增加,PI3K、p-Akt mRNA和蛋白相对表达量明显减少,差异均有统计学意义(P<0.05)(见表4、图3)。
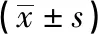
表4 各组A549细胞中PTEN、PI3K、p-Akt mRNA和蛋白相对表达量比较
3 讨论
肺癌是我国致死率较高的恶性肿瘤之一,其中85%~90%的肺癌为NSCLC[12]。随着肺癌免疫治疗和分子靶向治疗的发展,针对肺癌发生的分子机制和肿瘤关键标志物值得进一步探讨[13]。近年研究证实WASF3基因在正常细胞中处于沉默状态,而在多种肿瘤细胞中异常激活,有研究[14-15]认为WASF3基因的异常表达可通过重组肌动蛋白骨架进而促进恶性肿瘤的发生发展。
PI3K/Akt 信号通路是多种肿瘤发生的关键调控路径,在多种人类肿瘤中普遍存在,在肺癌中也发现 p-AKT的表达明显高于正常组织,并促进肺癌的迁移[16]。PTEN是人染色体缺失的张力蛋白同源基因,同时具有脂质磷酸酶和蛋白磷酸酶活性,可使PI3K激活后产生的三磷酸磷脂酰肌醇(PIP3)去磷酸化,进而抑制PI3K/Akt信号通路的活性,因此PTEN是PI3K/Akt信号通路的主要负调控基因,具有抑癌活性。PTEN基因在胃癌、肺癌、宫颈癌等肿瘤中存在不同程度的突变、缺失或低表达,导致P13K/Akt信号通路活化,进而促进肿瘤的发生发展[17],目前认为PTEN-PI3K/Akt信号通路可调节多种肿瘤细胞生长增殖、凋亡、迁移、浸润等过程。本研究结果发现,NSCLCA549细胞的WASF3相对表达量明显高于人正常肺细胞MRC-5细胞,提示WASF3基因的异常激活可能参与了NSCLC的发生与发展。转染WASF3-AS后,WASF3-AS组的WASF3相对表达量明显减少,提示转染成功;WASF3-AS组的A549细胞增殖水平、细胞克隆形成率、细胞迁移个数均明显低于空白对照组与WASF3-NC组,提示WASF3-AS能抑制A549细胞的增殖和迁移;WASF3-AS组细胞PTEN mRNA和蛋白表达水平明显高于空白对照组与WASF3-NC组,PI3K、p-Akt mRNA和蛋白表达水平明显低于空白对照组与WASF3-NC组,提示NSCLC细胞可能通过激活PTEN基因负向调节PI3K/Akt信号通路,进而抑制NSCLC细胞的增殖、克隆形成和迁移。

