靶向微泡介导超声辅助溶栓技术研究进展
许涛 周畅
三峡大学第一临床医学院超声科(湖北宜昌443000)
超声波的热效应、空化效应、机械效应等特定的生物学效应,使得超声波除了可以利用生物组织的声学特性进行影像成像之外,也可以其特定的能量形式,通过特定的生物学效应,发挥临床治疗作用[1]。其中超声辅助溶栓技术就是利用超声能量提高溶栓药物在血栓中的渗透效率以优化溶栓效果[2],与靶向微泡联合应用,利用靶向微泡的定向靶向特性精准递送溶栓药物至血栓部位,可增大药物聚集浓度[3],并利用空化效应以及微泡的形变特性潜在地增强溶栓药物在血栓中的渗透,以达到对特定部位血栓的精准溶栓治疗[4]。靶向载药微泡介导的超声辅助溶栓技术的发展日新月异,本文将就靶向微泡辅助溶栓的微泡分类、机制以及目前临床应用研究进展开展综述。
1 靶向微泡分类
临床常用普通微泡多为非相变微泡,它的瞬态空化无法维持而不能在微循环中的血栓靶区完成安全范围内的药物释放[5]。因此,具有良好的声学相变能力以维持稳态空化且能目标靶向的微泡制备成为溶栓的关键。在微泡表面装载靶向部分,例如多糖、多肽、抗体、适配体和磁珠等小分子物质,利用生物小分子的生物素-亲和素相互作用特性或磁能定向引导,使得载药靶向微泡能在血栓表面显著富集以达到溶栓所需药物浓度,以此来改善溶栓效果。目前研究多利用血凝块成分的特异构象与表达所提供的分子表位来选择耦联在微泡表面的靶向部分,主要是基于抗体或配体,也有在微泡表面耦联磁珠,通过体外磁场的引导到达靶区并定向富集。不同靶向微泡的具体构成及其发挥生物学效应的机制示意图见图1。目前靶向溶栓微泡研究众多,主要分为以下几类。
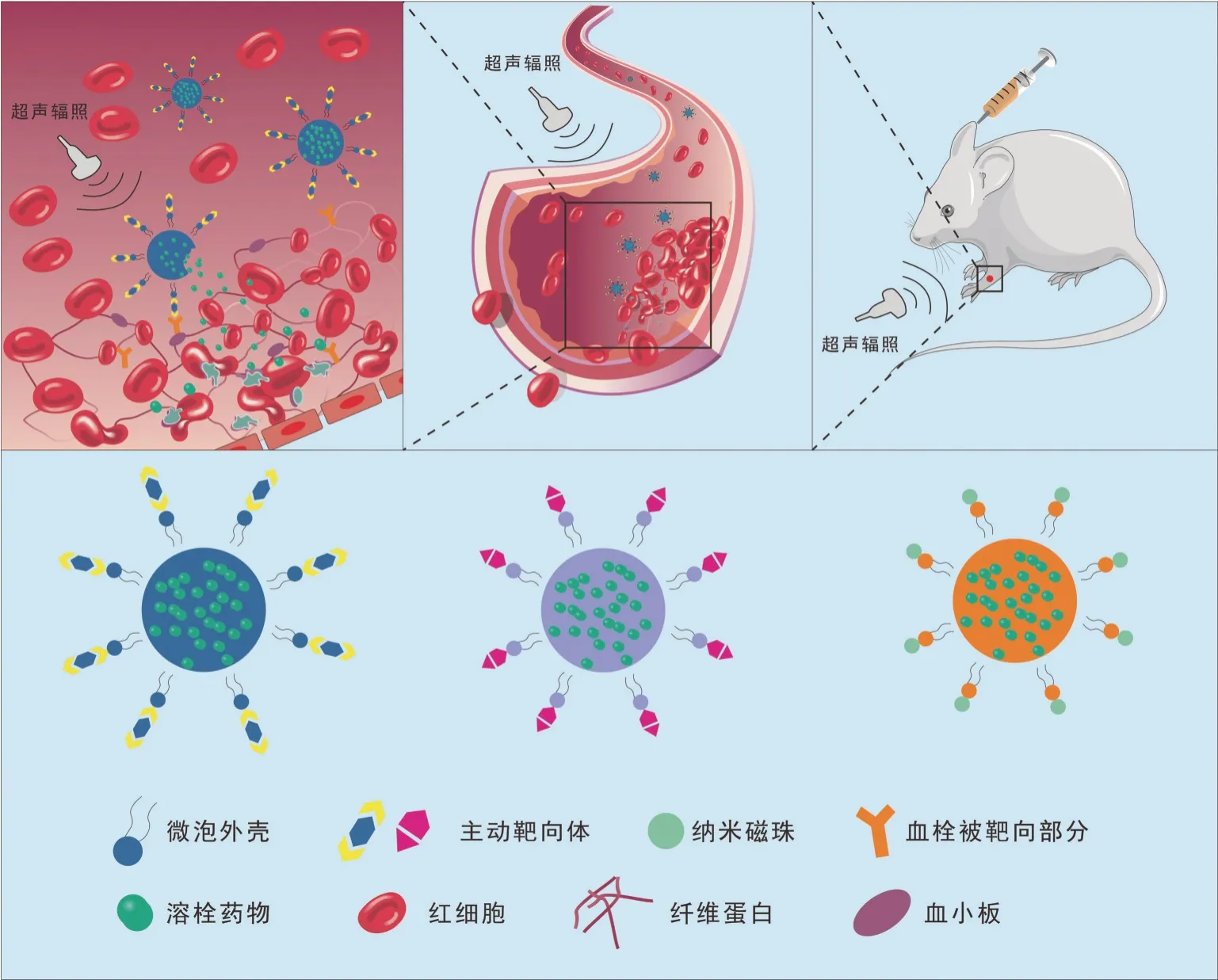
图1 不同靶向微泡的具体构成及其发挥生物学效应的机制示意图Fig.1 The specific composition of different targeted microbubbles and the mechanism of their biological effects
1.1 纤维蛋白靶向微泡 纤维蛋白是血栓的主要成分,在动静脉血栓中的浓度都很高且不存在于正常的循环中,利用纤维蛋白作为微泡的特异性靶区,识别血栓并靶向富集可以提高微泡辅助溶栓的效价。氨基酸序列为Cys-Arg-Glu-Lys-Ala(CREKA)的短肽是一种对纤维蛋白有高亲和力的多肽,体内外研究均证实其修饰的结构可在纤维蛋白沉积部位累积[6]。此类微泡在归巢至血栓时靶向体不改变化学结构,结合稳定性强,溶栓药物富集率高。为进一步提高CREKA 靶向多肽的稳定性,ZHANG 等[7]利用环状骨架的稳定性,成功实现环肽18F-iCREKA 靶向微泡的合成,ZANUY 等[8]则利用Byn-Methy-Glu 氨基酸序列替换CREKA 氨基酸序列里的Glu,成功制备其类似物CRMeEKA,以提高多肽抗水解能力,超声体外显像证明这些微泡可以显著提高超声诊断血栓的敏感性和特异性。
1.2 RGDs 肽段靶向微泡 RGD 肽段(Arg-Gly-Asp-Ser)是介导血栓形成中血小板聚集的血小板膜糖蛋白Ⅱb/Ⅲa(GPⅡb/Ⅲa)的拮抗剂[9],GPⅡb/Ⅲa 具有RGD 肽段特异性识别结合位点,装载RGD 肽段的靶向微泡既能通过拮抗血小板的聚集抑制血栓形成,也能通过释放微泡内封装的溶栓药物达到精准溶栓。国内研究学者应用生物素-亲和素系统桥接法成功制备RGD 及重组织纤溶酶原激活物(rt-PA)双负载靶向微泡,并在体外血栓模型中验证了其靶向显影的能力[10]。最近研究[11]发现,通过在修饰RGD 肽段侧面半胱氨酸残基之间以形成二硫键可提供更为稳定的结构增强微泡渗透能力,而运用RGD 基础序列及其远端的氨基酸的协同调控作用也能影响主动靶向体的特异性识别能力。
1.3 磁靶向微泡 一般情况下,微泡通过血液循环到达作用部位,而对于完全闭塞或血流瘀滞状态的血管来说,靶向微泡仅能自由扩散或惯性迁移到达血栓部位,微泡归巢能力弱,定向富集能力差[12]。利用体外磁场引导表面耦联磁珠的微泡,可使微泡在血栓靶区的定向富集[13-14],这降低了生物小分子带来的机体免疫反应的风险,同时避免了成分不同的血栓表面微泡富集率差异化显著而致溶栓效果不稳定[15]。将超磁性纳米微粒连接于微泡表面,可在超声下可视化监测靶向微泡在磁场作用下的运动路径及显影变化。有研究成功利用静电吸附在微泡表面交替沉积聚乙烯亚胺和磁性Fe3O4纳米粒子构建具有声场和磁场双重响应特性的磁性靶向微泡,微泡可在磁场中定向运动并在靶区通过超声辐照精准释放药物[13],这相对于耦联抗体作为靶向体的微泡来说,其制备成本更低,归巢能力可控性强。
2 靶向微泡介导超声助溶栓机制
2.1 超声波的生物学效应 超声波通过机械效应、热效应、促进血管活性酶表达等直接或间接机制促进溶栓。声波通过机械效应产生强烈的振荡,使纤维蛋白结构变得松散,暴露溶栓位点或靶区,促进与溶栓药物或靶向微泡的结合[16]。据报道,在2 ~5 MHz 范围内,震源区的声发射与裂解率呈正相关,振荡产生的血块碎片与红细胞大小相似,这将不会造成血栓靶区下游血栓再形成。稳定的空化效应在血栓周围形成微流不断地产生剪切力,分离血栓中的红细胞或离断耦联的血栓内纤维分子,扩大血栓间隙,提高溶栓药物渗透率[17]。同时,超声辐照产生的热效应可使得血栓局部升温,加速纤维蛋白的酶解。此外,超声波对于毛细血管内皮细胞的刺激作用可以提高一氧化氮合酶活性,这可以刺激微循环扩张进而改善灌注,在抑制血小板聚集的同时减少内皮细胞黏附分子的生成,提高溶栓效率并降低再栓塞风险[18]。
2.2 靶向微泡的生物学效应 靶向微泡和超声波对于溶栓具有协同效应,共同参与解聚血栓纤维蛋白网络,抑制血栓形成的过程。这得益于靶向微泡对血栓的特异性识别和深度穿透能力以及超声辐照靶向微泡的空化效应产生的协同作用。空化产生的能量使血栓表面发生爆裂,加速血栓形变裂解纤维蛋白,增大溶栓药物与血栓的接触面积[19]。KIM 等[20]通过分析射频数据来评估靶向微泡辅助溶栓的效价,可视化记录了纤溶酶渗入血栓的过程,发现随着时间的推移,血栓网络结构逐渐被侵蚀,表面发生塌陷,最终分解成微小的碎片。
3 助溶栓技术在临床中的应用
3.1 溶栓模式的探究 靶向微泡的粒径、浓度、靶向方式、包埋药物的选择和剂量、超声辐照激励参数幅值、辐照时长均会影响溶栓效价。既往研究证实溶栓效果与超声辐照频率呈反比,而超声功率及辐照时长可以在一定程度上提高微泡的占空比,影响溶栓效率[21]。曾瑶[2]在体外血栓模型中对超声激励参数幅值、占空比、辐照时间、微泡浓度进行变量优化滴定,结果表明当占空比低于5%时,溶栓率随着占空比增加而增大,而当占空比大于5%时溶栓率反而下降,这表明优化占空比可以保证最大程度的溶栓效果,又可以降低超声热效应带来的副作用[22]。纳米级脂质体双负载靶向微泡联合超声助溶栓效果更为显著,而且通过延长超声波脉冲持续时间或改变脉冲重复频率可以提高溶栓率,因为增加脉冲重复频率直接导致占空比的提高,间接促进了溶栓效率[5]。为了探索靶向微泡助溶技术在人类心血管系统的应用价值,目前研究利用非人类灵长动物模拟人体的止血机制、血流动力学环境发现调整超声辐照参数可完成对罪犯血管不同微环境的适应[23]。然而,目前的靶向微泡多为了治疗而设计,只能在低强度聚焦超声(LIFU)的激励下完成空化,释放包埋的溶栓药物发挥溶栓作用,这将是推广靶向微泡辅助溶栓技术的一大瓶颈。因此,对微泡进行改良以期在诊断超声波的辐照下完成稳态空化,能同时满足对于血栓的诊断、治疗、疗效评估的需求,仍需要进一步探索证明。再者,溶栓效率的差异受药物选择和量效关系的影响,靶向微泡载药量的选择和控制将直接关系到血管的再通和出血风险的控制,后续研究可对比分析精准递送不同溶栓药物和载药浓度对于溶栓效价的影响,这将会给临床应用靶向微泡辅溶栓安全剂量、溶栓方案的选择提供更多的循证医学证据。
3.2 助溶栓技术在疾病模型中的应用
3.2.1 缺血性脑卒中 脑血管栓塞引起脑血流灌注不足导致脑组织死亡,其有效时间窗内的血运重建治疗将显著降低患者致残率[24]。既往研究者们不仅在脑血管模型中探索了靶向微泡介导超声溶栓的疗效,有研究还利用3D 打印技术构建大脑中动脉模型来研究靶向溶栓的意义,实验证实相比于普通微泡,纤维蛋白靶向微泡精准递送药至责任血管,溶栓效果更佳[25]。3D 打印可能更真实地反映了大脑血流动力学环境,这为靶向微泡在人体血管内的溶栓应用提供了真实可靠的证据。VICTOR 等[26]在大脑中动脉血栓模型中利用永磁体引导磁性微泡辅助溶栓,其在血栓靶区的稳定空化率提高了3 倍,实验结果证实血栓裂解率因为靶向微泡的引入显著增加。与既往利用纤维蛋白及血小板膜蛋白抗体等生物分子表位靶向不同,这是首例利用其他靶向方式进行溶栓的研究,这有效地避免了溶栓药物剂量和时间窗选择错误造成的脑血管意外事件。近些年来,研究发现超声靶向微泡可以增强骨髓间充质干细胞的归巢能力,这被应用到缺血性脑卒中的溶栓治疗中以减少脑水肿和脑梗塞体积,改善神经功能评分[27]。不仅如此,缺血性脑卒中的超声辅助溶栓已经做出了临床应用的尝试,遗憾的是靶向微泡辅助溶栓的临床研究尚且不足,且目前诊疗指南尚不推荐在有效时间窗内行临床实验以外的溶栓药物。于是罗凌云等[28]证实了低频聚焦超声联合纳米微泡可以有效开放血脑屏障,并可防止毒性的物质损害脑组织。这为靶向微泡在缺血性脑卒中防治中的安全应用提供了依据,其他研究也没有显示更高的脑出血风险[29]。即使如此,人体脑组织对超声波非常敏感,超声辐照的暴露是否会造成脑组织退行性病变仍亟待更广泛的基础实验研究探索安全的溶栓模式。
3.2.2 急性冠状动脉综合征 急性冠脉综合征是发病率和病死率最高的心血管疾病之一,近些年来,研究探索了微泡联合声学造影在冠脉血栓溶解方面治疗潜力。心肌梗死的治疗策略多为冠状动脉的迅速血运重建,首选治疗方法是直接经皮冠状动脉介入治疗(PCI)。目前单中心大样本量研究证实,在急性心肌梗死患者的治疗中,载药微泡介导超声助溶栓治疗联合PCI 治疗组患者的心外膜血管再通率更高,与体内外实验相比,PCI 术前短时间的超声脉冲辐照的心外膜血管再通率更高,这证明微泡能与PCI 产生协同治疗作用[30]。心肌声学造影显像证明微泡治疗组的罪犯血管营养心肌部分显影更快,但未能证明在TIMI 3 级血流方面,靶向微泡助溶栓存在优势。不过微泡可在预防微循环栓塞,促进心功能恢复中提供更多帮助[31]。PCI 术后血管再狭窄是影响远期生存预后的直接因素,药物涂层球囊和洗脱支架的应用现已用于PCI 术后异质性再狭窄的治疗[32]。靶向微泡在这一领域同样具有价值,它能通过加速心肌梗死区域血管生成、输送抗增殖药物至血管靶区来防治PCI 术后再狭窄。在猪冠状动脉闭塞模型研究中发现,靶向微泡既可以释放包埋药物,例如紫杉醇类药物,促进其渗透到冠状动脉中膜区以延长在血管内支架的滞留时间[33],也可以通过刺激血管内皮生长因子和NO 的表达来促进血管生成,改善心肌灌注[31]。虽然目前急诊PCI 仍是临床首要的单独治疗策略,但靶向微泡辅助溶栓技术在急性冠脉综合征的前期研究中都体现了独特的价值。对于无法及时行急诊PCI 的患者来说,靶向微泡介导超声助溶栓可提供一种易于应用的、非侵入性的治疗策略选择,以获得更高的再通率和更低的并发症发生率。
3.2.3 外周血管栓塞 靶向微泡介导超声助溶栓在外周血管的实验研究分别在下肢静脉血栓(DVT)、肺动脉栓塞(PE)、肝门静脉血栓、髂静脉血栓等模型中开展。这些外周血管栓塞引起的疾病往往产生恶性临床事件,死亡率高,溶栓治疗对患者预后至关重要。利用生物素化单克隆抗体制备微泡靶向体外猪血纤维蛋白凝块,注射微泡后血凝块的基本声学反射率显著增加[34],在闭塞部分动脉血栓活体犬模型的在体研究中,也得出了相同的结论。然而,纤维蛋白抗体本身的免疫原性限制了其血管内的应用,不过在溶栓之外的领域,纤维蛋白靶向微泡有其特殊的应用价值。例如可以给术后胸、腹腔粘连的诊疗提供新的思路。在保证靶向性的同时对抗体进行表面修饰以降低其免疫原性将会真正的让患者从靶向微泡介导辅助溶栓中获益。超声助溶栓技术对人全血血凝块的溶栓效果可以通过靶向微泡介导的局部用药来优化。一项荟萃分析证实靶向微泡介导的超声助溶栓治疗让接受系统性溶栓治疗的PE 患者的肺动脉平均压(PAMP)、右心室/左心室比率和CT 梗阻评分都显著降低,大大提高了患者远期生存率[35]。ENGELBERGER 等[36]通过测量D-二聚体水平变化和血栓重量减少的百分比来评价溶栓效果也证明了这一点。CHEN[37]和WANG 等[3]分别在体外和体内建立大鼠下肢红色和白色血栓栓塞模型,利用血管再通率、平均血流速度、后肢灌注和骨骼肌损伤标志物水平评价溶栓效果,结果证明磁靶向微泡可以显著提高溶栓效价,与常规溶栓相比,残余血栓减少了67.5%。深静脉血栓模型因为构建实验模型易得而被广泛研究,而肺栓塞模型中靶向微泡助溶栓效果的实验研究尚且不足,成功构建活体主肺动脉栓塞模型成为探索其价值的关键。限制磁性微泡应用的难点在于磁场响应性随着距离增大而衰减,因此优化提高磁性微泡在活体深部血栓的磁场响应性是目前研究需要重点解决的问题。再者,目前也并未对磁性微泡体内对比度特性进行量化评价,有待于在今后的研究中加以补充完善。除了溶栓治疗,靶向微泡同样适宜于四肢动脉血栓溶栓后微循环栓塞的预防。GUAN 等[10]在兔股动脉血栓栓塞模型中进行RGDs 靶向微泡联合尿激酶辅助溶栓,成功实现血管再通后发现了预防溶栓后微栓塞发生的最佳超声辐照频率、时间与药物剂量的最佳组合方式[38],这项研究的局限性在于兔的显微出血类型和人类出血之间没有相关性,尚需要中长期的生存研究以动态监测出血风险,确保临床应用的安全性。此外,也有类似研究关注经颈静脉肝内门体静脉分流术(TIPS)中靶向微泡助溶栓的应用,分流血栓会闭塞分流术的通道并阻碍其远期功能的实现,而靶向微泡介导的超声助溶栓的应用在缩短溶栓治疗时间窗的同时还能清除延伸至门静脉的血栓,促进TIPS 支架紧密贴壁于血管内壁,更好地发挥其缓解静脉曲张出血或腹水压力的功能,远期出血可能性低[39]。外周血管栓塞溶栓的临床前期应用研究已逐步展开,但仍需更全面、更广领域的临床应用研究以明确该项技术的可行性与安全性。
4 结语
目前,国内外研究对靶向微泡介导超声助溶栓的效果进行了广泛的体内外实验评价,溶栓效果的改善都得到了相应的证实。与此同时,靶向微泡及超声辅助激励参数的优化配置也进行了初步探索研究。但由于大部分的辅助溶栓实验只进行了体外溶栓效价的评价,缺少在体实验的结果,这虽能为选择临床溶栓药物、给药途径提供新的方案,但尚需更广泛的多中心临床试验提供更多的循证医学证据。更为不足的是,在既往体外溶栓研究中,血栓模型往往只模拟了部分血管闭塞,这并不能代表大多数体内血栓的病理特点,虽然部分闭塞也能导致急性临床症状,但仍需要更为符合病理血栓形成状态的实验模型进行验证,下一步应该构建更符合病理生理特点的实验模型,充分考虑血栓大小、形成时期、分支血管数量和角度等对溶栓效果的影响[26]。相信随着研究的深入和临床探索的实践积累,靶向微泡介导的超声助溶栓技术将确定出更为有效和安全的溶栓模式,促进溶栓技术的进一步发展。

