RNA结合基序5基因敲除子宫内膜癌细胞系及其作用研究
王赛凤 史蔚 谢咸晶
上海交通大学医学院附属国际和平妇幼保健院,上海市胚胎源性疾病重点实验室妇科(上海200030)
子宫内膜癌发病率和病死率高,是妇科恶性肿瘤之一[1-2]。RNA 结合蛋白家族中RNA 结合基序5(RBM5)是目前公认的抑癌基因[3-4]。既往研究表明RBM5 在多种肿瘤中表达异常,可影响肿瘤进展[5-7]。然而,目前RBM5 在子宫内膜癌中的作用尚未见相关报道。CRISPR/Cas9 基因编辑技术能够快速高效的进行基因敲除,操作简便、成本较低[8-9]。因此本研究通过CRISPR/Cas9 技术敲除子宫内膜癌细胞中RBM5 基因,并初步探究其对子宫内膜癌的作用。
1 材料与方法
1.1 细胞、试剂与仪器 人子宫内膜癌Ishikawa、KLE、RL95-2、Hec-1A 和Hec-1B 亲本株均来自于上海交通大学医学院附属国际和平妇幼保健院。主要试剂与仪器:PX459-puro 和pLVX-Teton 载体均来自复旦大学生命科学院。细胞培养基、胎牛血清、Opti-MEM、双抗(青霉素-链霉素)(Gibco);Trizol(Invitrogen);嘌呤霉素、Neofect(MCE 公司);高保真PCR 酶试剂盒和重组试剂盒(Vazyme Biotech 公司);抗RBM5 抗体(Proteintech 公司);抗GAPDH 抗体和辣根酶标记山羊抗兔IgG(CST 公司);PCR 仪和实时定量PCR 仪(ABI StepOnePlus);酶标仪(Molecular Devices 公司);化学发光凝胶成像系统(上海天能科技有限公司)。本研究伦理审批号为国科伦委(GKLW)2020-03。
1.2 方法
1.2.1 sgRNA设计和CRISPR/Cas9重组载体构建通过synthego 网站(https://ww.synthego.com/prod?cts/bioinformatics/crispr-design-tool)设计靶向RBM5的三组特异性sgRNA,如表1 所示,由上海捷瑞生物公司合成和构建载体。
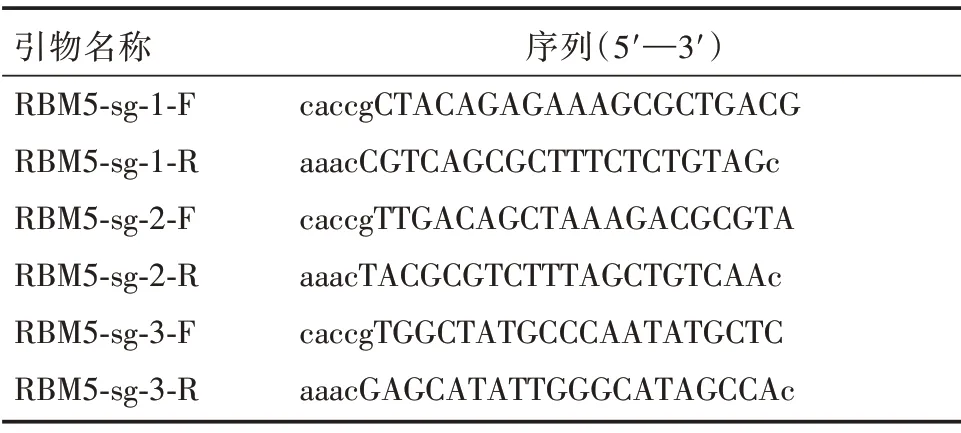
表1 靶向RBM5 基因的sgRNA 序列Tab.1 The sequence of sgRNA targeting RBM5 gene
1.2.2 构建RBM5 基因敲除细胞株 将Ishikawa细胞株铺到6孔板中,待细胞生长汇合度达到60%,利用Neofect 转染试剂体系转染细胞,分别利用Trizol、SDS 和基因组DNA 抽提试剂盒来收取细胞总RNA、总蛋白和基因组DNA。
1.2.3 RBM5 基因敲除验证Western Blot 和qRTPCR 法分析RBM5 基因表达 细胞基因组DNA由上海迈浦生物公司进行Sanger 测序。
1.2.4 回复株构建 利用慢病毒感染技术和多西环素(DOX,doxycycline)重新诱导RBM5 敲除Ishikawa 细胞株外源表达RBM5,质粒转染体系为:PSPAX 2.5 μg;PMD2G 2.5 μg;Tet-on 质粒2.5 μg 和Neofect转染试剂10 μL。室温静置15 min后滴加入培养皿,并用完全培养基补至10 mL 加入培养皿。转染方法按说明书进行。
1.2.5 CCK-8 法检测细胞增殖 3 000 个细胞/孔种植 于96 孔板内,CCK-8 100 μL 加入细胞中,37 ℃,5% CO2孵育2 h,于450 nm 波长处检测吸光度(OD)值。
1.2.6 克隆形成 200个细胞/孔种于6孔板中,1 mL 4%多聚甲醛,室温固定30 min 后换成1 mL 结晶紫,室温下静置10 min。自来水清洗后拍照。
1.2.7 Transwell 迁移实验 以6×104细胞/孔种于24 孔板,4%多聚甲醛室温固定10 min;棉签擦去小室内侧细胞拍照。侵袭实验中,按照1:10 稀释基质胶,铺板后,18 h 后固定、染色、润洗和拍照。
1.2.8 Western Blot 实验 提取总蛋白,一抗(anti-ARID2抗体1∶1 000稀释、anti-GAPDH抗体1∶10 000稀释)4 ℃孵育过夜,辣根酶标记山羊抗兔IgG 室温孵育1 h,用化学发光成像系统进行显影及条带灰度扫描,以GAPDH 为内参分析。
1.2.9 qRT-PCR 用TRIzol 法提取细胞总RNA,按照说明书将提取的RNA 反转录为cDNA,以GAPDH 作为内参基因(hmGAPDH-F:ATGACATCAAGAAGGTGGTG;hmGAPDH-R:CATACCAGGAAATGAGCTTG),qRT-PCR 检测RBM5 的相对表达水平(RBM5-F:ACAGTCCAGAGAGAGAGCGT;RBM5-R:ACTTGTCTGCTCCACATCGG)。按照2-ΔΔct法对结果进行分析。
1.3 统计学方法 采用SPSS 21.0 统计软件分析,计量资料以()表示,3 组及以上用单因素方差分析。两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 检测各子宫内膜癌细胞系中RBM5 的表达情况 在Ishikawa 和KLE 亲本株中RBM5 高表达,而Hec-1B 细胞系中RBM5 低表达(图1)。因此选择高表达RBM5 的Ishikawa 子宫内膜癌亲本株进行后续研究。
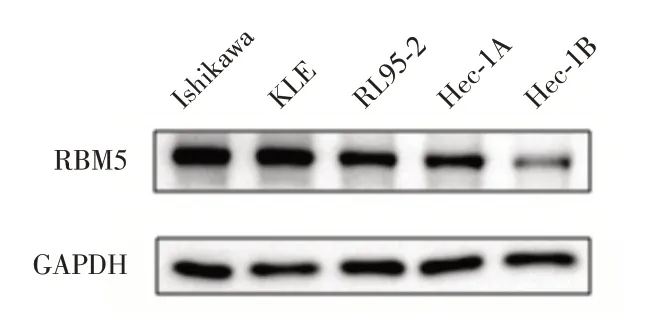
图1 子宫内膜癌细胞系中RBM5 蛋白的表达情况Fig.1 The expression of RBM5 protein in endometrial cancer cell lines
2.2 构建RBM5 敲除的Ishikawa 细胞系验证 利用CRISPR/Cas9 系统在Ishikawa 细胞系中成功构建了#1sg-RBM5 和#2sg-RBM5 两株敲除单克隆细胞系,Western Blot和qRT-PCR证实RBM5已被敲除(图2A-B,P<0.05)。Sanger测序结果均缺失了4个碱基(TATG)引起移码突变(图2C-D)。
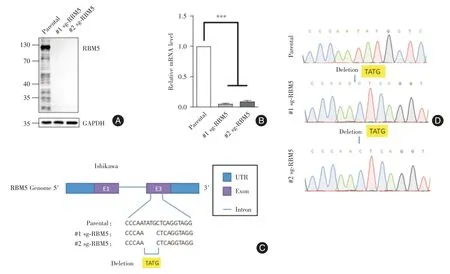
图2 RBM5 敲除Ishikawa 细胞株的鉴定Fig.2 Identification of RBM5 knockout Ishikawa cell line
2.3 在RBM5 敲除Ishikawa 细胞株中诱导外源RBM5 表达 在RBM5 敲除Ishikawa 细胞系中构建外源RBM5 可被DOX 诱导回复表达的细胞系,结果表明回复株中外源诱导的RBM5 表达(图3)。

图3 RBM5 敲除Ishikawa 细胞株中RBM5 表达Fig.3 The expression of RBM5 in RBM5 knockout Ishikawa cell line
2.4 RBM5缺失对Ishikawa细胞表型的影响 RBM5敲除的Ishikawa 细胞株和亲本株相比,其增殖能力显著增强(P<0.05),而外源诱导RMB5 表达后,增殖能力没有变化(图4A-B)。RBM5敲除的Ishikawa细胞株的迁移和侵袭能力与亲本株相比显著增强(P<0.05),而外源诱导RMB5 表达侵袭和迁移能力没有变化(图4C-D)。
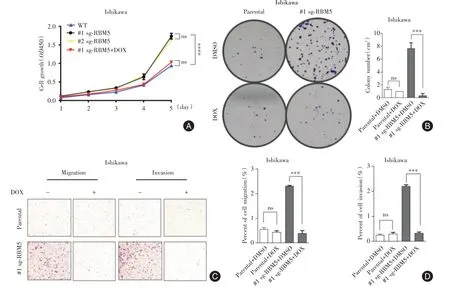
图4 RBM5 对Ishikawa 细胞表型的影响Fig.4 Effects of RBM5 on the phenotype of Ishikawa cells
3 讨论
既往报道[10-15]RBM5 在多种肿瘤中低表达,而外源性诱导RBM5 表达增加可抑制肿瘤生长。子宫内膜癌在我国发病率高,治疗难度大,因此找到新的靶点成为研究的关注目标。但RBM5 在子宫内膜癌中的作用尚未阐明。本研究通过CRISPR/Cas9 技术敲除RBM5 基因,成功构建RBM5 敲除子宫内膜癌细胞株。本研究证实选择CRISPR/Cas9基因敲除技术能够保证成功敲除RBM5 基因,进而获得RBM5 子宫内膜癌细胞敲除株,为之后的研究提供技术保障。
RBM5 作为肿瘤抑制因子可以诱导凋亡和细胞周期停滞,剪接调节casp-2,进而抑制肿瘤进展[16]。RBM5 还可以通过转录后调节机制影响p53 的活性,过表达RBM5 可以促进调节p53,进而抑制肿瘤细胞生长和克隆形成[17]。RBM5 过表达可以增强肿瘤细胞对顺铂化疗敏感性,通过抑制Wnt/β-catenin 信号通路,激活细胞溶质释放细胞色素C 和caspase9/3,诱导肿瘤细胞凋亡[18-19]。本研究发现RBM5 子宫内膜癌细胞敲除株中,肿瘤细胞的增殖、迁移和侵袭能力增强,提示RBM5 在子宫内膜癌中发挥抑癌作用,这与既往报道的RMB5 在其他肿瘤的研究结果一致。本研究首次利用CRISPR/Cas9 技术构建了RBM5 敲除株,并初步探索了RBM5 在调控子宫内膜癌进展中的相关机制。
此外,由于CRISPR/Cas9 基因编辑技术存在脱靶的可能[20-22],因此本研究又构建了RBM5 回复株,通过慢病毒感染细胞技术诱导RBM5 敲除株中外源RBM5 的表达,以排除RBM5 敲除株中可能存在的脱靶效应,进而排除脱靶效应对子宫内膜癌细胞作用的影响。
本研究存在一定的局限性,首先并未完全阐明RBM5 在子宫内膜癌中发挥抑癌作用的具体机制,这有待于进一步探索RBM5 可能参与调控的相关信号通路。此外,本研究未对临床样本中RBM5 的表达及和肿瘤临床病理特征的相关性进行分析,因此进一步研究中需分析子宫内膜癌患者肿瘤组织中RBM5 的表达或突变类型,以及RBM5 表达和子宫内膜癌临床病理参数间的关系,进而为确定RBM5 在子宫内膜癌诊断、预后或靶向治疗中的应用价值提供更有力的参考。
综上所述,本研究通过CRISPR/Cas9 系统构建了RBM5 子宫内膜癌细胞敲除细胞株,并证实RBM5 的表达缺失可以促进子宫内膜癌肿瘤细胞的增殖、迁移和侵袭,为后续进一步研究RBM5 在子宫内膜癌中是否存在突变及其调控机制提供了理论依据。

