VU0360172激活mGluR5对新生大鼠生发基质出血的保护作用
王筱雅,冯占辉,熊 英,张 晴,杨 清,陈惠心,汪朝云,左 丁,叶 兰
(1.贵州医科大学 1.基础医学院药理学教研室、2.附属医院神经内科、3.基础医学院机能学实验室,贵州 贵阳 550025)
生发基质出血(germinal matrix hemorrhage,GMH)是发生于早产儿的一类严重脑出血疾病,其出血位置源自侧脑室下方室管膜区域的生发基质层,这里是婴幼儿重要的神经发生部位,其中富含脆弱的血管。因未成熟的大脑缺乏自我调节功能,故早产儿脑部血流产生波动便极易造成血管破裂,从而发生出血[1]。GMH在早产儿及低体重出生儿中的发病率和死亡率极高,并伴有脑瘫、癫痫、发育迟缓等神经系统后遗症[2],严重危害早产儿的生命与健康。目前临床上仍然缺乏有效的治疗药物,故探索新型治疗靶点具有重要的医学意义。
代谢型谷氨酸受体5(metabotropic glutamate receptor 5,mGluR5)是一种G蛋白偶联受体(G protein coupled receptor,GPCR),在神经元细胞膜上有表达,在神经网络调节中起重要作用[3],参与突触可塑性和痛觉调节[4]。有研究发现,激动mGluR5在创伤性脑损伤[5]、蛛网膜下腔出血[6]、成人脑出血[7]、脑缺血[8]等神经系统疾病模型中发挥出较良好的疗效,有抗神经元凋亡、增强神经发生、改善神经功能的作用,但在GMH模型中的作用尚未有研究报道。VU0360172是一种新型的mGluR5正向变构调节剂,具有特异性好、口服利用率高、可透过血脑屏障等特点[9],有研究表明,用VU0360172激动mGluR5可有效改善癫痫[10]和蛛网膜下腔出血引起的神经功能损伤。本文探讨了利用VU0360172激动mGluR5对生发基质出血产生的保护作用,并初步探究其产生保护作用的机制可能与抗神经元凋亡有关。
1 材料与方法
1.1 试验材料
1.1.1动物 新生7日龄SD大鼠129只,♀♂各半,体质量(13~16) g,SPF级,购于贵州医科大学实验动物中心,生产许可证SCXK(辽)2020-0001。使用许可证SYXK(黔)2018-0001。
1.1.2主要材料与试剂 异氟烷:深圳瑞沃德生命科技有限公司;Ⅶ-S型胶原酶(批号:128M4107V):美国Sigma公司;TESCA缓冲液(pH 7.4,批号:20191114):索莱宝公司;VU0360172(批号:0586901-1):Cayman公司;都氏试剂:上海羽朵生物科技有限公司;多聚甲醛固定液、SWE快速高分辨电泳缓冲液、转膜缓冲液粉末、抗β-actin抗体(批号:Ls202319):武汉赛维尔生物科技有限公司;预染蛋白质分子量标准(批号:00864849):Thermo Fisher公司;氟化聚偏乙烯PVDF微孔转移膜(批号:R0BB23468):Millipore公司;高效封闭液:Genefist公司;抗mGluR5(批号:34r8599)、cleaved-caspase-3(批号:15z0096)、辣根酶标记山羊抗兔IgG(H+L)抗体(批号:56j9958)、ECL发光液(批号:1824c03):艾菲公司;抗Bcl-2抗体(批号:I07161556):万类公司。
1.1.3仪器 小动物麻醉机、脑立体定位仪(深圳瑞沃德生命科技有限公司);天平(METTLER TOLEDO公司);电热鼓风干燥箱(上海博迅实业);酶标仪(BioTek公司);高速冷冻离心机(Eppendorf公司);正置光学显微镜(日本尼康);电泳转膜仪(北京六一仪器厂);凝胶成像系统(Bio-Rad公司)。
1.2 试验方法
1.2.1造模 新生7日龄SD大鼠称重编号,诱导麻醉后固定于脑立体定位仪上,切开头皮暴露前囟,以前囟为原点,坐标1.6 mm(前)和1.5 mm(右)处钻一1 mm小洞,用微量进样针插入硬脑膜下2.7 mm(深)处,以1 μL·min-1速度注射胶原酶共0.3 U,留针5 min防止泄露。拔针后用骨蜡封住颅骨小洞,缝合头皮。术后放置于37 ℃环境中恢复苏醒,然后放回母鼠身边。假手术组仅进行脑部进针,不注射胶原酶。
1.2.2实验分组 实验共分为5组:假手术组(Sham组);模型组(GMH组);VU0360172低、中、高剂量组(0.75 mg·kg-1、1.5 mg·kg-1、3.0 mg·kg-1)。每组21只大鼠。
1.2.3给药 造模后3 h,VU0360172按低、中、高剂量给药(i.p.),假手术和模型组给予等容积的溶剂(0.02 DMSO+0.1吐温80+0.2 PEG400+生理盐水)。
1.2.4短期行为学测试 造模后24 h进行,每组6只大鼠,测试完成继续进行后续实验。
1.2.4.1 翻正反射 用手将乳鼠仰面固定于台面上,松手后记录其由仰卧姿势完全翻正为四足站立所需的时间。
1.2.4.2 负趋地性 将乳鼠头朝向下方,置于一呈45°倾斜角的粗糙斜面上,记录乳鼠倒转180°所需的时间。
1.2.4.3 神经功能缺陷评分 采用Longa评分[11],评分标准:0分,正常行走;1分,左侧前肢伸展不完全;2分,行走过程向对侧转圈;3分,行走过程中跌倒;4分,意识丧失,无自主行为。
1.2.5脑含水量测定 造模后24 h断头取脑,称取脑组织湿重,100 ℃烘干24 h称取干重。脑组织含水量/%=(脑组织湿重-脑组织干重)/脑组织湿重×100%。每组6只。
1.2.6血红蛋白测定 造模后24 h将乳鼠麻醉,PBS心脏灌流后断头取脑,称取右侧半球置于EP管中,加入2 mL PBS,冰上超声1 min,4 ℃ 13 000 r·min-1离心20 min,取上清液20 μL,按1 ∶4比例加入都氏试剂,室温下充分静置15 min,酶标仪540 nm处比色。每组6只。
1.2.7HE染色 造模后24 h乳鼠麻醉,断头取脑,迅速放入多聚甲醛固定液进行固定,石蜡包埋切片,进行苏木精-伊红染色,显微镜镜检乳鼠脑组织病理学变化。每组3只。
1.2.8Western blot检测 Bcl-2、cleaved-caspase-3蛋白的表达 造模后24 h心脏灌流取脑。180 mA转膜,快速封闭液室温封闭10 min,加入抗Bcl-2、cleaved-caspase-3抗体,4 ℃孵育过夜。每组6只。
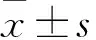
2 结果
2.1 VU0360172对GMH乳鼠神经功能的影响与假手术组相比,模型组在翻正反射和负趋地性实验中所消耗时间增长,神经行为学评分升高(P<0.01)。与模型组相比,VU0360172给药高剂量组明显缩短乳鼠神经行为学测试所需时间,神经功能缺陷评分降低,结果差异具有显著性(P<0.05)(Fig 1)。
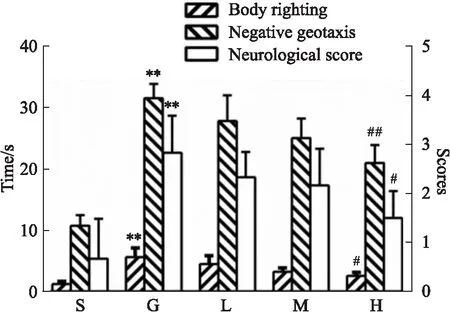
Fig 1 Effect of VU0360172 on neurobehavioral S: Sham; G: GMH; L: VU0360172 0.75 mg·kg-1; M: VU0360172 1.5 mg·kg-1; H: VU0360172 3.0 mg·kg-1. Respective time taking for body righting test and negative geotaxis test and neurological scores estimated 24 h after GMH. **P<0.01 vs Sham; #P<0.05, ##P<0.01 vs GMH.
2.2 VU0360172对GMH乳鼠脑含水量和脑血红蛋白含量的影响与假手术组相比,模型组乳鼠脑含水量和脑血红蛋白含量显著增加(P<0.01)。与模型组相比,VU0360172给药高剂量组乳鼠脑含水量和血红蛋白含量降低,结果差异具有显著性(P<0.05)(Fig 2)。
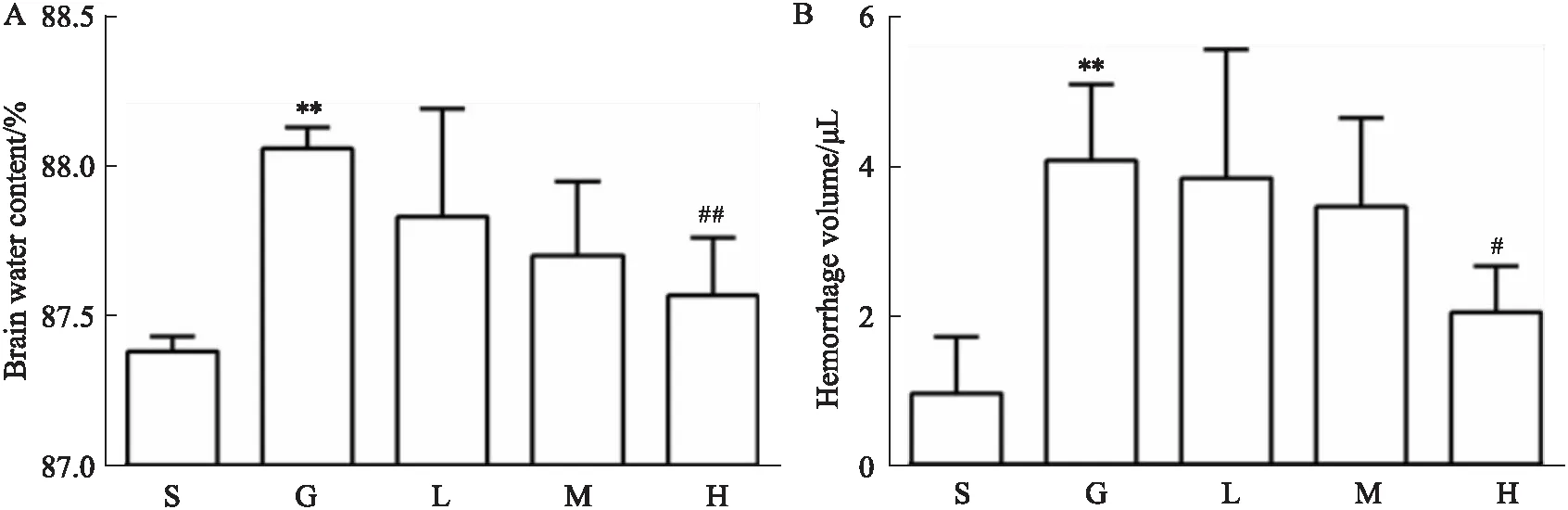
Fig 2 Effect of VU0360172 ameliorating outcomes of GMH in n=6)S: Sham; G: GMH; L: VU0360172 0.75 mg·kg-1; M: VU0360172 1.5 mg·kg-1; H: VU0360172 3.0 mg·kg-1. A: Brain water content. B: Quantification of brain blood volume 24 h after GMH. **P<0.01 vs sham; #P<0.05,##P<0.01 vs GMH.
2.3 VU0360172对GMH乳鼠脑组织病理形态学的影响HE染色结果表明,与假手术组相比,模型组患侧侧脑室显著增宽,基底节区结构破坏,基底节区和脑室下区(subventricular zone, SVZ)可见广泛红细胞和炎性细胞浸润。VU0360172低剂量组与模型组比较无明显差别。中剂量组侧脑室中度扩大,基底节区结构轻度破坏,SVZ区炎性细胞浸润明显。高剂量组侧脑室轻度扩大,基底节区有少量红细胞浸润,SVZ区可见红细胞和炎性细胞浸润,但面积较中剂量组明显减少,病理损伤明显改善(Fig 3)。
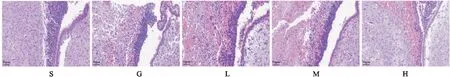
Fig 3 Histochemistry staining of rat brain (×200)S: Sham; G: GMH; L: VU0360172 0.75 mg·kg-1; M: VU0360172 1.5 mg·kg-1; H: VU0360172 3.0 mg·kg-1.
2.4 VU0360172对GMH乳鼠大脑凋亡相关蛋白水平的影响Western blot结果显示,与假手术组相比,模型组脑中Bcl-2蛋白表达减少(P<0.05),cleaved-caspase-3蛋白表达增加(P<0.01)。与模型组相比,VU0360172高剂量组明显上调Bcl-2蛋白(P<0.05),下调cleaved-caspase-3蛋白(P<0.01)(Fig 4)。
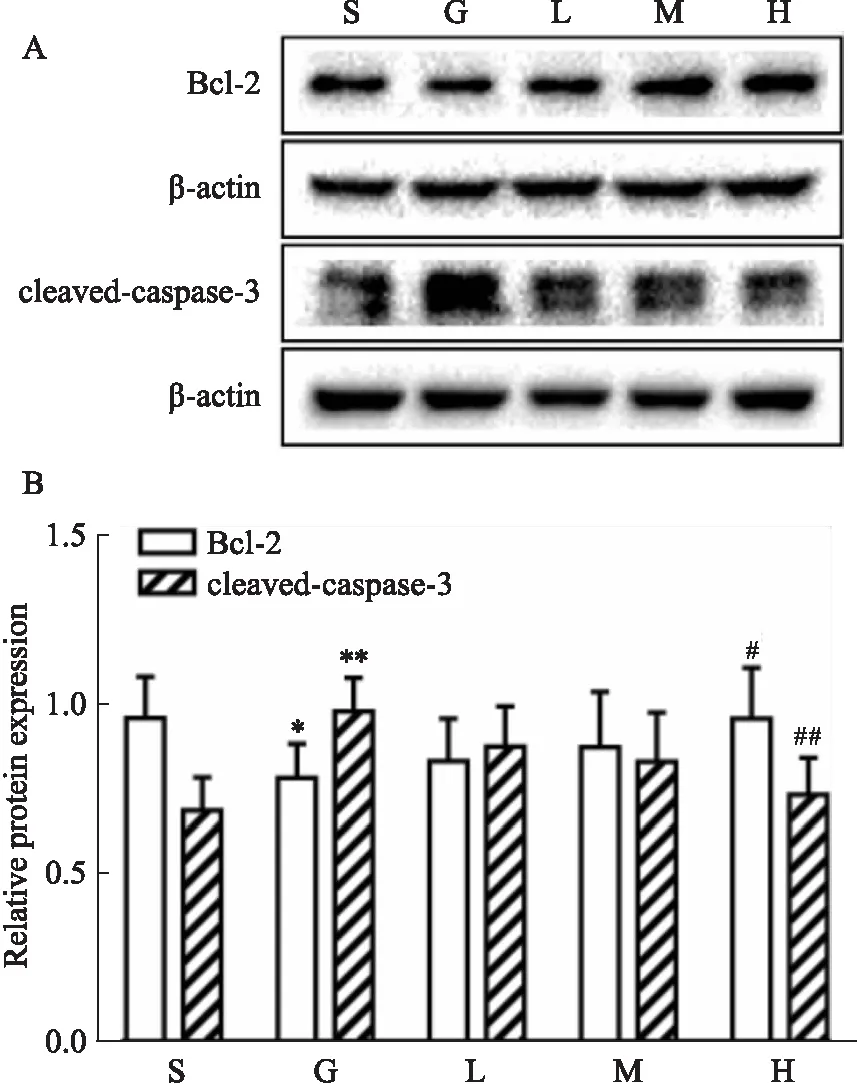
Fig 4 Effect of VU0360172 on apoptosis-related proteinS: Sham; G: GMH; L: VU0360172 0.75 mg·kg-1; M: VU0360172 1.5 mg·kg-1; H: VU0360172 3.0 mg·kg-1. A, B: Relative protein expression level of Bcl-2 and cleaved-caspase-3 24h after GMH. *P<0.05, **P<0.01 vs sham; #P<0.05, ##P<0.01 vs GMH.
3 讨论
新生儿生发基质出血发生后,脑血管破裂出现大量血液,积血不仅会形成血块阻塞脑脊液循环,加重脑积水[1],血液成分的释放还会引起神经元死亡[12]、小胶质细胞激活[13]、水通道蛋白表达改变[14]等病理反应,加剧脑损伤。
mGluR5是一种GPCR,在神经元细胞膜上表达,激动后具有抑制神经元凋亡,增强神经发生,调节小胶质细胞的功能,可产生抗炎、抗焦虑、抗精神病、抗癫痫的作用。有研究显示,mGluR5激动剂CHPG可增强脑室下区域神经祖细胞的增殖,增强神经发生,对成人脑出血产生保护作用[7]。在脑缺血模型上,特异性激动mGluR5可通过PI3K-AKT通路产生保护作用[8]。故mGluR5是一个可通过不同途径产生神经保护作用的受体。本研究结果发现,应用VU0360172后,可明显改善GMH所致的乳鼠脑含水量和脑血红蛋白含量的升高,并减少GMH造模后乳鼠神经行为学测试所消耗时间,降低神经功能缺陷评分。表明激活mGluR5后对GMH产生了治疗效果。
Georgiadis等[15]的研究显示,GMH的发病伴随着细胞凋亡,故抑制细胞凋亡可能是药物对GMH产生保护作用的一种途径。Zhang等[6]也发现,在蛛网膜下腔出血模型中,激动mGluR5可以改善早期损伤,并有抑制神经元凋亡的作用。故本研究提出假设,在GMH模型中激动mGluR5是否会产生凋亡抑制的效应?凋亡是一种细胞程序性死亡,只有当细胞凋亡程序启动时,半胱氨酸-天冬氨酸蛋白酶3(caspase-3)才会被激活,活化产生裂解的cleaved-caspase-3,裂解胞质和胞核底物,引起细胞凋亡,所以cleaved-caspase-3是细胞凋亡发生的重要指征和关键因子。而Bcl-2是重要的凋亡调控蛋白,Bcl-2的上调可抑制细胞凋亡。在本研究的WB结果中证实,GMH模型组的抗凋亡蛋白Bcl-2减少,裂解蛋白酶cleaved-caspase-3大量产生,说明细胞凋亡情况严重。给予VU0360172后,抗凋亡蛋白Bcl-2发生上调,而cleaved-caspase-3下调,细胞凋亡情况有所改善。综上,激动mGluR5后对GMH乳鼠产生了治疗效应,这种保护作用可能是通过抑制细胞凋亡所产生。
本研究主要聚焦于VU0360172激活mGluR5对GMH的保护作用,虽有其他研究也显示mGluR5激动剂对蛛网膜下腔出血、创伤性脑损伤等中枢疾病有保护作用,但也有研究表明抑制mGluR5可治疗帕金森[16]和阿尔茨海默症[17]。同一受体对不同神经疾病的治疗机制出现差异的原因,有可能是因为疾病本身的发病机制不同,急性创伤和慢性炎症性疾病存在差异,且因受mGluR5影响的下游通路众多,例如Akt-NF-κB通路[3]、PI3K-AKT通路等,受体可产生多种效应。本研究对mGluR5治疗GMH的机制探讨也仅是浅尝辄止,对其抑制细胞凋亡的具体机制尚不清楚,将在后续实验中对此进行更加深入的研究。

