匙指虾科线粒体基因组结构与系统进化分析
朱陇强,朱志煌,朱雷宇,王定全,王健鑫*,林琪*
(1.福建省水产研究所 福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013;2.浙江海洋大学 海洋微生物分子生态与应用实验室,浙江 舟山 316022)
匙指虾科Atyidae属于甲壳动物亚门Crustacea软甲纲Malacostraca十足目Decapoda真虾下目Caridea,该科物种广泛分布于热带和温带的淡水和海水环境中[1]。全球匙指虾科物种约400种,分布于约40个属中[2],最典型特征是螯上具有毛发状的刚毛,体型通常较小(全长<35 mm)[3]。匙指虾科物种在沉积物分解、颗粒有机物处理及生境底栖生物群落组成过程中发挥着重要的生态作用[4]。近年来,基于部分线粒体基因序列系统发育分析指出,匙指虾科物种分类关系受地壳运动影响,古老的冈瓦大陆断裂与特提斯海封闭可能是引起该类群物种进一步分化的主要原因。因此,尽可能全面地收集匙指虾科物种线粒体基因组数据,对开展分子系统学的相关研究非常有必要。
线粒体普遍存在于真核细胞中,负责大多数细胞ATP的产生,呈闭合环状结构,通常由参与电子传递的37个编码基因(13个PCGs、22个tRNA和2个rRNAs)组成[1]。线粒体基因通常被用作遗传标记,以确定生物进化和系统发育关系[5-6]。本研究中,基于GenBank中已公布的24种匙指虾科物种线粒体基因组的全序列,并结合地理学知识对其进行分子系统学相关分析,以期为深入研究匙指虾科物种系统进化关系提供科学参考。
1 材料与方法
1.1 数据的获取
从GenBank线粒体基因组数据库(http://www.ncbi.nlm.nih.gov)中检索到本研究中24种匙指虾科物种线粒体全基因组序列,并检索各物种样本的来源(图1)。未检索到中文名称的物种直接用拉丁名表示,物种相关信息见表1。

图1 GenBank中已公布的匙指虾科线粒体基因组样本类群的分布Fig.1 Distribution of the mitogenome sample taxa of Atyidae published in GenBank
1.2 方法
1.2.1 基因变异位点分析 使用ClustalW 2软件对24种匙指虾科物种线粒体基因组的13个PCGs序列和2个rRNA序列进行多重序列比对,然后选择DnaSP 6[7]软件中的多态位点分析剔除缺失位点,并整理各基因的变异位点值。
1.2.2 系统发育分析 使用ClustalW 2软件对24种匙指虾科物种线粒体基因组中13个PCGs序列进行串联比对,外类群为中华小长臂虾Palaemonsinensis线粒体基因组中13个PCGs序列。将比对后的序列通过Gblocks软件[8]提取保守序列。基于jModelTest软件[9]对保守序列的替代模型进行分析,根据赤池信息准则(akaike criteria,AIC),GTR+I+G (-lnL=150 789.030 2)为最佳替代模型用于后续计算分析。采用最大似然法(Maximum likelihood,ML)、邻接法(Neighbor joining,NJ)和贝叶斯法(Bayesian inference,BI)分别构建系统进化树。其中,采用PhyML 3.1软件构建ML树,通过自展法(Bootstrap=1 000)评估节点可靠性;采用MEGA 5.0软件构建NJ树,自展值设置为1 000;采用MrBayes 3.2.6软件[10]构建BI树,运行世代数为1×107,运行一次由4条链组成,包括3条热链(heated chain)和1条冷链(cold chain),每运行500个世代取样一次,每500个运行世代显示一次进展信息,收敛诊断设置为5 000。
1.2.3 物种分化时间估算 采用BEAST 2.6.3软件[11]估算匙指虾科各物种的分化时间。基于赤池信息准则,GTR+I+G为最佳分析模型。设置树先验(tree prior)选择适用于分析来自不同物种序列的Yule模型。依据宽松对数正态分子钟(uncorrelated relaxed lognormal clock)配合默认参数配置的xml文件,将运行世代数设置为10 000,运行结束后所获log文件中的ucld.stdev值为0.425,该值未接近0,故分子钟选择宽松分子钟模型。依据生命进化时间信息公共知识库(http://www.timetree.org/)记录的匙指虾科起源时间和Jurado-Rivera等[12]对匙指虾类群中部分适应洞穴生活的虾种分歧时间作为校准节点,计算匙指虾科的物种分歧时间。进行马尔可夫分析的运行链长为5×107,每运行1 000次抽样一次,最后弃掉25%的老化链。采用FigTree 1.4.4软件对估算结果进行注释。
2 结果与分析
2.1 匙指虾科线粒体基因组的特征分析
从表1可见,匙指虾科24个物种线粒体基因组的长度为15 318~16 430 bp,AT含量为62.20%~70.19%,高AT含量在十足动物中普遍存在。另外,24个匙指虾科物种线粒体基因的排列顺序完全相同,说明匙指虾科物种在进化中较保守。

表1 GenBank中已公布的匙指虾科物种线粒体基因组序列信息Tab.1 Mitogenome sequence information of species in Atyidae published in GenBank
2.2 匙指虾科线粒体基因组的差异位点分析
从表2可见:匙指虾科线粒体基因组的15个基因(13个PCGs和2个rRNAs)中,nd6、atp8、nd2、nd4L、nd5、nd4和nd3 7个基因变异位点比例超过60%,cox1和cox3基因变异位点比例较低,分别为46.22%和48.85%;nd5基因变异位点数最多(1 098个),其次为nd4和cox1基因,cox1基因变异位点比例较低,不适用于群体遗传分析,而nd5和nd4基因变异位点比例较高,基因长度较长,且变异位点数也多,故可作为匙指虾科理想的分子标记,用于分析不同群体间的生物多样性。
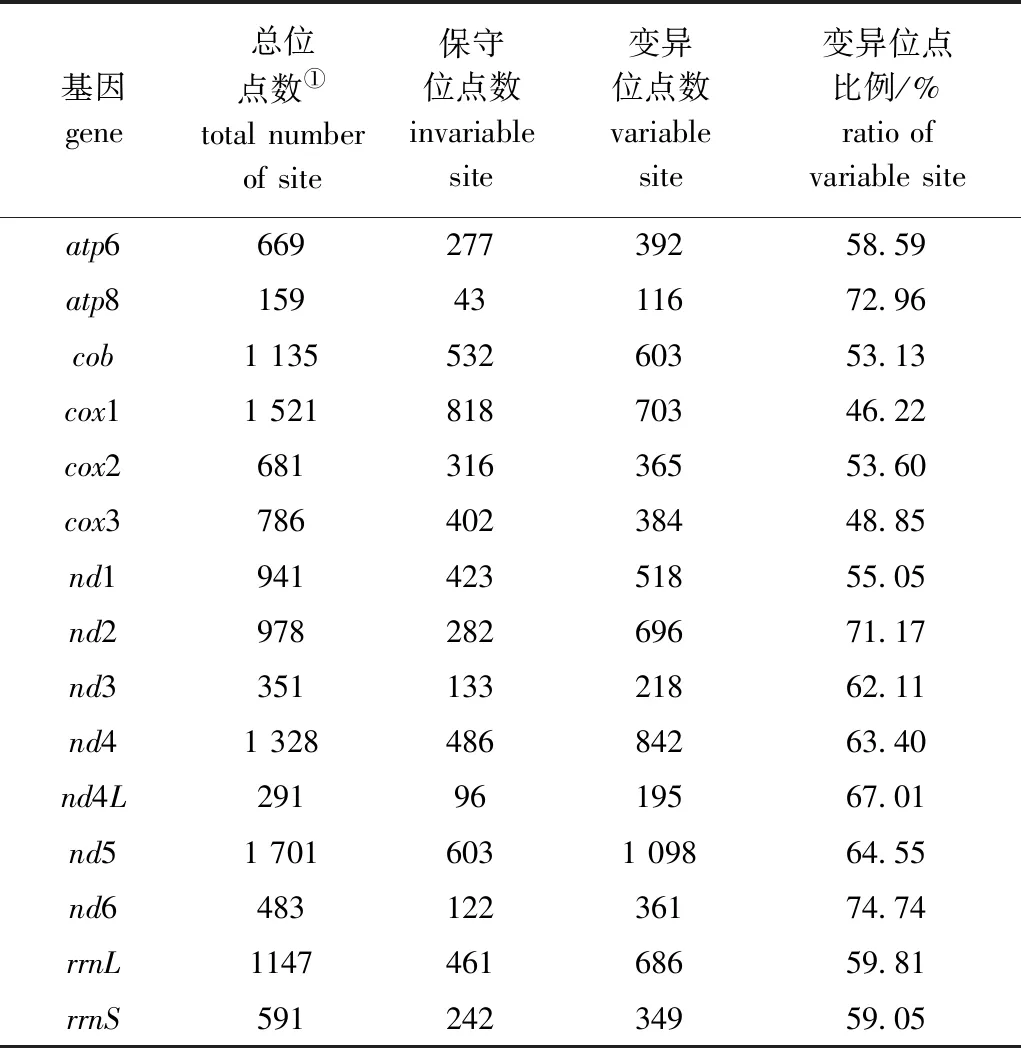
表2 匙指虾科线粒体基因组的基因变异位点Tab.2 Gene variation sites in the mitogenome of Atyidae
2.3 匙指虾科线粒体基因组的系统发育分析
基于24种匙指虾科物种线粒体基因组的13个PCGs序列,利用ML、NJ和BI方法构建系统发育树的拓扑结构基本一致,仅在个别物种间的分支关系存在差异。从图2可见:Atyinae亚科聚为一大支,其内部分支包括米虾属Caridina和新米虾属Neocaridina,新米虾属Neocaridina在米虾属Caridina内聚为一支;Typhlatyinae、Caridellinae和Paratyinae亚科(TCP)聚为一大支,其中,Paratyinae单独为一支,Caridellinae的两个物种不在同一分支上;而Typhlatyinae聚为一支(除Typhlatyagalapagensis外),其内部分支包括Typhlatya、Stygiocaris和Typhlopatsa3个属,其中Stygiocaris和Typhlopatsa聚为一支,互为姊妹关系。基于ML方法构建的系统发育树结果显示,Halocaridinidesrubra与Typhlatyagalapagensis聚为一支,自展值较低(43),Halocaridinidesfowleri独自为一支,三者的关系为(…+(Halocaridinidesfowleri+(Halocaridinarubra+Typhlatyagalapagensis)+…));基于NJ和BI方法构建的系统发育树一致,结果显示,这3个物种各自为一支且得到较高的自展值(>86)和后验概率(>0.88),它们之间的关系为(…+(Halocaridinidesfowleri+(Typhlatyagalapagensis+(Halocaridinarubra+…))))。

利用ML构建系统发育树分支上的数值为自展值;利用NJ和BI构建系统发育树分支上的数值为自展值和后验概率。Value on the branch of the phylogenetic tree constructed by ML is the bootstrap probability;the value on the branch of the phylogenetic tree constructed by NJ and BI is the bootstrap probability and posterior probability.图2 采用ML、NJ和BI方法构建的系统发育树Fig.2 Phylogenetic tree constructed using ML,NJ and BI methods
2.4 匙指虾科线粒体基因组的分歧时间分析
基于最适合的拓扑结构和分子进化速率,用宽松分子钟模型估算TCP物种最近的共同祖先在266.76~329.99 Mya(图3,节点B),其中,Caridellinae亚科物种最先出现分化是在205.63~285.12 Mya(图3,节点C);Typhlatyinae亚科物种最先出现分化是在174.94~242.37 Mya(图3,节点E),Typhlopatsa和Stygiocaris亚科物种最近的共同祖先在76.07~108.53 Mya(图3,节点O);Atyinae亚科物种最近的祖先在178.45~280.34 Mya(图3,节点D),其中新米虾属Neocaridina物种最近的共同祖先在14.70~41.69 Mya(图3,节点W)。
3 讨论
3.1 匙指虾科物种系统发育关系
匙指虾科所含物种相对较少,但其内部分类关系一直存在争议。本研究中,利用公共数据库现有的线粒体基因组序列对24种匙指虾科物种进行系统发育分析,研究结果与前人的结果对比发现,部分物种在分类地位上存在差异。本研究中,Typhlatyagarciai、Typhlatyapearsei、Typhlatyamitchelli、Typhlatyadzilamensis、Typhlatyaconsobrina和Typhlatyataina聚为一支,其内部Typhlatyaconsobrina和Typhlatyataina互为姊妹关系且聚为一小支,其余4个物种聚为另一支,且各节点的ML值和BI值均较高,这与Jurado-Rivera等[12]基于13个PCGs序列的研究结果一致。然而Park等[13]基于13个PCGs序列的研究结果显示,Typhlatyagarciai和Typhlatyapearsei与该分支其他物种的亲缘关系均发生了变化(图4A),值得注意的是,该研究部分的分支节点支持度较低;Botello等[19]基于rrnL、COI、cytb、LSU、SSU和组蛋白H3A序列的研究结果显示,Typhlatyagarciai独自形成一支且与其余5个种的亲缘关系较远(图4B),各节点支持度较高,然而部分基因序列往往因可提取的信息有限而不能解决一些较烦琐的系统发育问题,但该分支各物种亲缘关系的远近或许能支持本研究系统发育分析的准确性。另外,本研究中还发现,基于不同的进化分析方法,Halocaridinarubra和Typhlatyagalapagensis的亲缘关系存在差异,前人的研究结果显示,Halocaridinarubra和Typhlatyagalapagensis为姊妹关系且独自形成一个分支[12,19],这个结果与本研究中基于ML分析方法的研究结果一致,但本研究中节点支持度相对较低,说明二者的关系有待进一步研究确定。

图4 前人有关部分匙指虾科物种的种类系统发育关系假设[12,19]Fig.4 Previous hypotheses about the phylogenetic relationship of some species in Atyidae[12,19]

数字代表节点95% CI,板块运动示意图参考Jurado-Rivera等[12]的研究。Numbers represent 95% credible intervals (CI),and the sketch map of plate movement is referred to the study of Jurado-Rivera et al[12].图3 匙指虾科物种分歧时间估算Fig.3 Estimation of the divergence time of the species in Atyidae
3.2 匙指虾科物种分歧演化
基于系统进化树的拓扑结构可知,匙指虾科物种被分为两大支系,TCP为一个支系,Atyinae类群为另一支系。在TCP支系中,来自澳大利亚的物种Paratyaaustraliensis在石炭纪中期到二叠纪晚期时段就以分化形成(图3,节点B),比冈瓦大陆断裂的时间至少早100 Mya,说明该物种的形成与冈瓦大陆的断裂毫无联系,由此推测,该物种可能起源于南太平洋或随着洋流扩散到澳大利亚[20]。古老的冈瓦大陆断裂与特提斯海封闭导致一些同类群生物隔离和高度分散分布。来自Typhlatyinae亚科的洞穴虾分布于东太平洋、加勒比海、大西洋、地中海、马达加斯加和澳大利亚附近岛屿(图1),这类物种从未在开阔的海洋栖息地被报道,大多数物种栖息在岛屿或狭窄的海岸[12]。这种栖息环境导致这些物种具有较强的地域性,地理板块运动可能是导致这些物种分散的最好媒介。在Typhlatyinae亚科中,Typhlatyagalapagensis栖息于加拉帕戈斯群岛且在侏罗纪早期就以分化形成(图3,节点E),加拉帕戈斯群岛独特的地理位置及Typhlatyagalapagensis适应洞穴栖息的特点,可能会导致该物种的入侵能力极为有限。由此推测,加拉帕戈斯群岛可能在侏罗纪时期就已存在,但这种推测仍需进一步验证。基于Leprieur等[21]的研究可知,从白垩纪时代开始,冈瓦大陆开始出现断裂,特提斯海域面积缩小,而冈瓦大陆的断裂可能是导致Typhlatyinae中栖息于冈瓦大陆沿岸的洞穴虾出现分化的主要原因(图3,节点H)。来自冈瓦大陆沿岸的洞穴虾物种被分为两个支系,其中,第一支系所含物种主要位于大西洋西部及位于非洲东部一个未描述的种(图3,节点I),该类群中的Typhlatyailiffei、Typhlatyasp.JR2016聚为一支(图3,节点L),分化时间发生在87.47~125.08 Mya,这与Jurado-Rivera等[12]估算的分歧时间91~121 Mya基本相吻合;该类群的其余物种地理分布相对较集中且聚为一支(图1,图3,节点M)。另一支系所含物种主要位于地中海西部、澳大利亚西部、马达加斯加和加勒比海(图1),该类群中位于加勒比海的Typhlatyamonae和位于地中海的Typhlatyaarfeae、Typhlatyamiravetensis聚为一支(图3,节点K),分歧时间发生在91.12~124.14 Mya,这与南美洲和非洲被大西洋分隔的时间基本相吻合[21];该类群中位于马达加斯加的Typhlopatsapauliani与位于澳大利亚西部的Stygiocaris物种聚为一支,分歧时间发生在76.06~108.53 Mya,但印度板块与南极洲分裂的时间约为120 Mya[21],所以冈瓦大陆的断裂时间不能解释该分支的分歧时间,但有研究推测,Stygiocaris物种的祖先生活在古特提斯海沿海栖息地,随后被板块的运动分隔开[22]。所以,任何一个物种的进化不可能符合一种单一的构想,它需要更加复杂的混合模型来反映。
来自Atyinae亚科的物种主要分布在太平洋南部和西北部(图1)。该分支中所含物种均为淡水虾,其中,米虾属Caridina幼虫的发育需要高盐度水体,其幼虫孵化后进入浮游期,被动漂流在海洋中,蜕变后又迁徙到淡水栖息地[23]。本研究中现有的4种米虾属Caridina物种中,Caridinamultidentata在二叠纪早期到侏罗纪早期时段分化形成(图3,节点D),为独立一个分支,该物种以其独有的形态适应在湍急的水流中攀附栖息[23],说明该物种随洋流扩散的能力较强,其余C.indistincta、C.gracilipes和C.cf.niloticaHMG-216 3种米虾在三叠纪早期到白垩纪早期时段分化形成,同期分化形成的还有新米虾属Neocaridina(图3,节点G),Caridina3种米虾均适应于水流流速较低的植被下栖息[23-24],说明它们随洋流扩散的能力较弱。
4 结论
1)匙指虾科物种线粒体基因的排列顺序相同,nd5和nd4基因可作为匙指虾科理想的分子标记,用于分析不同群体间的生物多样性。
2)基于NJ和BI方法构建的24种匙指虾科物种的系统发育关系完全一致,基于ML方法构建的系统发育树中个别物种间的分支关系存在差异,其中,Atyinae亚科为单系群,Typhlatyinae和Caridellinae亚科均为非单系群。
3)根据分子钟估算结果推测,Atyinae物种最近的共同祖先可能出现在178.45~280.34 Mya,即二叠纪早期到侏罗纪时段,Paratyinae、Typhlatyinae和Caridellinae亚科物种最近的共同祖先可能出现在266.76~329.99 Mya,即石炭纪中期到二叠纪时段。

