昆虫激脂激素的功能及作用机制研究进展
郑洪远,范书凡
(河南大学生命科学学院/棉花生物学国家重点实验室,开封 475004)
昆虫激脂激素 (adipokinetic hormone,AKH) 是由位于脑后方的心侧体合成的神经多肽,成熟肽包含8~11个氨基酸。AKH最早发现于美洲大蠊Periplanetaamericana和飞蝗Locustamigratoria中[1,2],属于AKH/RPCH(red-pigment concentrating hormone)多肽家族,迄今为止昆虫中已经鉴定到80多种。在昆虫高耗能生命活动中,心侧体分泌AKH调动脂肪体内的营养储备,为需能组织提供能量物质,维持生理过程的正常运行[3-5]。AKH的信号由其膜受体AKHR(AKH receptor)介导进入胞内。AKHR属于G蛋白偶联受体家族,首先在果蝇Drosophilamelanogaster和家蚕Bombyxmori体内鉴定得到,目前已在多种昆虫中报道[6-10]。早期研究中,AKH/AKHR信号系统在昆虫运动,尤其是飞行中的功能和信号转导机制受到了广泛关注,但越来越多的研究表明,AKH作为调动营养储备的关键激素,在许多高耗能的生命活动中都发挥重要作用。近年来,AKH/AKHR信号通路在昆虫卵黄发生、抗杀虫剂、耐饥饿、免疫等生理进程中的调控机制取得了一定进展。本文对AKH/AKHR通路在运动活动、生殖生理进程以及胁迫响应中的功能和作用机制进行了总结和论述(图1),以期为研究AKH/AKHR信号通路在昆虫内稳态调控中的内在机理提供帮助。
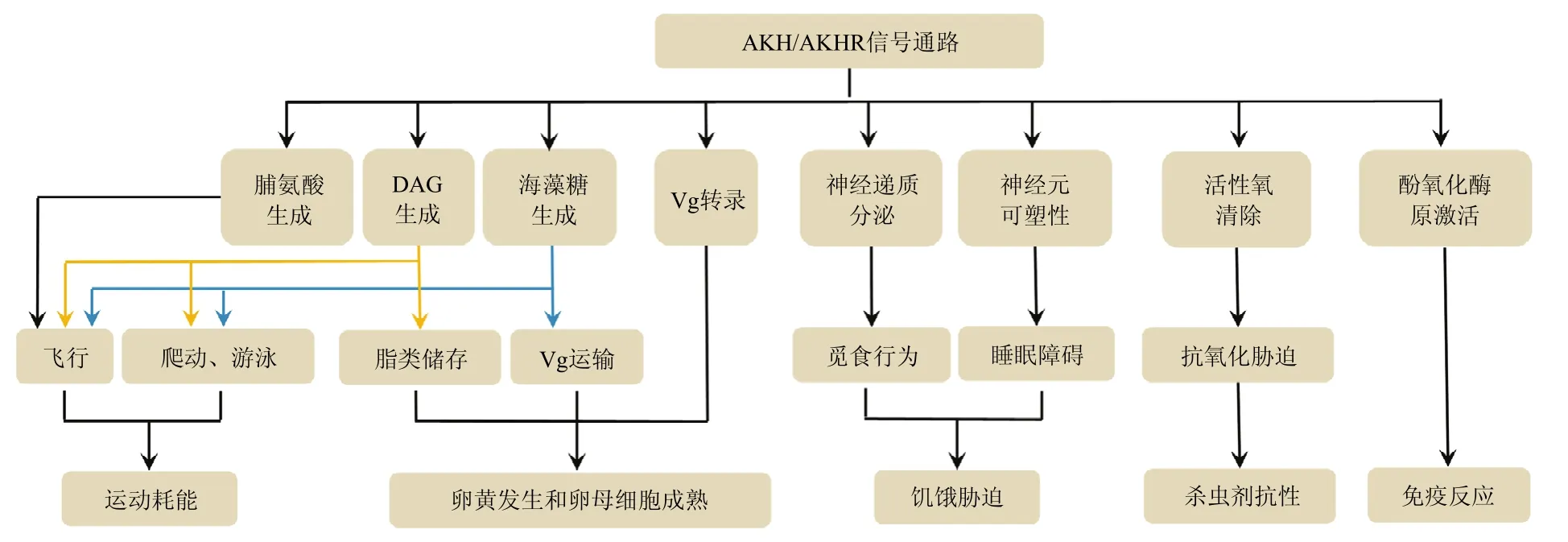
图1 昆虫AKH/AKHR信号通路的功能和作用机制Fig.1 Functions and mode action of AKH/AKHR signaling pathway in insects
1 AKH信号传导通路
AKH作用于脂肪体细胞调动的营养储存物质有两种:①糖元(glycogen)水解产生海藻糖(trehalose)和②甘油三脂(triacylglycerol,TAG)分解转化为甘油二脂(diacylglycerol,DAG)或脯氨酸(proline)[11-13]。AKH与 AKHR结合后经 cAMP-PKA通路或 PLC-IP3/Ca2+-PKC通路活化糖元磷酸化酶(glycogen phosphorylase,GP),将糖元水解产生葡萄糖-1-磷酸,并最终转化为海藻糖(图 2)[14-16]。AKH/AKHR系统动用脂类的信号通过cAMP-PKA通路激活TAG脂酶,该酶在Ca2+介导下定位到脂滴,将TAG分解生成DAG(图2)。以脯氨酸为主要供能物质的甲虫中,AKH还促进TAG分解产生的游离脂肪酸(free fatty acid,FFA)合成脯氨酸(图2)[15,17]。分解产物海藻糖和脯氨酸随后被释放到血淋巴,而DAG由载脂蛋白(apolipoprotein)携带进入血淋巴,之后运输到靶标组织进行氧化供能或再次储存。

图2 AKH诱导TAG和糖元分解的信号通路(虚线表示间接级联关系)Fig.2 AKH signal transduction in stimulating catabolism of TAG and glycogen (Dotted lines mean indirect cascade)
2 AKH在昆虫运动中的功能机制
2.1 AKH在飞行中的调节机理
昆虫飞行过程中的耗氧量是静息状态的100多倍,需要大量调动脂肪体的营养储备为飞行肌提供能量物质[4]。蝗虫作为典型的长距离迁飞昆虫,是飞行活动中 AKH内分泌调控的重要研究对象。飞蝗中共鉴定到三条AKH多肽:AKH I、AKH II和AKH III,其中AKH I和AKH II在飞行中发挥关键作用[17,18]。在飞行起始阶段,飞行肌主要利用自身和血淋巴中的海藻糖等碳水化合物作为氧化供能燃料。受飞行活动的诱导,AKH在飞行起始后10 min内即大量释放到血淋巴,脂肪体中糖元由AKH II主导水解产生海藻糖补充到血淋巴中[19,20]。飞行起始后20 min,脂肪体细胞受AKH I诱激分解TAG生成大量DAG,后者结合于载脂蛋白进入到血淋巴,主要供能物质由碳水化合物转变为高热量的脂类,以维持长距离飞行[11,21]。飞蝗飞行30 min,AKH I作用下血淋巴中的脂类物质含量升高6.5倍[22]。同时,AKH I还促进DAG与高密度载脂蛋白(high density lipoprotein,HDL)结合形成低密度脂蛋白(low density lipoprotein,LDL),进一步提高了脂类动用的速率[23,24]。沙漠蝗Schistocercagregaria中目前鉴定到AKH I和AKH II,两者成熟肽与飞蝗高度同源,其中AKH I与飞蝗AKH I氨基酸序列相同,AKH II仅第6位氨基酸不同(沙漠蝗中为苏氨酸,飞蝗中为丙氨酸)[25,26]。两个物种中飞行活动诱导的AKH分泌速率相似,不同的是飞蝗中AKH II诱导生成的cAMP是AKH I的2倍,所以两种多肽主导的分解反应各有侧重,而沙漠蝗中两者作用下细胞中cAMP响应水平相当[27-29]。半翅目具有飞行习性的昆虫,如大锥蝽Panstrongylusmegistus、印田鳖蝽Lethocerusindicus、缘蝽科Holopternaalata等以及鳞翅目烟草天蛾Manducasexta飞行过程中营养物质利用方式与蝗虫类似,即初始阶段主要以糖类供能,而以TAG维持长时间飞行[12,30-33]。然而,这些昆虫中现已鉴定的AKH只促进血淋巴中DAG含量升高而对糖类物质没有明显影响[4]。
许多鞘翅目甲虫以及双翅目刺舌蝇Glossinamorsitans以脯氨酸和碳水化合物为主要供能物质[4,34]。以非洲果甲虫Pachnodasinuata为例,飞行起始的前30 s以脯氨酸为底物氧化产能,此后飞行肌和血淋巴中脯氨酸迅速下降,供能物质转换为碳水化合物[35]。非洲果甲虫中目前鉴定到一种AKH多肽,体外注射AKH能够提高血淋巴中海藻糖和脯氨酸的含量[36-38]。AKH诱导脯氨酸合成的反应中首先促进 TAG分解产生FFA,此过程如上述由 cAMP-PKA通路传导信号(图 2)[39]。产物 FFA在 3-羟酰基-辅酶 A脱氢酶(3-hydroxyacyl-CoA dehydrogenase)作用下氧化生成乙酰辅酶 A(acetyl-CoA),后者在丙氨酸转氨酶(alanine aminotransferase)催化下与丙氨酸(alanine)结合生成脯氨酸,但是此过程中哪些酶受AKH调控还是未知[39,40]。
2.2 AKH在爬动和游泳中的作用
与飞行相比,昆虫的其他运动活动,如游泳或爬动对能量的需求要低得多,但许多研究表明这些活动中也需要分泌AKH以调动能量物质。始红蝽Pyrrhocorisapterus活动能力更强的长翅型个体较短翅型响应AKH的敏感度更高,并且前者血淋巴中AKH滴度和脂类含量与活跃度呈正相关[41-43]。体外注射或局部点滴AKH的始红蝽和双斑蟋Gryllusbimaculatus爬行活动量会增加一倍[44,45],而AKH缺失型果蝇血淋巴中海藻糖水平显著降低,并且活动力明显下降[46]。美洲大蠊的研究显示,AKH不仅能诱导能量物质的调动,可能还作用于章鱼胺分泌神经元,促进这一兴奋性神经递质的释放[47,48]。双重效用下,AKH注射处理的美洲大蠊运动活性可提高60倍[47]。
此外,虽然尚无直接证据,AKH可能还参与游泳活动中营养物质动用。半翅目灰蝎蝽Nepacinerea、味潜蝽Ilyocoriscimicoides以及仰泳蝽属Notonectaglauca等昆虫注射AKH能够显著促进脂肪体中脂类储备的动用,增加血淋巴中脂质含量。另一方面,游泳运动刺激血淋巴中脂质含量升高,说明昆虫游泳过程中需要消耗脂类储备,而且很可能也需要AKH动用营养物质以维持肌肉活动[31,49,50]。
3 AKH在生殖发育中的功能及作用机制
昆虫一枚成熟的卵中脂类含量约占干重的30%~40%,在这其中90%脂类是由脂蛋白携带脂肪体中的DAG运输到卵巢中,剩余 10%则由卵黄原蛋白(vitellogenin,Vg)和载脂蛋白运输到卵巢中[11,51]。AKH在促进脂肪体中TAG、糖元等营养储备物质分解的同时还抑制RNA、蛋白和脂类的合成[52-56]。卵黄发生是卵发育成熟的基本保障。在此过程中,脂肪体大量转录和翻译合成 Vg,并由血淋巴运输,被发育中的卵吸收储存。因此,有人认为AKH对昆虫卵黄发生、卵成熟等生殖发育进程具有抑制作用。较早的研究显示,飞蝗中AKH I体外处理和双斑蟋中AKH(与飞蝗AKH II同源)白天和夜间各一次的注射可以抑制脂肪体中Vg的合成,阻碍卵母细胞成熟、减少初级卵母细胞数量,并导致卵巢变小[57,58]。然而,近年来越来越多的研究发现,AKH/AKHR信号系统对雌性生殖力具有正向刺激作用。德国小蠊Blattellagermanica的高海藻糖激素(属AKH多肽家族)基因沉默(RNAi)后,血淋巴中海藻糖稳态受到影响、产卵期显著延长,而胎生物种刺舌蝇中干扰AKHR表达会抑制妊娠期间脂类储备的利用,导致幼虫发育延迟,生殖力下降20%[59,60]。在褐飞虱Nilaparvatalugens和飞蝗中,AKHR RNAi阻碍TAG动用并降低血淋巴中海藻糖含量,从而导致Vg摄取受阻、卵母细胞成熟延迟以及产卵量减少,并且AKHR沉默还降低了TAG分解和海藻糖稳态相关基因的mRNA水平[61,62],说明AKH/AKHR信号系统还可以在转录水平调控基因表达而作用于能量物质调动。
昼夜节律与激素信号系统相互作用调控昆虫的生殖生理和行为等生命活动[63,64]。在家蟋蟀Acheta domesticus和始红蝽中已报道AKH的滴度具有昼夜节律变化[65,66],而且脂肪体中脂类动用对AKH处理的敏感度也具有昼夜节律,并与AKH滴度呈正相关[41,65]。最新的研究发现,飞蝗AKH III mRNA水平具有明显的白天高、夜间低的昼夜节律,而AKH I和AKH II 的转录在24 h周期中没有明显变化。体外注射试验显示白天AKH III处理显著促进卵黄发生和卵母细胞成熟进程,而夜间处理则具有抑制作用,并且AKH I和AKH II白天和夜间处理均会阻碍Vg合成和卵发育[62]。上述研究说明,生殖发育过程中AKH在昼夜节律的协同下诱导能量物质分解代谢,促进脂肪体中的营养转存到发育中的卵中。另外,飞蝗中AKH III主要在卵黄发生和卵成熟过程中调控营养动用,而AKH I和AKH II则在飞行活动中发挥作用。
4 AKH在昆虫抗胁迫中的作用及调控机制
昆虫极强的逆境耐受力是其能够在几乎所有的生态位中生存的关键因素之一。脂肪体的能量储备是昆虫抵御逆境胁迫、度过不良时期的重要保障。近年来的研究发现,在耐饥饿、抗杀虫剂和氧化胁迫、抵御病原体等生理活动中AKH也具有能量调动和稳态维持的作用。
4.1 AKH在氧化和杀虫剂抗性中的功能机制
有氧生物呼吸作用所需的氧气约有 1%~3%会转变为 O2-、H2O2和 OH等具有强氧化能力的活性氧(reactive oxygen species,ROS)[67]。正常状态下,低浓度的ROS具有增强免疫力的作用,但浓度过高会损伤 DNA、蛋白质,并使质膜上的多不饱和脂肪酸发生过氧化反应,从而影响细胞机能甚至导致死亡。机体具有复杂精密的清除机制以维持 ROS的平衡状态[68]。研究表明,H2O2处理的始红蝽心侧体中 AKH的合成和血淋巴中的滴度都会增强[69]。AKH注射能够显著减弱H2O2引起的脂过氧化反应、质膜流动性降低和蛋白羰基化等氧化胁迫作用以及最终导致的高死亡率,并且削弱H2O2对过氧化氢酶(catalase,CAT)活性的抑制作用[69-71]。灰翅夜蛾Spodopteralittoralis幼虫进食鞣酸(tannic acid,TA)后,蛋白羰基化、谷胱甘肽(glutathione)水平、CAT、超氧化物歧化酶(superoxide dismutase)和谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)等标示性参数显示中肠内氧化胁迫增强,而AKH注射抑制TA的作用,削弱肠道的氧化压力[72]。药理学试验证明,胞内外Ca2+、cAMP和PKC介导了AKH诱导增强细胞抗氧化活性的信号传递[70]。AKH干扰的果蝇中,无论有无H2O2处理,FoxO(Forkhead box class O)的表达都显著低于野生和AKH过表达品系,并且受FoxO调控的关键抗氧化蛋白sestrin的表达也相应下降,说明AKH可能通过FoxO诱导sestrin蛋白合成从而提高机体氧化防御能力[71]。
许多杀虫剂、除草剂和生物毒素会扰乱虫体氧自由基清除系统,导致体内ROS累积[73,74]。研究证实,多种杀虫剂、除草剂百草枯处理以及进食表达雪花莲凝集素(Galanthusnivalisagglutinin)或苏云金芽孢杆菌毒素Cry 3Aa的马铃薯后,始红蝽、德国小蠊等昆虫虫体内AKH的合成和释放都会倍增,而外源AKH注射能够降低杀虫剂或百草枯引起的氧化胁迫[75-81]。褐飞虱毒死蜱抗性品系中AKH和AKHR的表达量显著高于敏感品系。深入的研究发现 AKH/AKHR通路能够增强羧酸脂酶(carboxylesterase)的转录和蛋白活性,从而提高机体的杀虫剂解毒能力[82]。然而,AKH与杀虫剂共同注射往往引起比后者单独处理更高的死亡率[76,79,81]。最新的研究显示,ROS会通过杀虫剂解毒核心转录因子CncC(cap ‘n’ collar isoform-C)上调P450和GST基因的表达而提高机体的杀虫剂抗性[83-85]。另一方面,AKH会抑制H2O2的生成以及相应的CncC和P450基因转录[85]。因此,AKH提高杀虫剂致死率的机理可能是远超生理水平的AKH外源注射过度抑制了体内ROS的生成和解毒基因的转录,而单独杀虫剂处理引起的内源AKH分泌在内稳态调控作用下不会严重影响解毒基因的表达。
4.2 AKH在饥饿胁迫中的功能机制
饥饿胁迫会促进脂肪体中脂类的动用[86]。虽然飞蝗和烟草天蛾中AKH并未参与调控饥饿导致的血淋巴中脂类含量倍增[87,88],但饥饿状态的褐飞虱AKH和AKHR以及橘小实蝇BactroceradorsalisAKHR的基因表达都明显增加,并且AKHR基因沉默的褐飞虱和AKH缺失的果蝇寿命显著延长[46,89-91]。反之,AKH过表达增加饥饿引起的死亡率[92]。饥饿状态的果蝇在死亡前表现出亢奋的觅食活动,而AKH缺失或失活表达AKHR的神经元则抑制这种行为[93,94],说明饥饿条件下AKH促进能量调动维持机体高度活跃以利于寻找食物。富含脂类的食物增强饥饿导致的亢奋活动。深入的研究发现高脂食物中的脂类会被载脂蛋白运输到表达AKHR的章鱼胺分泌神经元,而后通过抑制AMPK-TOR通路抑制神经元自噬使AKHR蛋白累积,最终介导高脂食物增强饥饿状态下的亢奋行为[95]。短时间(4 h)禁食条件下,AKH通过肝激酶B1(liver kinase B1)-盐诱导激酶3(salt-inducible kinase 3)-组蛋白去乙酰化酶4(histone deacetylase 4)通路使FoxO去乙酰化进而调控TAG脂酶brummer的转录[96]。饥饿状态的橘小实蝇AKHR基因沉默明显降低雄虫的求偶率,而雌虫生殖行为虽无明显变化,但产卵量显著减少[89]。与橘小实蝇相似,AKHR突变的果蝇雄虫在饥饿状态下交配率降低并对雄性特异性信息素的感应能力也减弱,而AKHR缺失的雌虫表皮中信息素的合成也受到抑制,推测饥饿胁迫下AKH/AKHR通路调控脂类调动而影响雄虫求偶行为和雌虫生殖力[89,97]。
另外,饥饿会阻碍果蝇的睡眠,其机理是饥饿导致含色素分散因子的小侧腹神经元(small ventral lateral neuron,s-LNv)背向连接的延展[98]。AKH或AKHR缺失会阻断饥饿诱发的这一反应以及睡眠丧失。另一方面FoxO具有调控神经元突触可塑性的功能,并且饥饿会增强FoxO的转录,而AKH缺失的果蝇中FoxO表达下降。因此AKH可以通过调控FoxO的基因表达抑制饥饿导致的sLNv背向连接延展和睡眠障碍[98,99]。
4.3 AKH在免疫反应中的作用
昆虫中负责脂类运输的载脂蛋白III(apolipophorin III,apoLp-III)具有激活免疫反应的作用,而AKH能够促进LDL生成和脂类运输,因此Goldsworthy等[100-102]最先利用飞蝗研究了AKH在免疫反应中的作用。结果显示,AKH I能够延长真菌细胞壁组分昆布多糖(laminarin)或真菌孢子引发的酚氧化酶原激活生成酚氧化酶的作用。虽然细菌细胞壁组分脂多糖(lipopolysaccharide,LPS)单独注射不会影响酚氧化酶原激活作用,但与AKH I共同处理则会明显增加酚氧化酶水平,并且还会促进LPS诱导的结节的形成[100,103,104]。昆布多糖和LPS注射能够增加血淋巴中LDL的含量,降低HDL和apoLp-III的水平,这种作用与AKH I处理效果相似,但两种免疫原处理并未引起血淋巴中AKH I滴度上升[102,105],因此两者诱发的免疫反应与AKH之间的关系还有待研究。
近年来的研究发现,昆虫病原线虫小卷蛾斯氏线虫Steinernemacarpocapsae处理能够显著增加始红蝽心侧体中AKH的表达水平和血淋巴中的滴度[106],而且昆虫病原真菌玫烟色棒束孢Isariafumosorosea注射后美洲大蠊心侧体中AKH的转录和蛋白合成也显著增强[107]。然而,病原线虫或真菌与AKH共同处理的昆虫死亡率会升高[101,107-109],其中的作用机制可能是血淋巴中受 AKH诱导升高的能量物质加速了微生物毒素进入宿主细胞,从而增强了毒素的致死性[107]。此外,麦蛾茧蜂Habrobraconhebetor毒液处理会增强美洲大蠊AKH的表达[110],并且始红蝽中血淋巴AKH滴度和脂类物质含量也相应升高,而毒液引起的神经肌肉麻痹效应在外源注射AKH后会显著降低[111],说明AKH能够帮助虫体抵御寄生蜂毒液。
5 小结与展望
能量稳态为机体提供了营养储存和利用相互平衡的内环境,是生命运行的基本保障。AKH作为多效性激素,对许多能量稳态相关的生理活动具有调节作用。虽然关于AKH的研究在早期主要集中于飞行等运动活动中能量物质调动的机理,但近五年来,AKH/AKHR通路在生殖生理进程和胁迫响应中的功能和作用机制有许多新的发现,因此对AKH信号通路有了更丰富的认识,并且其分子调控机理研究也取得了一定进展。然而,AKH/AKHR信号通路作用机制还存在较多不明之处,以下几个方面的问题还有待解析:(1)许多研究证实,FoxO介导了AKH/AKHR系统调控基因表达,但其自身转录也受AKH调控,其中的分子机制是什么?还有哪些转录因子在AKH作用下参与基因表达调控?(2)许多昆虫中,迁飞会以降低生殖力为代价供应其能量消耗,反之亦然,即迁飞-卵子发生综合症(flight-oogenesis syndrome)[112]。AKH作为营养物质动用的关键激素在迁飞和卵子发生的权衡中扮演怎样的角色?(3)昼夜节律如何协同insulin促进的合成代谢和AKH诱导的分解代谢以维持机体营养物质储存和再分配的平衡?阐明AKH在不同生命活动中调控内稳态的分子网络和作用机制,将有助于揭示昆虫种群数量庞大、适应范围广泛的遗传机理,并能为害虫防治提供新的理论依据。

