裙带菜孢子叶仿生酶解工艺优化及酶解肽的抗氧化活性分析
黄 雨,刘魏红,王洪阳,朱倩儿,郎晓晓,王 唯,陈生龙,于 慧
(鲁东大学食品工程学院,山东烟台 264025)
裙带菜(Undaria pinnatifida)隶属于褐藻门、褐子纲、海带目、翅藻科、裙带菜属,是一种大型温带经济褐藻,在我国主要分布于大连、烟台和荣成等海域[1−2]。孢子叶是裙带菜的繁殖器官,因其含较多纤维物质且质地较硬,食用口感较差,在加工过程中常作为废料被丢弃,造成资源浪费和环境污染[3−4]。经研究发现,孢子叶中含有多种营养物质,除多糖外,其蛋白质含量约为16%,且含有褐藻多酚、岩藻黄素等多种生物活性物质,可起到抗癌、抗肿瘤、抗氧化、降血脂等功效,是功能性食品开发的良好原料[5−6]。就目前而言,对裙带菜孢子叶的研究主要集中于多糖的提取,有关其蛋白质的研究较少,并且大多采用传统提取方法。有关研究表明,多肽是天然的抗氧化剂,能有效预防衰老及其他免疫疾病[7−9]。
仿生酶解,运用了化学仿生,是在酶解法的基础上,模拟消化道的酸碱环境,蛋白质大分子物质到达胃肠道后,在消化酶、酸碱环境等的作用下,被酶解成小分子物质,进而被人体吸收[10]。与其他酶解方法相比,仿生酶解具有作用条件温和、水解度高、反应周期短,模拟生物体机能,使蛋白以小肽的形式吸收更适合人体消化吸收利用的优点[11−14]。揣欣欣等[15]使用仿生酶解工艺,对鹿骨蛋白依次用胃蛋白酶、胰蛋白酶进行酶解,得到的酶解肽通过体外抗氧化实验表明,鹿骨多肽对DPPH、OH 自由基具有良好的清除能力。姜丰等[16]通过体外模拟胃肠道消化功能,研究卵白蛋白消化产物的抗氧化活性中发现,卵白蛋白经胃蛋白酶、胰蛋白酶酶解后所得产物的体外抗氧化活性增强并与产物浓度呈明显的剂量-依赖关系。韩荣欣等[17]对酸枣仁蛋白依次用胃蛋白酶、胰蛋白酶进行体外模拟消化的实验显示,经模拟胃肠消化后,DPPH、ABTS、O2−、OH 自由基清除率分别高达81.25%、90.40%、47.51%、32.66%,通过仿生酶解工艺得到的酶解肽具有较好的氨基酸组成和抗氧化活性。
近年来,国内外学者对藻类源抗氧化肽做了大量研究,发现其相比合成肽具有成本低、副作用小、有助于人体健康等优势[18]。研究表明,蛋白的水解程度以及抗氧化活性与酶解工艺直接相关,采取双酶法比单酶法有更好的酶解效果[19]。本团队前期利用仿生酶解技术从孢子叶中制备了抗肿瘤多肽,发现其对人胃癌细胞(SGC7901)、胰腺癌细胞(SW1990)和结肠癌细胞(LS180)的体外生长均有一定的抑制作用[20]。本实验在前期研究结果的基础上,利用仿生酶解工艺对裙带菜孢子叶进行酶解,以多肽得率和水解度为主要指标,通过单因素实验和响应面试验确定最优酶解工艺条件,对仿生酶解后的裙带菜孢子叶多肽进行抗氧化研究,并通过DPPH、ABTS、OH 自由基清除率参数来评价裙带菜孢子叶的抗氧化活性,旨在为仿生酶解制备生物活性肽和裙带菜孢子叶的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
裙带菜孢子叶干 山东省荣成科林水产食品有限公司;胃蛋白酶(1:15000)上海阿拉丁生化科技股份有限公司;胰蛋白酶(1:250)、菲啰嗪、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)≥98% 合肥博美生物科技有限责任公司;牛血清白蛋白 标准品,上海蓝季科技发展有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)梯希爱(上海)化工工业发展有限公司;其他试剂 均为国产分析纯。
JY92-IIDN 超声波细胞破碎仪 宁波新芝生物科技股份有限公司;KH19A 离心机 湖南凯达科学仪器有限公司;PB-10 Sartorious 普及型pH 计 德国赛多利斯股份有限公司;UV-1300 紫外可见分光光度计 上海美析仪器有限公司;XMTD-204 水浴恒温振荡器 金坛市天竟实验仪器厂;LGJ-18S 真空冷冻干燥机 北京松源华兴科技发展有限公司;RE-52B 旋转蒸发器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 裙带菜孢子叶仿生酶解工艺 将裙带菜孢子叶干粉碎后过40 目筛,取1 g 裙带菜粉末于100 mL超纯水中,进行超声破壁处理(超声功率720 W、超声时间40 min)。酶解过程使用0.05 mol/L 的HCl和NaOH 溶液来调节反应体系的pH,先将pH 调节至2.0 后加入胃蛋白酶进行酶解(37 ℃、2.5 h),然后进行灭酶处理(80 ℃,15 min),后将pH 调节至8.0,加入胰蛋白酶再次进行酶解(37 ℃、3 h),然后再次灭酶(80 ℃,15 min),将酶解液离心后(5000 r/min,20 min),取其上清液,最终得到酶解液[21]。
1.2.2 酶解条件单因素实验 以裙带菜孢子叶多肽的水解度和多肽得率为指标,主要考察超声功率、超声时间、料液比、胃蛋白酶量、胰蛋白酶量、胃蛋白酶酶解时间、胰蛋白酶酶解时间对裙带菜孢子叶多肽得率和水解度的影响。
1.2.2.1 超声功率的确定 在料液比1:50 g/mL、超声破壁40 min、加胃蛋白酶量6%、加胰蛋白酶量3%、胃蛋白酶酶解时间2 h、胰蛋白酶酶解时间3 h的条件下,选取超声功率为450、540、630、720、810 W,考察超声功率对裙带菜多肽得率和水解度的影响。
1.2.2.2 超声破壁时间的确定 在料液比1:50 g/mL、超声功率720 W、加胃蛋白酶量6%、加胰蛋白酶量3%、胃蛋白酶解时间2 h、胰蛋白酶酶解时间3 h 的条件下,选取超声破壁时间为20、30、40、50、60 min,考察超声破壁时间对裙带菜多肽得率和水解度的影响。
1.2.2.3 料液比的确定 在超声破壁40 min、超声功率720 W、加胃蛋白酶量6%、加胰蛋白酶量3%、胃蛋白酶酶解时间2 h、胰蛋白酶酶解时间3 h 的条件下,选取料液比为1:25、1:50、1:75、1:100、1:125 g/mL,考察料液比对裙带菜多肽得率和水解度的影响。
1.2.2.4 胃蛋白酶量的确定 在料液比1:100 g/mL、超声破壁40 min、超声功率720 W、加胰蛋白酶量3%、胃蛋白酶酶解时间2 h、胰蛋白酶酶解时间3 h 的条件下,选取加胃蛋白酶量为4%、5%、6%、7%、8%,考察加胃蛋白酶量对裙带菜多肽得率和水解度的影响。
1.2.2.5 胰蛋白酶量的确定 在料液比1:100 g/mL、超声破壁40 min、超声功率720 W、加胃蛋白酶量6%、胃蛋白酶酶解时间2 h、胰蛋白酶酶解时间3 h 的条件下,选取加胰蛋白酶量为1%、2%、3%、4%、5%、6%,考察加胰蛋白酶量对裙带菜多肽得率和水解度的影响。
1.2.2.6 胃蛋白酶酶解时间的确定 在料液比1:100 g/mL、超声破壁40 min、超声功率720 W、加胃蛋白酶量6%、加胰蛋白酶量5%、胰蛋白酶酶解时间3 h 的条件下,选取胃蛋白酶酶解时间为1.5、2.0、2.5、3.0、3.5 h,考察胃蛋白酶酶解时间对裙带菜多肽得率和水解度的影响。
1.2.2.7 胰蛋白酶酶解时间的确定 在料液比1:100 g/mL、超声破壁40 min、超声功率720 W、加胃蛋白酶量6%、加胰蛋白酶量5%、胃蛋白酶酶解时间2.5 h 的条件下,选取胰蛋白酶酶解时间为1.5、2.0、2.5、3.0、3.5 h,考察胰蛋白酶酶解时间对裙带菜多肽得率和水解度的影响。
1.2.3 响应面优化试验 根据单因素实验结果,运用Box-Behnken 设计原理[22],以料液比(A)、胃蛋白酶量(B)、胰蛋白酶酶解时间(C)为变量,进行三因素三水平的响应面试验,因素与水平设计见表1。采用F检验的方法对试验结果进行方差分析以评价模型的统计意义。
1.2.4 多肽得率的测定 参照文献[23]的方法并稍作修改,以牛血清白蛋白对照品溶液浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线y=4.4766x−0.0159(R2=0.9947)。样品的测定:取0.1 mL 酶解液、0.9 mL 蒸馏水于试管中,先后加入1 mL 的碱性铜试液和4 mL 的福林酚试剂,摇匀。置于55 ℃水浴锅中反应5 min,取出放冷水中10 min,然后在650 nm 的波长处测定其吸光度,并以蒸馏水作空白实验,根据标准曲线计算裙带菜样品的多肽得率(W)。计算公式如下:
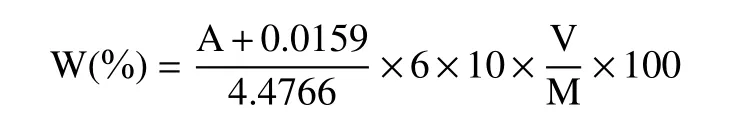
式中:W 为多肽得率(%);A 为样品测得的吸光度;V 为样品酶解后上清液体积(mL);10 为稀释倍数;M 为裙带菜样品的质量(g)。
1.2.5 水解度的测定 参考文献[24]取灭酶后10 mL酶解液置于50 mL 烧杯中,加蒸馏水10 mL,开动磁力搅拌器进行搅拌,用0.01 mol/L NaOH 溶液滴定至pH8.2,加入10 mL 中性甲醛溶液,混匀,用0.01 mol/L NaOH 标准溶液滴定至pH9.2,记录消耗NaOH 标准溶液体积为V,同时取20 mL 蒸馏水按上述方法作空白实验,记录消耗NaOH 标准溶液体积为V0。水解度(DH)计算公式如下:
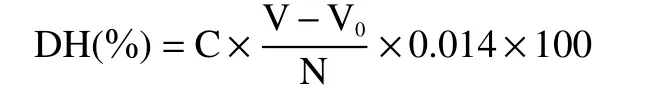
式中:C 为NaOH 标准溶液浓度(mol/L);V 为酶解液消耗NaOH 标准溶液体积(mL);V0为空白液消耗NaOH 标准溶液体积(mL);N 为底物样品总氮含量(g);0.014 为氮毫克当量。
1.2.6 酶解肽的制备工艺 在酶解液中加乙醇至体系乙醇体积分数为60%,醇沉12~16 h,过滤后离心(8000 r/min、15 min)得到上清液。上清液经浓缩后加入2%活性炭脱色2 h,过滤后浓缩冻干获得多肽粉[21]。
1.2.7 抗氧化性的测定
1.2.7.1 DPPH 自由基清除能力的测定 参照文献[25−26]的方法并稍作修改,取2.00 mL 不同浓度的样品溶液于不同的试管中,配置浓度为0.1 mol/L DPPH-乙醇溶液,向每个试管中加入2.00 mL DPPH-乙醇溶液,立即混匀,室温下暗反应0.5 h,于517 nm处测定溶液吸光值A1。同时以乙醇代替DPPH乙醇溶液作空白实验测定其吸光度值A2,以蒸馏水代替样品溶液作对照实验测定其吸光度值A0。设置阳性对照(VC),样品测定结果与VC对照组比较。计算公式如下:
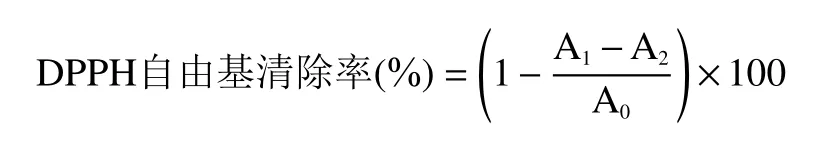
1.2.7.2 ABTS 自由基清除能力的测定 参照文献[27]的方法并稍作修改,将ABTS(38.4 mg)溶于过硫酸钾溶液中,避光12~16 h,生成ABTS 自由基阳离子,再用磷酸缓冲溶液(pH7.4)进行稀释,调734 nm 处吸光值为0.7±0.2;取0.1 mL 不同浓度的样品溶液与3.9 mL ABTS 工作液混合,室温避光反应6 min,于734 nm 处测吸光值A1。同时以磷酸缓冲溶液代替ABTS 工作液作空白实验测定其吸光度值A2,以蒸馏水代替样品溶液作对照实验测定其吸光度值A0。按下式计算ABTS自由基清除率:
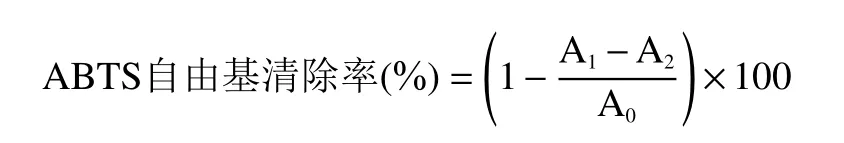
1.2.7.3 OH 自由基清除能力的测定 参照文献[28]的方法并稍作修改,分别取1.00 mL 不同浓度的样品溶液于试管中,依次加入9 mmol/L FeSO4溶液,9 mmol/L 水杨酸-乙醇溶液,8.8 mmol/L H2O2溶液各1.00 mL,混合均匀,于37 ℃条件下水浴30 min,510 nm 处测定溶液吸光值A1。同时以蒸馏水代替H2O2溶液作为空白实验测定其吸光度值A2,以蒸馏水代替样品作对照实验测定其吸光度值A0。羟自由基清除率的计算方法如下所示:
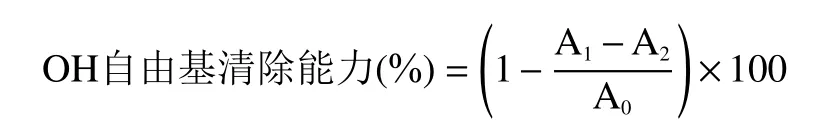
1.3 数据处理
采用Microsoft Excel 2010 软件对实验数据进行平均数和标准偏差的统计分析并绘图,采用Design-Expert 10 对响应面分析实验结果进行作图分析,其中使用ANOVA 程序作数据分析,使用Model Graphs 程序作响应面图。
2 结果与分析
2.1 单因素实验结果
2.1.1 超声功率的选择 由图1 可知,随着超声功率的增大,在一定范围内,裙带菜孢子叶的酶解产物的多肽得率和水解度是上升的,当超声功率达到720 W时,两者均达到最大值,多肽得率达到16.17%,水解度达到39.96%。这是因为在450~720 W 范围内,超声空化产生的流体剪切力快速地破坏细胞壁,酶结合位点增多,使得蛋白质的逸出加速,带有疏水侧链的残基与水分子接触,通过疏水作用加速了蛋白质的溶解,使多肽得率和水解度均上升[29]。当超声功率超过720 W 后,多肽得率和水解度均呈下降趋势。这可能是因为:超声功率过大不利于裙带菜溶液在超声中形成对流,降低了超声破壁的效率,从而导致多肽得率下降;蛋白质分子过度松散,疏水作用过强,蛋白质聚合成难溶的聚集体沉积在液体中,处于水分子周围的蛋白质区域减少,难以溶解,从而导致水解度下降[30]。因此,超声功率的最优选择是720 W。
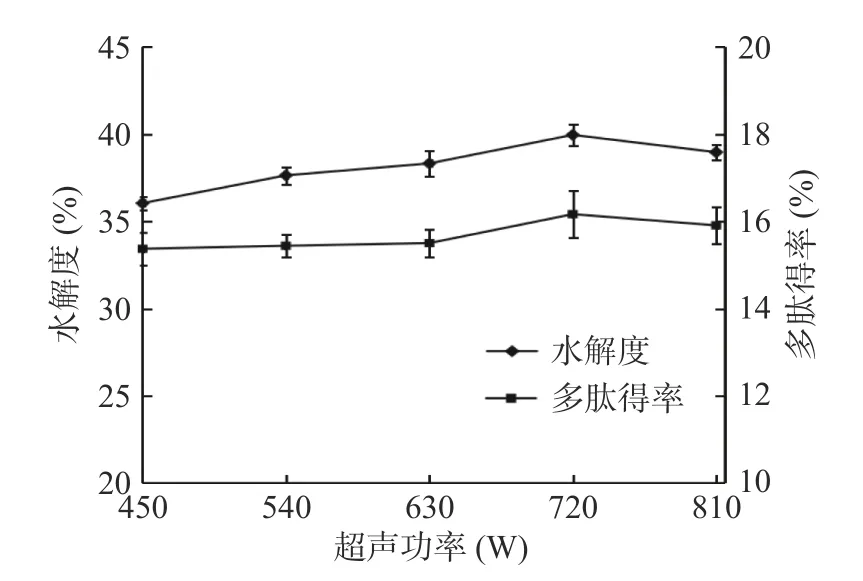
图1 超声功率对多肽得率和水解度的影响Fig.1 Effect of ultrasonic power on polypeptide yield and degree of hydrolysis
2.1.2 超声时间的选择 由图2 可知,随着超声时间的增大,在一定范围内,裙带菜孢子叶酶解产物的多肽得率和水解度是上升的,当超声时间达到40 min时,两者均达到最大值,多肽得率达到15.08%,水解度达到37.89%。这是由于在20~40 min 超声过程中,破壁程度上升,蛋白质的结构展开,官能团也随之展露出来,蛋白质的水合作用增强[31],使多肽得率和水解度均上升。当超声破壁时间超过40 min 时,多肽得率和水解度均呈下降趋势。这可能是因为:当超声时间超过40 min 时,裙带菜孢子叶溶液有黑色沉淀形成,超声时间太长导致蛋白质碳化,从而引起多肽得率和水解度的降低[32]。因此,超声时间的最优选择是40 min。
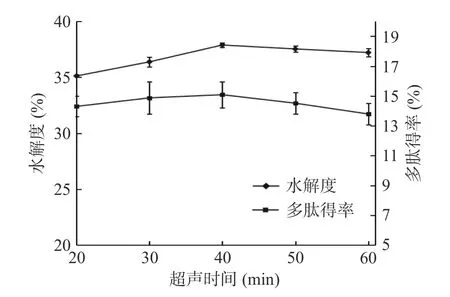
图2 超声时间对多肽得率和水解度的影响Fig.2 Effect of ultrasonic time on polypeptide yield and degree of hydrolysis
2.1.3 料液比的选择 由图3 可知,随着料液比的增大,在一定范围内,裙带菜孢子叶的酶解产物的多肽得率和水解度是上升的,当料液比达到1:100 g/mL时,两者均达到最大值,多肽得率达到23.32%,水解度达到37.63%。这是因为在料液比为1:25~1:100 g/mL 范围内时,由于水分含量过少,减少了裙带菜孢子叶底物和胃蛋白酶、胰蛋白酶的扩散和接触,从而对酶解产生抑制作用。当料液比小于1:100 g/mL时,多肽得率和水解度均逐渐降低,这说明裙带菜孢子叶底物和胃蛋白酶、胰蛋白酶的浓度过小而导致它们之间的碰撞几率下降,酶解蛋白不够彻底,从而使多肽得率和水解度降低[33]。因此,料液比的最优选择是1:100 g/mL。
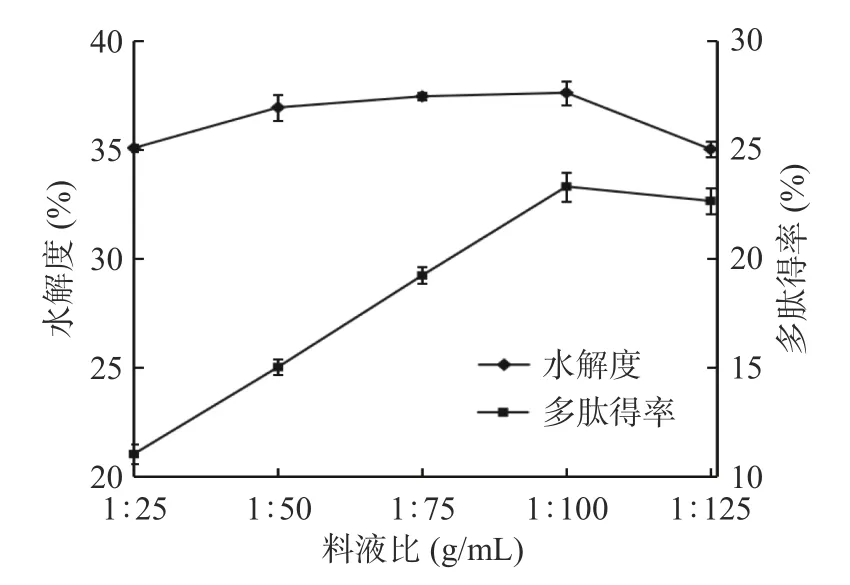
图3 料液比对多肽得率和水解度的影响Fig.3 Effect of solid to liquid ratio on polypeptide yield and degree of hydrolysis
2.1.4 蛋白酶量的选择 由图4 和图5 可知,随着胃蛋白酶和胰蛋白酶量的增大,在一定范围内,裙带菜孢子叶的酶解产物的多肽得率和水解度是上升的,当胃蛋白量为6%时,胰蛋白量为5%时,两者均达到最大值,多肽得率达到22.43%,水解度达到40.08%。这是因为随着酶用量的增加使得酶与裙带菜孢子叶中蛋白质结合的几率增大,酶能更充分地与底物进行反应,从而使多肽得率和水解度增加[34];当胃蛋白酶量超过6%,胰蛋白酶量超过5%后时,多肽得率和水解度有降低的趋势。这是因为在酶解后期,裙带菜中的蛋白被完全水解成多肽后,多肽也会作为蛋白酶的底物被进一步水解成分子量更低的肽分子,以至于最后水解形成氨基酸,导致多肽得率降低;同时,随着加酶量的增大,单位酶作用的蛋白质会变少,若酶的量较多时,反应会受到抑制,导致水解度变小[34]。因此,胃蛋白酶量和胰蛋白酶量的最优选择分别为6%和5%。

图4 胃蛋白酶量对多肽得率和水解度的影响Fig.4 Effect of pepsin amount on polypeptide yield and degree of hydrolysis
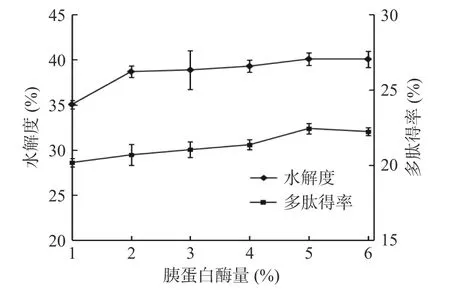
图5 胰蛋白酶量对多肽得率和水解度的影响Fig.5 Effect of trypsin content on polypeptide yield and degree of hydrolysis
2.1.5 酶解时间的选择 由图6 和图7 可知,随着胃蛋白酶和胰蛋白酶酶解时间的增大,在一定范围内,裙带菜孢子叶的酶解产物的多肽得率和水解度是上升的,当胃蛋白酶酶解时间为2.5 h,胰蛋白酶酶解时间为3 h 时,两者均达到最大值,多肽得率达到25.61%,水解度达到41.92%。这是因为随着酶解时间的增长,底物能更充分地与酶反应,从而多肽得率和水解度也在不断增加。之后,多肽得率和水解度呈下降趋势,这是因为:随着酶解时间的延长,多肽被过度水解为分子量更低的小肽和氨基酸等,导致多肽得率下降;酶的活力可能会降低甚至丧失,而且底物会被酶结合进行反应,渐渐地被转化,甚至过度水解[35],导致水解度开始降低。因此,胃蛋白酶和胰蛋白酶酶解时间的最优选择分别为2.5 和3 h。
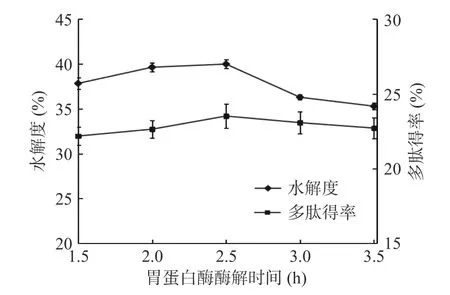
图6 胃蛋白酶酶解时间对多肽得率和水解度的影响Fig.6 Effect of enzymatic hydrolysis time of pepsin on polypeptide yield and degree of hydrolysis

图7 胰蛋白酶酶解时间对多肽得率和水解度的影响Fig.7 Effect of trypsin enzymatic hydrolysis time on polypeptide yield and degree of hydrolysis
2.2 响应面优化试验
根据单因素实验结果,超声时间、超声功率、胰蛋白酶量和胃蛋白酶酶解时间对裙带菜孢子叶多肽得率和水解度的影响不如其他3 个因素,因此,以料液比(A)、胃蛋白酶量(B)、胰蛋白酶酶解时间(C)为变量,进行三因素三水平的响应面试验[36]。
通过Design-Expert 10 软件进行仿生酶水解裙带菜蛋白的工艺条件优化的设计试验,共有17 组试验,其中,有5 组为中心点重复试验(表2)。并且利用Design-Expert 10 软件对多肽得率、水解度与各因素进行多元回归拟合,得二次多项式拟合方程为:

表2 Box-Behnken 试验设计及结果Table 2 Design and results of Box-Behnken experimental
Y1=20.95+1.16A+0.42B+0.18C−0.15AB−0.32AC+0.068BC−1.63A2−0.57B2−0.50C2。
Y2=43.19−0.22A−0.0672B+0.094C+0.29AB+0.050AC−0.14BC−1.38A2−1.65B2−1.94C2。
Y1方程回归模型的决定系数R2是0.9907,P<0.0001,这说明模型达到极显著的水平。Y1方程回归模型的失拟项P是0.7264,影响不显著(P>0.05),这说明该方程拟合度良好。Y2方程回归模型的决定系数R2是0.9751,P<0.0001,这说明模型达到极显著的水平。Y2方程回归模型的失拟项P是0.9542,影响不显著(P>0.05),这说明该方程拟合度良好。因此,可以用Y1、Y2回归方程表示各响应变量与响应值之间的关系,以评价各响应因素对响应值影响的显著性。
通过表3 和图8 可以得出,响应值是裙带菜孢子叶酶解产物多肽得率的模型,比较A、B、C 三个因素的F值大小以及A、B、C 与多肽得率曲线的陡峭程度可得,各响应因素影响程度依次为:A>B>C,即料液比对于裙带菜的酶解产物的多肽得率的影响最大。
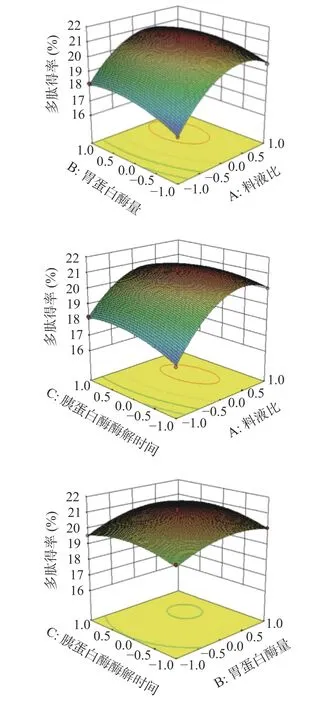
图8 各因素交互作用对多肽得率的影响Fig.8 Influence of interaction of various factors on polypeptide yield

表3 多肽得率二次回归方程方差分析结果Table 3 Variance analysis results of quadratic regression equation for peptide yield
通过表4 和图9 可以得出,响应值是裙带菜包子叶酶解产物水解度的模型,比较A、B、C 三个因素的F值大小以及A、B、C 与水解度曲线的陡峭程度可得,各响应因素的影响程度依次为:A>C>B,即料液比对于裙带菜的酶解产物的水解度的影响最大。

图9 各因素交互作用对水解度的影响Fig.9 Influence of interaction of various factors on degree of hydrolysis
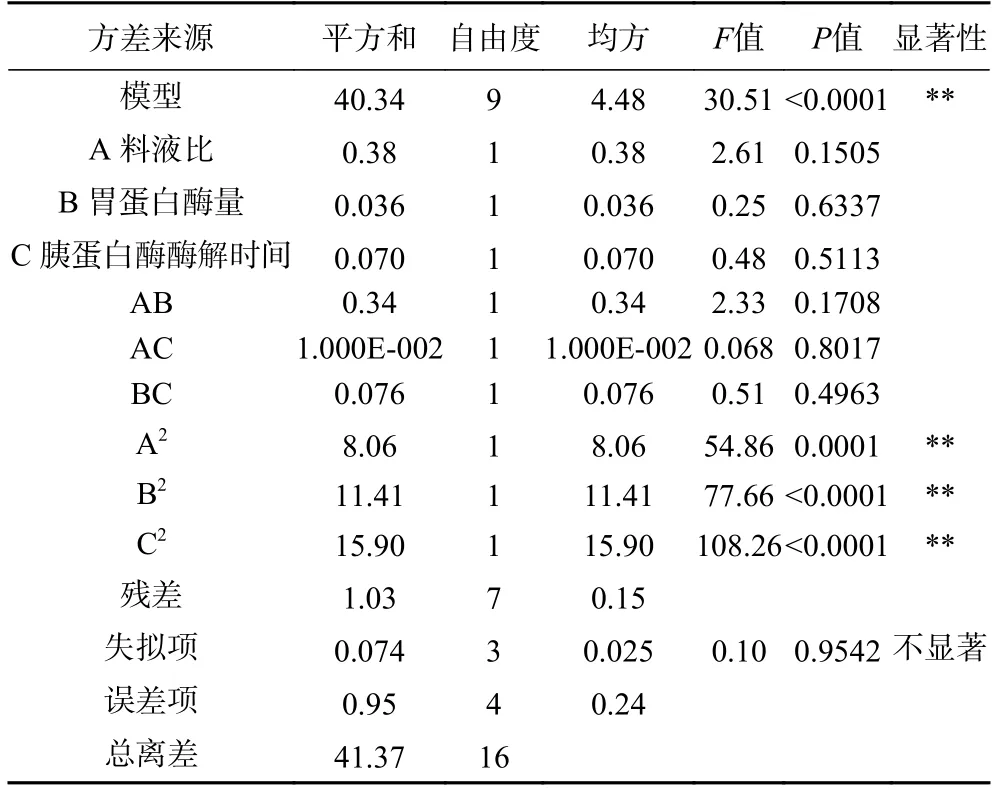
表4 水解度二次回归方程方差分析结果Table 4 Variance analysis results of quadratic regression equation for degree of hydrolysis
通过Design-Expert 10 软件得到了最佳工艺条件优化的组合为料液比103.62 g/mL、胃蛋白酶加酶量6.08%、胰蛋白酶酶解时间3.02 h。其他条件是按照单因素实验得到的最优结果:超声功率720 W、超声破壁时间40 min、胰蛋白酶用量5%、胃蛋白酶酶解时间2.5 h。为检验模型预测的准确性以及实验的可操作性,选取料液比104 g/mL、胃蛋白酶加酶量6.1%、胰蛋白酶酶解时间3 h,做3 组平行实验进行验证,得到的多肽得率为21.17%,水解度为43.07%。此结果与通过Design-Expert 10 软件预测得到的多肽得率21.12%,水解度43.12%相比,误差均在1%以内。根据上述分析,采用响应面的方法对裙带菜孢子叶仿生酶解工艺条件进行优化是可行的。
2.3 裙带菜孢子叶多肽的抗氧化活性测定
2.3.1 DPPH 自由基的清除能力 DPPH 自由基一般在室温下稳定存在,常用于评价体外清除自由基的抗氧化活性[37]。由图10 可以看出,与VC相比,裙带菜孢子叶多肽在0.25~10 mg/mL,清除率与孢子叶多肽浓度呈明显的剂量-效应关系,随着浓度的增大,DPPH 自由基清除率迅速升高,10~25 mg/mL 时,清除率增加趋缓,并在样品质量浓度为25 mg/mL 时达到70.50%。曹镇海等[38]在对暗纹东方鲀鱼皮胶原蛋白肽的实验中发现,在模拟肠胃道消化之前,胶原蛋白肽的DPPH 清除能力仅7.89%,经胃蛋白酶酶解后,DPPH 清除率可达28.77%,经胰蛋白酶酶解后抗氧化活性稍有降低。徐杰等[39]认为某种物质DPPH自由基清除率的IC50值<10 mg/mL 时,即可认为有较好的抗氧化性。因此,可以认为,本实验经仿生酶解获得的裙带菜孢子叶多肽具有较好的DPPH 自由基清除能力,其IC50值为5.71 mg/mL。
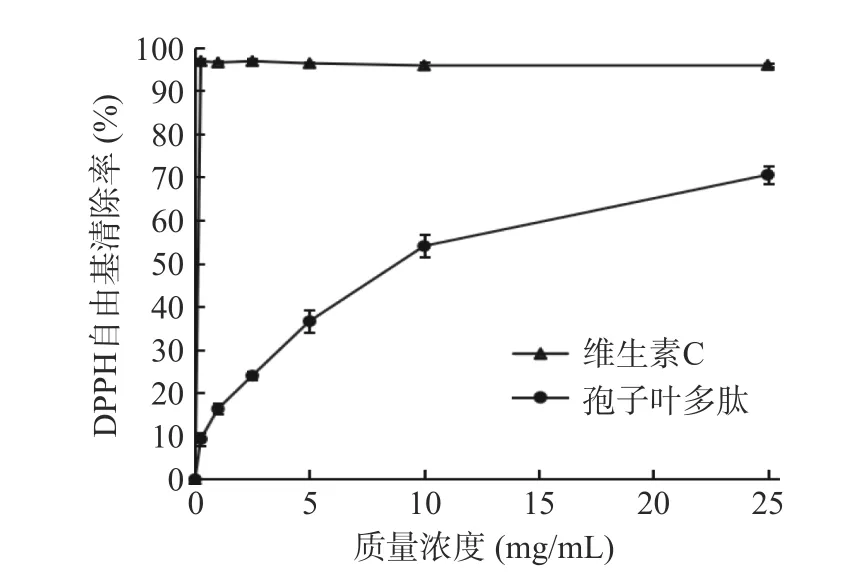
图10 裙带菜孢子叶多肽对DPPH 自由基清除能力的影响Fig.10 Effects of Undaria pinnatifida sporophyll polypeptide on DPPH free radical scavenging ability
2.3.2 ABTS 自由基的清除能力 ABTS 自由基既能溶于水相也能溶于有机相,也常用于评估抗氧化能力。由图11 可以看出,与VC相比,裙带菜孢子叶多肽在0~1.25 mg/mL,清除率与孢子叶多肽浓度呈明显的剂量-效应关系,随着浓度的增大,ABTS 自由基清除率迅速升高,1.25~2.5 mg/mL 时,清除率增加趋缓,并在样品质量浓度为2.5 mg/mL 时达到88.66%。冯晓文等[40]认为,经仿生酶解后,可能是由于经模拟肠胃道消化后,分解成了更多具有ABTS 自由基清除活性的小肽,乳清肽的ABTS 自由基清除能力有一定的提高。毛小雨[41]研究表明,与芸豆蛋白相比,经胃部模拟消化后多肽的ABTS 自由基清除率增加了43.72%,经肠道消化后的ABTS 自由基清除率增加了121.07%。因此可以得到,经过仿生酶解后得到多肽的抗氧化活性进一步提升。本实验所研究的裙带菜孢子叶多肽具有较强的ABTS 自由基清除能力,但比相同浓度下,阳性对照组VC的清除率低,其IC50值为0.82 mg/mL。

图11 裙带菜孢子叶多肽对ABTS 自由基清除能力的影响Fig.11 Effects of Undaria pinnatifida sporophyll polypeptide on ABTS free radical scavenging ability
2.3.3 OH 自由基的清除能力 OH 基自由基是一种非常活泼的自由基,可使机体内的有机大分子发生氧化,对身体造成损伤[42−43]。由图12 可以看出,与VC相比,裙带菜孢子叶多肽在0.125~1.5 mg/mL,清除率与孢子叶多肽浓度呈明显的剂量-效应关系,随着浓度的增大,OH 自由基清除率迅速升高,1.5~5 mg/mL时,清除率增加趋缓,并在样品质量浓度为5 mg/mL时达到96.01%,这与叶昱辉[44]对牡蛎多肽的羟自由基清除力的研究结果类似。毕秋芸[37]通过碱性蛋白酶酶解裙带菜蛋白,再经超滤分级得到不同分子量的多肽,研究发现,低分子量多肽的抗氧化活性高于高分子量的多肽,但其OH 自由基清除能力较低,最高仅21.85%。而本实验说明通过仿生酶解制备的孢子叶多肽具有较好的OH 自由基清除能力,其IC50值为1.35 mg/mL。
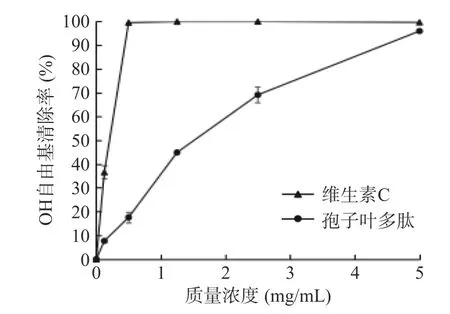
图12 裙带菜孢子叶多肽对OH 自由基清除能力的影响Fig.12 Effects of Undaria pinnatifida sporophyll polypeptide on OH free radical scavenging ability
3 结论
本实验以裙带菜孢子叶为原料,利用仿生酶解工艺,通过单因素和响应面优化试验分析,获得优化裙带菜孢子叶的最佳酶解工艺条件:超声功率720 W,超声破壁时间40 min、料液比1:104 g/mL、胃蛋白酶加酶量为6.1%、酶解时间2.5 h、胰蛋白酶加酶量为5%、酶解时间3 h。在此条件下进行酶解,多肽得率为21.17%,水解度为43.07%。运用仿生酶解工艺,在最优条件下制备的孢子叶酶解肽,对DPPH、ABTS、OH 自由基清除率分别达到70.50%、88.66%、96.01%。通过抗氧化研究,在一定范围内,孢子叶多肽对自由基清除能力呈现剂量-效应关系,其DPPH、ABTS、OH 自由基的IC50值分别为5.71、0.82、1.35 mg/mL,此结果可为今后裙带菜孢子叶的开发利用提供理论依据。

