干旱缺钾对油菜内源激素、光合作用和叶绿素荧光特性的影响
朱波,徐绮雯,马淑敏,刘帮艳,段美春,王龙昌*
(1.西南大学农学与生物科技学院,三峡库区生态环境教育部重点实验室,南方山地农业教育部工程研究中心,重庆,400716;2.重庆师范大学生命科学学院,重庆,401331)
钾(K)是植物组织中含量最丰富的阳离子,约占植物干重的2%~10%[1,2]。钾广泛参与植物生理过程,如酶的激活、渗透调节、离子平衡、物质运输、蛋白质合成等,并在植物应对干旱等非生物胁迫中具有重要作用[3]。许多研究表明植物遭受干旱胁迫时对钾的需求增加[4],增施钾肥可缓解干旱对植物生长影响[5]。增施钾肥缓解干旱的主要途径包括:提升渗透调节能力并维持细胞膨压[6];提高叶片气孔开闭灵敏度[7];减少活性氧的积累[4];降低细胞膜透水性,提高水分利用效率[8,9];提高木质部导水能力并维持植株体内水分长距离运输[10]。植物激素是植物体内广泛存在的调节自身生理代谢的活性物质,主要包括生长激素(IAA)、细胞分裂素(CTK)、赤霉素(GA)、脱落酸(ABA)、乙烯、油菜素内酯(BR)等,在植物响应逆境胁迫中发挥着重要的调控作用[11]。干旱胁迫下,通常植物体内IAA、GA 和CTK 含量降低,而ABA 和乙烯含量升高,从而调控生理生化过程以及同化产物的分配以适应干旱[12]。ABA是植物响应干旱胁迫最重要的信号调节物质,干旱胁迫下植物合成大量ABA 调节叶片气孔关闭以减少水分散失[12],同时ABA 的大量合成会加剧叶片发育性衰老和应激性衰老[13]。Hosseini 等[14]研究发现干旱胁迫下大麦通过维持叶片高钾浓度可促进ABA 的降解,从而延缓叶片衰老。涂冰洁等[15]发现缺钾会导致大豆叶片中ABA 含量显著增加。IAA 和CTK 可分别促进细胞核和细胞质分裂,从而促进植物生长[16],干旱胁迫下增施钾肥可促进甘薯块根和叶片IAA、GA 和CTK 含量显著增加,进而促进块根淀粉的积累[17]。姜仲禹等[18]研究发现,通过增施钾肥可降低甘薯根系IAA 氧化酶的活性,从而促进IAA 含量的提高。光合作用是植物生长和干物质积累的主要来源,干旱胁迫会导致叶片气孔关闭,RuBP 羧化酶等光合酶活性降低,并抑制光化学反应[12]。植物光合机构由光系统I(PSI)和光系统II(PSII)构成,其中PSII 被认为是胁迫条件下发生光抑制的原初部位,与之相比,PSI相对稳定[19]。前人研究发现,逆境胁迫下提高作物组织内钾素水平可维持光化学电子传递[4],显著提高油菜叶片PSII 的活性[20],然而缺钾会引起PSII 供体侧受到抑制并导致PSII 光抑制[21]。油菜(Brɑssicɑ nɑpusL.)是我国最主要的油料作物,也是重要的饲料蛋白来源,2019 年油菜的播种面积达到658.3 万公顷,仅次于水稻、玉米、小麦和大豆(国家统计局)。由于季节性干旱频发,严重制约我国油菜生产[22]。尽管钾在作物抗旱机理上已有探究,但钾对油菜抗旱机理尤其在激素和叶绿素荧光水平上的研究较少。本研究通过PEG6000 模拟干旱试验,重点探讨干旱胁迫下不同钾肥水平对油菜激素调控、光合作用、叶绿素荧光的影响,旨在揭示钾在油菜抗旱生理上的作用,为油菜抗旱栽培提供理论依据。
1 材料与方法
1.1 材料
抗旱品种油研57 和干旱敏感品种川油36[23]均为甘蓝型油菜品种。试验于西南大学实验农场进行。
1.2 方法
将油菜种子置于石英砂中育苗,10 d 后将长势一致的苗移至直径120 mm、高110 mm 连盖塑料黑桶中进行水培,每个盖子上有5 个孔,每孔移苗1株,用海绵固定,并置于避雨温室中。采用1/2 Hogland 营养液,含有1.0 mmol/L K2SO4,2.5 mmol/L Ca(NO3)2,0.25 mmol/L Ca(H2PO4)2,1.0 mmol/L MgSO4,20µmol/L FeSO4,0.3µmol/L CuSO4,0.8µmol/L ZnSO4,5µmol/L MnCl,50µmol/L H3BO3,0.1µmol/L H2MoO4,用H2SO4或Ca(OH)2将pH 调至6.0,营养液每5 d 更换一次。培养20 d 后,设置缺钾(0.01 mmol/L K2SO4)和正常钾肥(1.0 mmol/L K2SO4)两个梯度(除K 外,其它营养元素不变),并添加7%质量浓度PEG6000 模拟干旱,分别记为LK 和NK 处理,另设置1.0 mmol/L K2SO4营养液,不添加PEG6000做对照,记为CK。每个处理重复4 次。处理8 d 后,取从上往下第二片完全展开叶装在自封袋中,迅速置于液氮中猝灭并于-80℃冰箱保存,用于激素、叶绿素、光合酶和MDA含量的测定。
1.3 测定指标及方法
1.3.1 生物量 干旱处理8 d 后,将油菜整株取出,2 株为一个重复,用去离子水洗净置于纸袋中,120℃杀青30 min,80℃烘干至恒重。
1.3.2 内源激素和光合酶 IAA、CTK、GA、ABA、RuBP 羧化酶和PEPC 酶的测定采用酶联免疫法(ELISA),准确称取0.2 g 叶片,加入1.6 mL 0.1 mol/L pH7.4 的磷酸缓冲液磨样至匀浆,8000×g离心10 min,取上清液用于激素和酶活性的测定。测定试剂盒购自江苏博深生物科技有限公司,测定方法参照使用说明[24]。
1.3.3 叶绿素 准确称取0.05 g 叶片于2 mL 离心管中,加入丙酮∶乙醇∶水(4.5∶4.5∶1)浸提液1.6 mL,60 Hz 磨样2 min,8000×g离心10 min,取上清液在645 nm 和663 nm 下测定吸光度值。叶绿素含量= (20.29A645+8.05A663)×V/m×1000,其中V为浸提液体积,m为样品重量。
1.3.4 光合作用 干旱处理第7 d,在上午9:00-11:00用LI6400便携式光合仪器(Li-Cor公司,美国)测定油菜心叶往下第二片完全展开叶净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)。测定参数设定为:红蓝光源,光强为1000µmol·m-2·s-1,CO2浓度为430µmol/mol,流速为500µmol/s,样品室温度为28℃。
1.3.5 叶绿素荧光参数及P700 采用Dual-PAM-100 荧光仪(Walz,Germany),同步测定油菜心叶往下第二片完全展开叶光系统II(PSII)和光系统I(PSI)。参考肖飞等[25]方法并略有改动,测定前暗适应0.5 h,测定中避免其他光源的干扰,首先打开测量光测定最小荧光产量(Fo),然后施加饱和脉冲光得到最大荧光产量(Fm)和最大P700 信号(Pm),随后打开光化光(Al),强度为1030µmol photons·m-2·s-1,待荧光信号稳定后(4~5 min),打开饱和脉冲光(SP),强度为20 000 µmol photons·m-2·s-1,时间为300 ms,测定任意时间的实际荧光产量(Fs),过30 s关掉作用光(AL),测定光适应状态下的最大荧光产量(Fm′)和光下最大P700 信号(Pm′)。按Dual-PAM-100 使用说明,分析PSII最大光有效光化学量子产量[Y(II)]、调节性能量耗散[Y(NPQ)]、非调节性能量耗散[Y(NO)]和PSI 有效光化学量子产量[Y(I)]、PSI 供体侧限制[Y(ND)]、PSI 受体侧限制[Y(NA)]等,计算公式为:
Y(II)=(Fm′-Fs)/Fm′
Y(NO)=Fs/Fm
Y(NPQ)=1-Y(II)-Y(NO)
Y(NA)=(Pm-Pm′)/Pm
Y(ND)=1-P700red
Y(I)=1-Y(ND)-Y(NA)
1.4 统计分析
采用Excel 2010 进行数据分析和作图,在SAS V8 中采用最小显著差异法(LSD,P<0.05)对不同水分和钾肥处理进行多重比较。
2 结果与分析
2.1 干旱胁迫下不同钾肥水平对油菜生长和内源激素的影响
由图1 可知,经过8 d 的干旱处理,油菜生长受到严重抑制,叶片表现出明显的萎蔫症状。与NK处理相比,LK处理下,叶片萎蔫症状更严重,且油菜子叶黄化、早衰加剧。油研57 受干旱胁迫影响较小,且子叶黄化、早衰症状较川油36更轻。与CK 相比,LK和NK处理下川油36和油研57的干物质积累大幅降低(表1)。不同钾肥水平对干旱胁迫下油菜生物量影响显著(P<0.05),与NK 处理相比,LK 处理下川油36 和油研57 的干物重分别减少了16.5%和14.4%。干旱胁迫下油菜品种间干物质积累间表现出较大差异,在NK 和LK处理条件下油研57的干物重分别较川油36 高出17.3%和20.0%。干旱胁迫下不同钾肥水平对油菜内源激素影响显著。干旱胁迫下,川油36 和油研57 叶片ABA 含量均升高,表现出LK>NK>CK 的趋势,且LK 与NK 和CK差异达显著水平(P<0.05)。川油36 叶片中GA 含量呈现LK>NK>CK 的趋势,且LK 处理下GA 含量显著高于CK。与CK 相比,油研57 叶片中GA 含量在LK 和NK 处理下均升高,但各处理间差异不显著。川油36叶片中GA含量在LK和NK处理下均高于油研57,且在LK 处理下差异达显著水平(P<0.05)。干旱胁迫下,两个品种叶片中IAA含量均显著降低。与NK 处理相比,两个品种生长素含量LK处理下均降低,且在川油36 中降幅最大,差异达显著水平(P<0.05)。此外,LK 处理下,油研57 的生长素含量显著高于川油36。与此相似的是,川油36叶片中CTK 含量呈现CK>NK>LK 的趋势,且各处理间差异显著(P<0.05)。NK 处理下油研57 叶片CTK 含量与CK 相比差异不显著,然而LK 处理下细胞CTK 含量显著降低。值得注意的是,油研57 在NK 和LK 处理下CTK 含量均显著高于川油36。不同钾肥水平对BR 含量影响显著,两个品种叶片中BR 含量在不同水分和钾肥水平下呈现出CK>NK>LK 的趋势,且在油研57 中LK 与NK 间的差异达显著水平。油研57 BR含量在LK和NK处理下均高于川油36。

图1 不同水分和钾肥条件下油菜生长的表型差异Fig.1 Phenotypic difference of rapeseed under different water and potassium level

表1 干旱胁迫下不同钾肥水平对油菜生长和内源激素的影响Table 1 Effect of different potassium level on rapeseed growth and hormone under drought stress
2.2 干旱胁迫下不同钾肥水平对油菜光合特征的影响
2.2.1 对光合作用的影响 由图2A可知,与CK相比,川油36的净光合速率在LK 处理下显著降低,在NK 处理下差异不显著。干旱胁迫下,油研57 的净光合速率显著降低,且在NK 处理下显著高于LK 处理。在NK 处理下,川油36 净光合速率显著高于油研57,然而,在LK 处理下,油研57 净光合速率显著高于川油36。干旱胁迫下两个品种叶片气孔导度均显著降低,且LK 处理下气孔导度显著低于NK 处理。LK 处理下,油研57 叶片气孔导度显著高于川油36(图2B)。叶片的胞间CO2浓度呈现CK>NK>LK 的趋势,在川油36 中LK 处理和NK 处理差异达显著水平(图2C)。川油36叶片蒸腾速率呈现NK>CK>LK 的趋势,且各处理间差异显著。干旱胁迫下,油研57 蒸腾速率显著降低,LK 处理和NK 处理间差异不显著(图2D)。

图2 干旱胁迫下不同钾肥水平对光合作用的影响Fig.2 Effects of different potassium level on photosynthesis under drought stress
2.2.2 对叶片MDA 含量、叶绿素含量及光合酶活性的影响 干旱胁迫下川油36 叶片中MDA 含量大幅增加,且在LK 处理下显著高于NK 处理。油研57叶片MDA 含量在LK 和NK 处理下差异不显著,且均低于川油36,在LK 处理条件下差异达显著水平(图3A)。干旱胁迫导致油菜叶绿素含量显著降低,在川油36 叶绿素含量呈现CK>NK>LK 的趋势,各处理间差异显著(P<0.05)。油研57 叶绿素含量受干旱胁迫的影响较小,在LK 和NK 处理下差异不显著,且油研57 各处理条件下叶绿素含量均显著高于川油36(图3B)。RuBP 羧化酶和PEPC 酶活性在不同钾肥水平和品种间表现出较大的差异。干旱胁迫下,川油36 叶片RuBP 羧化酶活性显著降低,在LK 处理下显著高于NK 处理。与之相反的是,川油36 在NK 处理下PEPC 酶活性最高,显著高于CK 和LK 处理。油研57 叶片RuBP 羧化酶和PEPC 酶活性主要受钾素水平的影响。与CK 相比,油研57 的RuBP 羧化酶和PEPC 酶活性在NK 处理下差异不显著。然而,与NK 处理相比,LK 处理下油研57 叶片RuBP 羧化酶和PEPC 酶活性显著降低(图3C、D)。

图3 干旱胁迫下不同钾肥水平对MDA含量(A)、叶绿素含量(B)、RuBP羧化酶(C)和PEPC酶(D)的影响Fig.3 Effect of different water and potassium level on content of MDA (A),Chlorophyll(B),enzyme activity of RuBP carboxylase(C)and PEPC(D)
2.3 干旱胁迫下不同钾肥水平对油菜叶绿素荧光特性的影响
2.3.1 对PSII 的影响 由图4A 可知,干旱胁迫下PSII最大光化学量子产量(Fv/Fm)显著降低,且油研57 的最大光化学量子产量显著高于川油36。不同钾肥水平对最大光化学量子产量影响显著(P<0.05),与NK 相比,川油36 的Fv/Fm 在LK 处理下显著降低。干旱胁迫导致光下最大光化学量子产量(Fv′/Fm′)显著降低,两个品种Fv′/Fm′在LK 处理下均高于NK 处理,在川油36 中差异达显著水平(P<0.05)。干旱胁迫导致有效光化学量子产量[Y(II)]显著降低,LK 和NK 处理间差异不显著。川油57 的Y(II)在LK 和NK 处理上均高于川油36,且在NK 处理下差异达显著水平(图4C)。与此相似的是,干旱胁迫导致PSII 电子传递速率显著降低,且不同钾肥水平间差异不显著。油研57 的PSII 电子传递速率[ETR(II)]在LK 和NK 处理上均高于川油36,且在NK处理下差异达显著水平(图4D)。LK 处理下,两个品种非调节性能量耗散[Y(NO)]均显著高于NK 处理。与之相反的是,干旱胁迫下调节性能量耗散[Y(NPQ)]均升高,且NK 处理下两个品种的Y(NPQ)均高于LK 处理,在川油36 中差异达显著水平(P<0.05)。

图4 干旱胁迫下不同钾肥水平对PSII的影响Fig.4 Effects of different potassium level on PSII under drought stress
2.3.2 对PSI 的影响 由图5 可知,干旱胁迫下P700 最大变化值(Pm)显著降低。川油36 的Pm 在LK 处理下显著高于NK 处理,与之相反的是油研57的Pm 在LK 处理下显著低于NK 处理。此外,油研57 的Pm 在NK 处理下显著高于川油36,而在LK 处理下二者差异不显著。光下P700最大变化值(Pm′)在干旱胁迫下显著降低,NK 处理下两个品种Pm′均显著高于LK 处理,且在油研57中差异达显著水平。PSI 系统光化学量子产量[Y(I)]在干旱胁迫下显著降低,呈现NK>LK 的趋势。油研57 的Y(I)在LK 和NK 处理下均显著高于川油36。PSI 电子传递速率[ETR(I)]在干旱胁迫下显著降低,呈现NK>LK 的趋势。油研57 的ETR(I)在LK 和NK 处理下均显著高于川油36。干旱胁迫导致PSI供体侧限制[Y(ND)]显著升高,且表现出NK>LK 的趋势。川油36 的Y(ND)升高幅度较大,在LK 和NK 处理下均显著高于油研57。LK 处理下,两个品种PSI 系统受体侧限制[Y(NA)]均显著高于NK 处理,与CK 相比,Y(NA)在LK处理下增加,而在NK处理下显著降低。
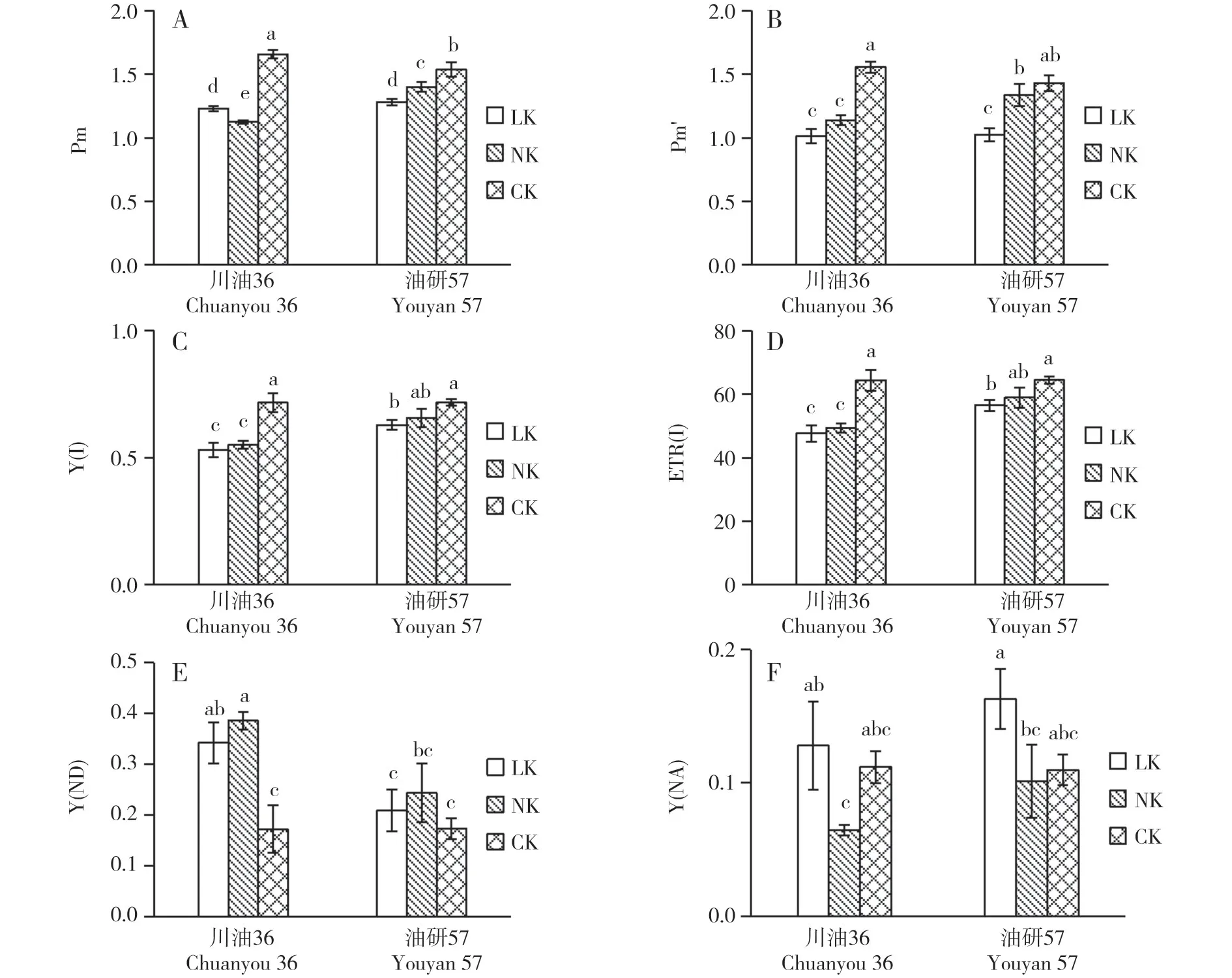
图5 干旱胁迫下不同钾肥水平对PSI的影响Fig.5 Effects of different potassium level on PSI
3 讨论
3.1 干旱缺钾降低油菜生长促进类激素水平
PEG6000 模拟干旱胁迫下,油菜生长受到严重抑制,不同钾肥水平对油菜生长的影响显著,两个油菜品种干物重在LK 处理下较NK 处理降低15.5%,表明干旱缺钾条件下油菜生长受到进一步抑制。干旱胁迫下两个品种生长表现出显著差异,抗旱品种油研57 在NK 和LK 处理下的生物量较川油36 分别高17.3%和20.0%。逆境胁迫下植物通过内源激素调节生长、发育、养分分配和源库转换等以适应环境变化[26],通常可以将植物激素分为生长促进类激素(包含IAA、GA、CTK 和BR)和逆境应激应激激素(ABA、茉莉酸、水杨酸和乙烯)两大类[27]。ABA是植物响应干旱等逆境胁迫重要的信号调节物质[12],干旱胁迫下大量ABA 的合成不仅会引起叶片发育性衰老而且会引起应激性衰老[13]。Hosseini等[14]研究发现干旱胁迫下大麦通过维持叶片高钾浓度可促进ABA的降解并减少ABA积累,从而延缓叶片衰老。涂冰洁等[15]也发现缺钾条件下大豆叶片中ABA 含量显著增加。本研究中,干旱胁迫下两个油菜品种叶片中ABA 含量均增加,且在LK 处理下显著高于NK 处理,表明缺钾条件下,干旱诱导合成更多ABA 并加剧油菜叶片衰老。Jogawat 等[28]认为GA 对植物抗旱性具有负面作用。Nir等[29]发现干旱胁迫下抑制GA 的活性可减少番茄叶片气孔数量和孔隙从而减少水分散失,Omena-Garcia 等[30]研究发现缺少GA 的植株通过大量合成氨基酸参与渗透调节并促进代谢物向根系分配提升组织保水能力。GA 的代谢调控还与钾相关,姜仲禹等[18]研究发现缺钾条件下甘薯根系赤霉素含量显著增加。本研究川油36 叶片中GA 含量呈LK>NK>CK 的趋势,且LK 和CK 间差异达显著水平,表明干旱缺钾条件下油菜对GA 的代谢调节能力降低。IAA 是生长促进物质,在植物细胞分裂伸长以及光合同化物运输与积累等方面起着重要作用,干旱等逆境胁迫导致IAA 含量下降,增施钾肥可促进IAA 的合成[31]。本研究中,干旱胁迫导致油菜叶片IAA含量显著降低,与正常钾水平相比,缺钾条件下IAA含量显著降低,且干旱敏感品种川油36 的IAA 含量下降幅度最大,表明干旱胁迫下,IAA 合成减少导致油菜生长受到抑制,缺钾会进一步降低IAA激素的合成,影响油菜生长。CTK 具有促进细胞生长,延缓蛋白质和叶绿素降解及延迟衰老的作用,缺钾条件下细胞分裂素的含量会显著降低[32]。干旱胁迫下细胞分裂素含量显著降低,与正常钾肥相比,缺钾条件下两个品种CTK 含量均显著降低,表明干旱胁迫下,尤其因缺钾引起细胞分裂素含量降低,导致蛋白质和叶绿素降解加剧,叶片早衰。此外,油研57 细胞分裂素含量在各处理均显著高于川油36,表明抗旱品种油研57 具有较强的抗衰老能力。油菜素内酯是公认的第六大类植物激素,广泛参与蛋白质的合成和提高酶活性等生理过程,可增强植物对生物和非生物胁迫的抵抗能力[33]。本研究中,干旱胁迫导致油菜素内酯含量显著降低,且在缺钾条件下下降幅度更加明显。表明,干旱胁迫下缺钾会导致油菜素内酯的合成受阻进而影响各生理过程,降低油菜抗旱性。综上,干旱胁迫导致油菜ABA 含量显著增加,而促进生长类激素IAA、CTK 和BR 含量显著降低,缺钾条件下会激发ABA 的合成,并进一步限制IAA、CTK和BR 的合成。抗旱品种油研57在干旱条件下保持了较高的IAA、CTK、BR,在激素水平上保持较强的调控能力。
3.2 干旱缺钾降低油菜叶片光合作用能力
前人的研究表明,干旱导致作物光合作用降低,充足的钾肥供应可促进作物在干旱胁迫下净光合速率的提高[34,35]。本研究中,干旱胁迫导致油菜净光合速率和气孔导度均显著降低。与NK 处理相比,两个品种油菜在LK 处理下净光合速率和气孔导度均大幅降低,表明充足的钾肥供应可减少干旱胁迫对油菜光合作用的影响。导致光合作用降低的因子分为气孔限制和非气孔限制两方面因素,非气孔限制包括叶绿体结构破坏、叶绿素含量降低、光系统损伤、RuBP 羧化酶等光合酶活性降低以及活性氧对代谢功能的破坏等[36]。本试验中,尽管气孔导度在干旱缺钾条件下急剧下降,然而,叶片胞间CO2浓度在各处理间变化较小,表明净光合速率的降低并非由气孔因素引起,而是由非气孔限制所致。干旱胁迫会导致活性氧系统(ROS)在植物组织中大量积累,造成膜脂过氧化,膜脂过氧化产物MDA 含量增加,导致叶片光合能力降低[37,38],缺钾条件下,光合CO2的固定严重下降,过量的光合电子向O2传递刺激ROS 的产生,加剧细胞膜损伤和叶绿素降解,造成光合速率显著降低[4,39,40]。本研究中,干旱敏感品种川油36 在干旱胁迫下叶片MDA 含量显著增加,且在LK 处理下显著高于NK 处理,与之相反的是,川油36 叶片叶绿素含量在LK 处理下显著低于NK 处理,表明干旱胁迫下缺钾会加剧叶片膜脂过氧化和叶绿素降解,导致油菜光合作用显著降低。RuBP 羧化酶是光合作用C3 途径关键酶,干旱胁迫下RuBP 羧化酶活性显著降低,钾肥施用可降低干旱对RuBP 羧化酶活性的影响[41]。与前人的研究相似,本研究中干旱胁迫下RuBP 羧化酶活性显著降低,且油研57 RuBP羧化酶活性在NK处理下显著高于LK 处理,表明干旱缺钾条件下油菜RuBP 羧化酶活性降低是限制油菜光合作用的原因之一。油菜作为典型的C3 植物,在叶片和角果中检测到C4 途径关键酶PEPC[42,43]。在干旱胁迫下RuBP 羧化酶活性降低,PEPC 酶活性显著增加,并可部分替代RuBP 羧化酶功能[44,45]。C3 作物C4 化改造是提高作物光合作用的重要途径之一,干旱胁迫下通过PEPC 过表达可增强水稻光系统的热耗散能力,从而提高耐强光能力[46]。本研究发现,与CK 相比,NK处理下两个品种PEPC 酶活性增加。与NK 处理相比,LK处理下两个品种PEPC活性显著降低,表明干旱胁迫下缺钾会抑制PEPC 酶活性。干旱胁迫下,川油36 PEPC酶活性显著提高,在NK处理下显著高于LK 处理,然而RuBP 羧化酶活性在NK 处理下显著低于LK 处理,由此推测干旱胁迫下提高钾肥水平会激发川油36 的C4 途径,但该机理需进一步明确。
3.3 干旱缺钾抑制油菜叶片PSI和PSII活性
叶绿素荧光动力学参数是反映植物对光能的吸收、转化、传递、分配情况的灵敏探针,当发生胁迫时,PSII反应中心会造成损伤,使光合电子传递和PSII的光合作用活力受到抑制,光合受阻,光合速率下降[47]。Fv/Fm 是PSII 最大光化学量子产量,代表光合机构把吸收的光能用于光化学反应的最大效率。在非胁迫条件下,该参数的变化极小,常用该参数的下降来反应光抑制的程度。本试验中,干旱胁迫导致Fv/Fm 显著降低,且川油36 在LK 处理下的Fv/Fm显著低于NK处理,表明干旱导致油菜光抑制,且缺钾条件下光抑制的程度更高。Y(NPQ)反应的是通过热耗散途径将过剩的激发能无损伤地耗散掉,这是保护PSII 免受损伤的重要途径之一[48]。本试验中,干旱胁迫下Y(NPQ)均有不同程度提高,且在NK 处理下Y(NPQ)增加幅度更大,表明干旱胁迫下油菜通过增加热耗散将多余的激发能消耗掉以减少对叶片的损伤,且与缺钾条件相比,维持正常钾水平增强油菜热耗散能力。非调节性能量耗散量子产量Y(NO)反应既不能用于光化学反应,也不能通过天线耗散过剩的激发能[49]。由于低钾条件下,通过热耗散消耗多余激发能的能力减弱,多余的激发能无法通过热耗散全部耗散掉,从而有LK处理下Y(NO)显著高于NK 处理。在干旱胁迫下,植物PSII 的活性降低,激发能上升并引发能量过剩,导致自由基在体内大量积累,造成膜脂过氧化作用加剧[37,38]。许多研究表明,提高植物钾营养水平可极大的减少NAD(P)H 氧化酶的活性并维持光合电子传递,从而降低激发能过剩对组织造成的伤害[4]。与NK 处理相比,LK 处理下油菜组织中钾含量显著降低,且干旱敏感品种川油36组织中钾含量显著低于油研57[23]。与之相反的是,LK 处理下川油36 叶片中MDA 含量在显著增加,且显著高于油研57。因此,推测干旱胁迫下缺钾会导致叶片热耗散能力减弱而不足以清除大量过剩的光能,导致PSII 活性下降并加剧叶片膜脂过氧化,最终造成油菜光合作用降低。
P700最大氧化状态可以反映有活性的PSI反应中心的含量,是衡量PSI 是否受逆境胁迫损伤的重要指标[50]。干旱胁迫下,两个品种的暗下P700 的最大变化值(Pm)和光下P700 的最大变化值(Pm′)均显著降低,在缺钾条件下Pm 和Pm′的下降更明显,表明干旱胁迫导致PSI失活,且缺钾条件下PSI失活会更加严重。干旱胁迫下,PSI 供体侧限制引起的非光化学量子产量Y(ND)增加,且LK 处理下增加的幅度低于NK,与之相反的是LK 处理下PSI 受体侧限制引起的非光化学量子产量(Y(NA))显著高于NK 处理。PSI 受体侧过度还原是羟基自由基产生的先决条件[51],Y(NA)表示PSI 受体侧处于还原态的电子载体难以被饱和脉冲光氧化的比例,可以作为PSI光抑制的指标[52]。以上结果表明,干旱缺钾条件下PSI受体侧过度还原,导致油菜PSI受到光抑制。
综上,通过内源激素调节生长在植物响应逆境胁迫中发挥着重要作用[11,26],干旱胁迫下,缺钾会影响油菜内源激素水平,导致生长促进类激素IAA、CTK 和BR 含量降低,胁迫应激激素ABA 含量增加[27],从而抑制油菜生长;同时,干旱缺钾引起膜脂过氧化、叶绿素降解、RuBP 羧化酶活性降低、PSI 和PSII 抑制等非气孔限制因素增加[36],导致生长物质来源的光合作用降低[12],从而限制油菜生长。
4 结论
干旱胁迫下,缺钾会激发ABA 的积累,抑制IAA、CTK 和BR 的合成,抑制油菜生长。干旱缺钾条件下,RuBP 羧化酶和PEPC 酶活性显著降低,同时PSI受体侧过度还原抑制PSI活性,且PSII调节性能量耗散减弱,非调节性能量耗散量子产量增加,造成PSII 活性下降,并加剧叶片膜脂过氧化和叶绿素降解,导致油菜光合作用降低并限制油菜生长。

