三七总皂苷对糖尿病肾病小鼠TGF-β1及自噬相关蛋白Bax、Bcl-2、LC3I/LC3II表达的影响
徐莉莉,戴世杰,项晓骏
(1舟山医院·浙江 舟山 316021;2杭州医学院·浙江 杭州 310059;3浙江省中医院·浙江 杭州 310000)
三七总皂苷(panax notoginseng saponins,PNS)为传统中药材三七的活性成分,具有抗炎、抗氧化等多种药理作用,已被广泛应用于心血管系统、消化系统、泌尿系统、神经系统等疾病的治疗[1]。研究表明,PNS可改善血脂代谢、肾功能及微循环障碍等,且对肾损伤具有良好的保护作用[2]。动物实验证实,PNS可有效地改善糖尿病肾病(DN)模型小鼠的肾损伤,可通过抗炎症反应、抗氧化应激、降低肾组织TGF-β1、Col-Ⅳ、AGEs的表达等途径实现[3-4]。此外,PNS可调控肾组织细胞凋亡与自噬改善顺铂诱导的大鼠肾损伤[5]。但是,PNS防治DN所致肾损伤的作用机制目前尚未阐明。基于此,本研究通过db/db小鼠建立DN模型,进一步探讨PNS对DN肾损伤的防治作用及机制,以期为PNS的临床应用提供实验参考。
1 材料
1.1 实验动物 48只5周龄db/db小鼠,雄性,体质量(30±2)g,12只同周龄db/m小鼠,雄性,体质量(23±2)g,从上海普尔-必凯实验动物有限公司购买,饲养在浙江中医药大学动物实验中心,动物生产许可证号:SCXK(沪)2018-0006,饲养许可证号:SYXK(浙)2018-0012。适应性喂养1周,自由饮食饮水。
1.2 实验药物和试剂 PNS:上海源叶生物科技有限公司,货号:B21102;厄贝沙坦:上海源叶生物科技有限公司,货号:B34627。BCA蛋白定量试剂盒:Solarbio;Masson染色试剂盒:武汉谷歌生物科技有限公司;丙二醛(MDA)、过氧化氢酶(CAT)ELISA试剂盒:上海梵态科技有限公司;Tunel凋亡试剂盒:碧云天;LC3B、Bax、Bcl-2、TGF-β1、GAPDH抗体:Abcam。
1.3 实验仪器 AU640全自动生化分析仪:Olympus;DM3000正置荧光显微镜:Leica;Nikon DS-U3成像系统:日本尼康。
2 实验方法
2.1 模型制备与分组给药 选取48只5周龄雄性db/db小鼠,适应性喂养1周,1周后小鼠尾静脉采血测定空腹血糖,空腹血糖值大于11.1 mmol/L[6]为造模成功。小鼠随机分为模型组、PNS低、高剂量组、阳性对照组4组,每组12 只,另取12只同周龄db/m雄性小鼠设为正常组。阳性对照组给予16 mg/(kg·d)厄贝沙坦灌胃,PNS低、高剂量组给予15、30 mg/(kg·d)PNS灌胃,模型组和正常组予等体积生理盐水,均于每日上午8:30灌胃给药,给药剂量根据小鼠体质量的变化调整,持续8周。
2.2 观察指标
2.2.1 血糖监测 每周监测小鼠体质量及血糖波动情况,测定空腹血糖前禁食8 h后取尾静脉血,血糖浓度用血糖试纸检测。
2.2.2 生化指标检测 给药8周结束前1 天,收集代谢笼中小鼠24 h尿液标本,应用全自动生化检测仪检测尿肌酐(UCr)、尿微量白蛋白(mAlb)水平变化。2%戊巴比妥钠麻醉,腹主动脉采血,全自动生化检测仪测定血尿素氮(BUN)水平。
2.2.3 氧化应激指标检测 对小鼠进行二氧化碳麻醉致死,取肾组织研碎后离心,取上清液,参照ELISA相关试剂盒说明,检测肾脏组织MDA水平和CAT活性。
2.2.4 HE染色观察肾组织病理变化 取小鼠肾脏组织,剪成1.0 cm×1.0 cm×0.5 cm大小的块状,置于4% PFA中固定、脱水、包埋、切片。肾组织切片烘烤至水烤干、蜡烤化后,行HE染色。二甲苯脱蜡,梯度乙醇水洗,苏木素染核5 min,盐酸乙醇分化30 s,自来水浸泡15 min,伊红复染2 min,水洗,梯度乙醇常规脱水,二甲苯透明,中性树胶封片。图像分别在显微镜20×10、20×20倍镜下拍照采集,分析小鼠肾脏组织病理改变情况。同时行HE半定量分析,0~4 分,依据炎症细胞浸润面积与上皮细胞肿胀、脱落进行评价,分值越高则说明炎症细胞浸润越明显,上皮细胞肿胀、脱落越多。
2.2.5 Masson染色观察肾脏纤维化程度 按照Masson染色试剂盒说明操作,将包埋的肾组织常规切片去石蜡并放入水中,苏木素染核5 min,1%盐酸乙醇分化,流水洗涤以恢复为蓝色;然后丽春红染色5~10 min,蒸馏水漂洗。磷钼酸处理3~5 min,苯胺蓝液复染5 min,1%冰醋酸分化,常规脱水,透明,封片。图像在显微镜20×20倍下镜检,拍照采集,分析肾脏纤维化程度。
2.2.6 Tunel染色观察肾脏组织细胞凋亡 按照Tunel凋亡试剂盒说明操作,包埋肾组织常规切片脱蜡入水,4% PFA固定,1% Triton-100通透,PBS洗涤,3%H2O2-甲醇溶液灭活酶,PBS洗涤,加入100 uL TdT酶反应液,在37 ℃黑暗潮湿的环境中保持1 h,在PBS中洗涤,加100 uL Streptavadin-HRP,在37 ℃的黑暗潮湿环境中放置30 min,PBS洗涤,DAB方法显色,染色后用蒸馏水停止显色,然后苏木精复染10 min,按常规方法脱水,透明并固定载玻片。图像在显微镜20×20倍下镜检,拍照采集,分析肾脏组织细胞凋亡程度。
2.2.7 Western bolt检测肾组织中TGF-β1、Bcl-2、Bax、LC3 I、LC3II蛋白表达水平 取肾组织样品,总蛋白通过裂解15 min提取。BCA试剂盒测定蛋白浓度。SDS-PAGE电泳分离,转到PVDF膜,并被封闭溶液密封,用TBST冲洗3 次,加入一抗稀释液(TGF-β1、Bcl-2、Bax、LC3 I、LC3II),将膜在4 ℃摇晃过夜,然后在室温下二抗被添加其中孵育1~2 h,TBST洗膜3 次。β-actin做内参,ECL化学发光试剂盒处理,并使用Chemi Capture软件捕获处理后的图像。
2.3 统计学处理 数据分析采用SPSS 16.0统计软件,采用SNK分析进行组间比较,采用非参数检验的Kruskal-WallisH检验方差不齐者,用One-way-ANOAY单因素方差分析计量资料。所有数据以均值±标准差表示,P<0.05为差异有统计学意义。
3 结果
3.1 各组小鼠体质量及空腹血糖水平比较 见表1。

表1 各组小鼠体质量及空腹血糖水平比较
3.2 各组小鼠UCr、mAlb、BUN水平比较 见表2。

表2 各组小鼠UCr、mAlb、BUN水平比较
3.3 各组小鼠肾组织CAT活性、MDA含量比较 见表3。

表3 各组小鼠肾脏组织CAT活性、MDA水平比较
3.4 各组小鼠肾组织病理变化观察 HE染色显示:正常组肾脏结构完整而清晰,且没有炎性细胞浸润。模型组肾小球体积扩大,大量炎性细胞浸润。PNS低剂量组炎性细胞浸润无明显改善,HE半定量评分没有明显差异(P<0.01)。阳性对照组和高剂量PNS组肾组织炎性细胞浸润明显减少,HE半定量评分显著降低(P<0.01),病理损伤改善明显。见图1,表4。
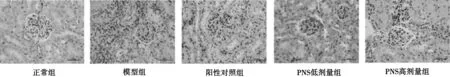
图1 各组小鼠肾组织病理变化(HE,× 400)
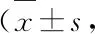
表4 各组小鼠HE半定量评分比较分)
3.5 各组小鼠肾脏纤维化程度比较 Masson染色显示:正常组肾小球、肾间质未见纤维组织增生;模型组可见大量肾间质纤维化;PNS低剂量组肾间质纤维化程度仍十分明显,无显著改善;PNS高剂量组、阳性对照组肾组织纤维化程度较模型组明显改善。见图2。
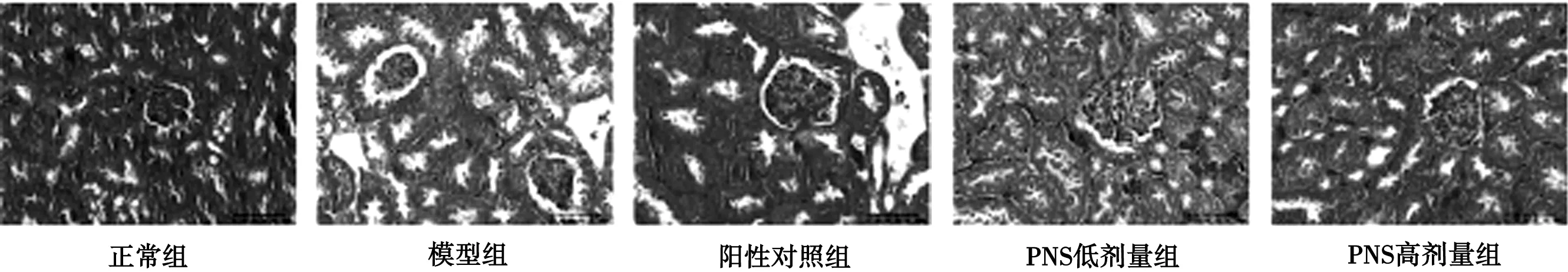
图2 各组小鼠肾纤维化程度观察(Masson,×400)
3.6 各组小鼠肾组织细胞凋亡的比较 Tunel染色显示:正常组肾组织未出现Tunel染色阳性细胞,而模型组出现大量具有凋亡特征的阳性细胞,且凋亡率升高明显(P<0.01)。PNS高剂量组、阳性对照组肾组织凋亡细胞明显减少,Tunel阳性细胞与模型组相比明显降低(P<0.01),PNS低剂量组着色较深,仍存在大量凋亡细胞。见图3,表5。
图3 各组小鼠肾组织细胞凋亡观察(Tunel,×400)
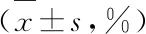
表5 各组小鼠肾组织细胞凋亡率比较
3.7 各组小鼠肾组织TGF-β1、Bcl-2、Bax、LC3I、LC3II蛋白表达比较 与正常组相比,模型组Bcl-2蛋白表达水平明显降低(P<0.01),模型组肾组织TGF-β1、Bax、LC3I/LC3II蛋白表达水平明显升高(P<0.01);PNS低剂量组各蛋白表达水平与模型组比较没有明显差异(P>0.05),而Bcl-2蛋白表达水平升高明显(P<0.01),PNS高剂量组与阳性对照组肾组织TGF-β1、Bax、LC3I/LC3II蛋白表达水平明显降低(P<0.05或P<0.01)。见图4。

注:与正常组比较,▲P<0.05,▲▲P<0.01;与模型组比较,*P<0.05,**P<0.01
4 讨论
三七味甘、微苦,性温,可消肿定痛、散瘀止血,其活性成分PNS已被证实,在细胞水平具有抗纤维化作用,可有效延缓肾小管-间质纤维化进程[5]。但关于PNS防治DN所致肾损伤仍缺乏相关证据,故探讨PNS对DN的改善作用及其作用机制具有重要的临床意义。
高血糖是DN发生发展的重要基础,研究表明,机体长期处于高血糖状态下可损伤肾小球内皮细胞,影响细胞正常生理功能[7]。此外,持续的高血糖亦可诱导产生过量AGEs,于肾小球聚集,进而影响基底膜正常结构,破坏肾小球滤过屏障,增加毛细血管通透性,造成蛋白尿[8]。本研究通过db/db小鼠制备DN模型,监测各组小鼠血糖浓度与体质量,结果显示DN小鼠空腹血糖浓度、体质量升高的明显,而PNS可降低小鼠体质量和空腹血糖浓度,说明PNS可有效改善血糖代谢。HE、Masson染色结果显示DN小鼠肾间质纤维化程度严重及肾脏组织病理损伤明显,提示本研究成功制备DN小鼠模型,与Xu, et al.[9]研究结果相符,高剂量PNS不仅使肾脏组织病理损伤得到有效改善,而且使肾间质纤维化程度得到改善,更使炎性细胞浸润显著减少,进一步证实PNS对DN小鼠肾损伤及肾间质纤维化的改善作用明显。
DN早期的主要特点为肾小球肥大,滤过率减少,随后会出现组织纤维化,微量白蛋白尿等。蛋白尿的重吸收需要另外的能量,可能使肾小管细胞缺氧,进而造成损伤[10]。mAlb是评价肾小球损伤的指标之一,早期肾功能损伤,可引起肾小球电荷屏障受损、微循环障碍等,均可增加mAlb的排泄量[11]。BUN和UCr与肾脏排泄能力有关,可反映肾脏功能损害程度。本研究中高剂量PNS可降低mAlb、BUN水平(P<0.05,P<0.01),升高UCr水平(P<0.05),提示PNS可改善肾小球滤过屏障,减轻肾功能损害程度。
氧化应激是诱导DN发生的主要原因之一,高血糖可诱导产生过量ROS,致氧化/抗氧化系统失衡,过多的ROS可激活蛋白激酶C、多元醇通路等,致肾小球ECM沉积,形成纤维化瘢痕,损害肾组织,促进DN病情进展[12]。CAT活力的高低与细胞抗氧化能力的强弱有关,MDA堆积可产生细胞毒性,加快纤维化进程[13]。高剂量PNS可显著升高肾脏组织CAT活性(P<0.05),降低MDA水平(P<0.01),提示PNS可通过抑制氧化反应改善肾组织纤维化程度,减轻肾损伤。
TGF-β1是重要的促纤维化因子,研究发现,长期高血糖状态下可以激活TGF-β,诱导TGF-β基因转录,增加其表达量;TGF-β1可调节ECM的合成与降解,对肾小管上皮细胞转化为成纤维细胞也具有调节作用,是DN肾病变的关键致病因子,调控多种信号通路,参与DN进展中的多个环节,包括诱导足细胞凋亡、破坏滤过屏障等,引起肾小球硬化,肾功能衰竭[14-15]。本研究中,DN小鼠TGF-β1蛋白表达水平增加明显(P<0.01),与Zheng, et al.[16]研究结果一致,而高剂量PNS显著降低TGF-β1蛋白表达水平(P<0.05),证实PNS可下调TGF-β1蛋白表达发挥抗纤维化作用。此外,细胞凋亡程度与肾功能恶化程度呈正相关,Bax为促凋亡基因,而Bcl-2可抑制细胞凋亡,二者在DN肾组织细胞凋亡过程中具有重要的作用[17]。自噬在DN发生发展中起着防御作用,LC3是自噬体标记蛋白,LC3I与LC3-II对自噬体膜延长、膜融合及运载有着重要作用,可以使体内ROS保持平衡[18]。本研究结果显示,高剂量PNS显著降低Bax、LC3I/LC3II蛋白表达水平(P<0.01)和Tunel阳性细胞凋亡率,升高Bcl-2蛋白表达(P<0.01),表明PNS能上调Bcl-2蛋白表达和下调Bax蛋白表达,从而使细胞凋亡被抑制,同时增强自噬,LC3-I向LC3-II转换,发挥减轻肾脏损伤的作用。
综上所述,PNS可有效减轻DN小鼠肾损伤,可通过抑制细胞凋亡和氧化应激,下调TGF-β1、LC3I/LC3II蛋白表达,实现抗肾纤维化。

