冷圈套切除结直肠10~15 mm息肉的疗效和安全性分析:一项单中心前瞻性观察性研究
谢 惠, 冯秀棠,2, 李扬杰,2, 马贤纵, 王海红, 王风玉, 何玉琦,2, 金 鹏, 盛剑秋, 王 昕
1.中国人民解放军总医院第七医学中心消化内科,北京 100700; 2.南方医科大学第二临床医学院
结直肠癌是最常见的恶性肿瘤之一,其发病率呈现逐年上升趋势[1]。早期预防、早期发现、早期治疗是减轻结直肠癌疾病负担的关键策略。癌主要通过“腺瘤-癌”途径演变[2],结直肠癌筛查并切除腺瘤性息肉可以有效预防结直肠癌并降低相关死亡率[3-6]。随着消化内镜技术的发展,内镜下息肉切除术式及操作器械更新换代速度快、层出不穷,冷圈套息肉切除术(cold snare polypectomy,CSP)因无需电凝、耗时短、完整切除率高等优势受到内镜医师的青睐,被广泛用于治疗结直肠微小息肉(5 mm以下)及小息肉(5~9 mm)[7]。最近欧洲胃肠内窥镜学会(European Society of Gastrointestinal Endoscopy,ESGE)临床指南建议及多项相关的研究证实,CSP可作为<10 mm结直肠息肉的标准术式,具有耗时短、完全切除率高、并发症发生率低等优点[8-9]。近期,有研究报道显示,CSP可作为切除直径较大结直肠息肉(>10 mm)的一种安全有效的方法[8,10]。但CSP治疗结直肠较大息肉的安全性和有效性的资料有限,有待进一步研究。本研究通过观察纳入CSP切除的结直肠较大息肉(10~15 mm)患者,并与已发表的文献进行对比,旨在探讨CSP切除10 mm以上直径息肉的疗效及安全性。
1 资料与方法
1.1 一般资料研究设计为前瞻性观察性研究,研究对象为2018年1月至2020年1月在中国人民解放军总医院第七医学中心接受结肠镜检查并发现至少一枚10~15 mm结直肠息肉的患者。
1.2 纳入及排除标准纳入标准:(1)可完成结肠镜检查并切除息肉的患者;(2)息肉直径为10~15 mm;(3)未使用抗凝和/或抗血小板药物或至少停药5 d以上;(4)签署知情同意书。排除标准包括:(1)息肉直径<10 mm或>15 mm;(2)内镜观察考虑癌变的息肉;(3)有蒂息肉。结肠镜检查中发现合格大小(10~15 mm)息肉的患者纳入研究。本研究得到我院伦理委员会的批准(No.2018-070)。所有患者均提供知情同意书。
1.3 方法良好的肠道准备后,使用标准结肠镜(CF-HQ290I,CF-Q260AI,Olympus CO,Tokyo,Japan)进行检查,所有病例均使用圈套器切除息肉,不贴电极片,不通电。手术由经验丰富的内镜医师完成(至少完成了1 000例内镜下息肉切除术)。通过白光(white light,WL)和窄带成像(narrowband imaging,NBI)判断息肉的病理类型,使用圈套器的尖端(2.5 mm)测量息肉直径。所有病变的形态分型均使用巴黎分型定义[11]。
准确判断息肉的形态、边界和大小后,将息肉置于监视器6点方向,不进行黏膜下注射,释放圈套器,息肉位于圈套器中心,在保证息肉边缘有足够多正常黏膜的情况下,以息肉中心为原点,缓慢收紧圈套器,同时缓慢吸引肠腔内空气,内镜手柄大旋钮缓慢上抬,直至圈套器完全收紧。用力收紧手柄,将息肉机械切割。根据息肉切除时间(容易<30 s、中等难度30~60 s、困难>60 s)对手术难度进行分级,切除时间定义为圈套器出内窥镜活检孔道至息肉完全切除。息肉切除后以生理盐水冲洗切除部位边缘黏膜,如明确有病变残留,再次以圈套器或活检钳辅助切除残留息肉。息肉切除后持续出血超过60 s或出血量较大,可采用钛夹对出血处进行即时封闭。通过仔细观察切缘证实息肉完全切除后,以活检钳对切缘进行四象限活检。通过组织病理学检查确定切除边缘是否有腺瘤性息肉残留来计算完全切除率。病理结果回报息肉不完全切除的患者,建议3~6个月后复查结肠镜。
1.4 观察指标主要观察指标为CSP的完全切除率。次要观察指标为不良事件发生率,包括迟发性出血(需要进行结肠镜下止血或住院治疗)、穿孔和术后即时出血(活动性出血持续时间≥60 s,需要内镜止血夹闭的明显出血)等。自CSP操作开始观察可能发生的不良事件,常规观察创面30 s左右判断是否持续出血,如出血可在短时间内停止,不进行止血处理,如创面持续出血,则采用钛夹夹闭止血。建议患者术后卧床休息,观察是否出现腹痛、便血、黑便等情况,并由内镜医师判断病情,必要时可行急诊结肠镜检查。所有数据均使用电子文档记录,内容包括性别、年龄、息肉位置、息肉大小、操作时间、辅助措施等。
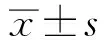
2 结果
2.1 患者及息肉特征如表1所示,研究期间内有108例患者共计119枚10~15 mm息肉采用冷切除治疗,1例患者1枚10 mm息肉切除后丢失,未送病理而排除。108例患者中男69例(63.9%),女39例(36.1%),年龄(58.3±10.0)岁。手术切除时间(44.5±25.2)s。息肉直径大小(11.1±1.6)mm。78枚(65.5%)息肉病理组织学诊断为管状腺瘤,9枚(7.6%)为绒毛管状腺瘤,28枚(23.5%)为无蒂锯齿状病变,4枚(3.4%)为高级别上皮内瘤变。

表1 108例患者与119枚息肉特征Tab 1 Characteristics of 108 patients with 119 polyps
2.2 CSP的疗效及安全性分析如表2所示,113枚息肉(95.0%)经术后多点活检证实为完全切除,6枚(5.0%)为不完全切除。在不完全切除的息肉中,无蒂锯齿状病变4枚,管状腺瘤1枚,高级别上皮内瘤变1枚(创面边缘活检可见腺瘤成分,垂直切缘病理诊断为阴性)。10枚(8.4%)息肉切除后发生即时出血,多为少量渗血,预防性使用钛夹夹闭;未观察到迟发性出血、穿孔、腹痛等不良事件。所有不完全切除病例及高级别上皮内瘤变病例在随访中均未见复发。

表2 CSP切除息肉有效性及安全性分析Tab 2 Efficacy and safety analysis of CSP resecting polyps
3 讨论
结直肠息肉的切除方式包括:内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)、内镜下黏膜切除术(endoscopic mucosal resection,EMR)、CSP、活检钳息肉钳除术、氩离子凝固术等。ESD主要用于治疗直径>20 mm的大息肉;EMR通常用于较大息肉(10~19 mm)的切除;热圈套息肉切除术(hot snare polypectomy,HSP)和CSP被广泛用于治疗微小息肉(≤5 mm)或小息肉(6~9 mm)[12]。虽然,美国多学会工作组(US Multi-Society Task Force,USMSTF)发布的最新指南建议采用HSP或CSP(有或无黏膜下注射)切除10~15 mm的无蒂病变,但证据质量等级较低,需要深入研究[12]。本研究通过前瞻性观察性研究,结果发现CSP切除结直肠较大息肉(10~15 mm)的完全切除率为95.0%,除少部分病例出现即时出血(8.4%;钛夹夹闭成功止血),未观察到其他CSP相关不良事件,提示CSP治疗10~15 mm结直肠息肉具有良好的安全性。
CSP的优势在于通过对息肉及其周围的正常黏膜使用圈套器进行套取收紧并直接勒除,避免了与电凝相关的并发症并保证了标本的完整性,理论上有较好的疗效和安全性。而HSP则在圈套器套取息肉后,通过高频电流对圈套的组织进行灼除,一定程度上会影响内镜医师对病变切除部位边缘组织学评价;此外,如未进行黏膜下注射,HSP不能圈套足够的正常黏膜,导致不完全切除率较CSP高[13]。多项研究报道HSP对结直肠较大息肉的完全切除率为73%~80.9%[14-15],Horiuchi等[14]对直径10 mm以上息肉进行了研究,HSP对直径10~14 mm息肉的完全切除率达到90%(27/30)。内镜下切除10~15 mm结直肠息肉,我们发现CSP的完全切除率与报道的HSP相仿,术后不良事件发生率更低,因此,CSP也可以是切除直径10 mm以上息肉的一种选择。
出血是结直肠息肉切除术后最常见的并发症,其发生率为0.3%~10.2%[16]。轻微的自限性黏膜出血在CSP中比较常见,可能与机械切割有关。既往研究报道,>10 mm的息肉在CSP治疗后出血率<4.5%[17],HSP的出血率为7.2%[18]。已有研究证实,息肉直径≥10 mm是治疗后出血的危险因素[19-20]。Gutta等[21]发现息肉的直径每增加1 mm,息肉热切除后的出血风险就增加13%,这可能会让内镜医师担心HSP治疗大息肉的术中或术后出血风险,但CSP却未见明显出血风险的增加[22]。本研究中,CSP的即时出血率为8.4%,未见迟发性出血,且所有即时性出血均可在术中采用钛夹夹闭有效止血。此外,本研究中的所有患者在接受结肠镜检查时均未使用或已停用抗凝和/或抗血小板药物,术前凝血功能检查均无明显异常。有研究也报道,即使是应用了抗凝和/或抗血小板药物,CSP也是安全的[10,23]。因此,结合本研究的结果和既往研究结果,CSP切除结直肠较大息肉具有较好的安全性。
我们中心近期的一项大型结直肠癌筛查随机对照研究及数据总结显示,5~15 mm结直肠息肉高级别或癌变的比例为4.2%(24/578)[24],并且癌变的风险随息肉直径的增加而提升。因此,对于10 mm直径以上息肉进行冷切除,一定要对病变进行充分评估。最好采用高清内镜结合NBI及色素内镜进行观察,提高癌变病变的检出率。对于高度可疑为高级别或癌的病变不建议进行冷切除治疗,标准的EMR或ESD仍是治疗首选。CSP切除结直肠大息肉(10 mm以上),需要很好的病理学评估。就垂直切缘而言,目前研究显示冷切除10 mm以下息肉多数病例能获得完整的黏膜肌层[25],而对于10 mm以上息肉垂直切缘的研究较少。文献和我们小样本研究显示息肉直径的增加可能是黏膜肌层不完全切除的危险因素[25]。因此,为了更好地进行切缘判断,冷切除10 mm左右直径的息肉可以进行切除标本固定,通过病理判断切缘。充分的病理学评估可以为息肉的治愈性切除提供依据。
本研究的局限性在于,这是一项单中心前瞻性观察性研究,未与HSP和EMR等传统方法进行对比,可能存在一定的信息偏倚。国外已经陆续开展将CSP应用至直径>10 mm结直肠息肉的切除研究,且完全切除率、不良事件发生率、残留率均取得较为理想的效果[8,17,26-27];而我国相关研究较少,CSP的应用和普及受到一定的限制。因此,今后还需要开展大样本量、多中心的前瞻性随机对照试验,为结直肠大息肉的CSP切除提供更多证据支持。冷切除10 mm以上息肉是否能保证大多数病例获得足够的黏膜肌层,保证病变垂直切缘阴性,还需要大样本前瞻性研究进一步加以明确。
总之,冷切除确实给内镜医师息肉治疗带来了很多的便利,手术时间短、安全性和完全切除率高,并发症发生率低,患者负担小,恢复快。相信随着越来越多的研究结果发表,冷切除的应用指征会得到不断的拓展,冷切除病例的选择和术后标本的处理会越来越规范。

