冠状动脉旋磨术在慢性完全闭塞病变介入治疗中的疗效
李文铮 吴铮 柳景华 郑斌 吕昀 刘佟
冠状动脉旋磨术是冠状动脉介入治疗中一项成熟的技术,至今已用于临床30余年。早期冠状动脉旋磨术的主要目的是消蚀斑块,由于没有药物洗脱支架,再狭窄率很高,限制了其在临床上的使用。近些年随着药物洗脱支架时代的来临,冠状动脉旋磨术的主要目的已转变为开通病变,降低血管阻力,提高器械通过率和手术成功率[1]。随着技术和器械的进步,冠状动脉旋磨术也更多地应用于慢性完全闭塞(chronic total occlusion,CTO)病变。本研究比较了CTO病变和非CTO病变合并高阻力病变中冠状动脉旋磨术的疗效。
1 对象与方法
1.1 研究对象
前瞻性注册登记首都医科大学附属北京安贞医院心内科2018年1月至2021年3月行冠状动脉旋磨术的患者,并根据靶血管造影结果分为CTO病变组和非CTO病变组。CTO病变定义为心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级0级,闭塞时间≥3个月。入选标准为导丝通过病变后球囊无法通过病变或非顺应性球囊无法扩张病变。排除标准:(1)急性心肌梗死;(2)左心室射血分数<30%;(3)无保护左主干病变;(4)支架内再狭窄病变。
1.2 血运重建方法
术前所有患者均给予阿司匹林和氯吡格雷或替格瑞洛双联抗血小板治疗。冠状动脉介入治疗采用桡动脉或股动脉路径,使用7 F以上指引导管。旋磨仪使用Rotablator旋磨系统(波士顿科学,美国)。旋磨液使用12 500 IU普通肝素和2.5 mg硝酸甘油加入0.9%氯化钠溶液1000 ml,旋磨时由加压袋持续冲洗旋磨导管。旋磨初始转速和旋磨头直径由术者根据经验决定,15~30 s/次,旋磨头通过病变后至少旋磨3次。旋磨术后行球囊扩张和支架置入。
1.3 观察指标
手术相关指标包括旋磨头个数、旋磨头直径、旋磨头直径与靶血管直径比、冠状动脉旋磨术成功率、置入支架个数、冠状动脉旋磨术后和介入治疗术后靶血管管腔直径、靶血管狭窄程度以及TIMI血流分级Ⅲ级比例。手术成功定义为冠状动脉旋磨术后TIMI血流分级恢复Ⅲ级,且血管残余狭窄<30%。观察住院期间主要不良心脑血管事件,包括心原性死亡、心肌梗死、靶病变血运重建和脑血管意外。
1.4 统计学分析
所有数据使用SPSS 24.0统计软件进行处理。计量资料使用均值±标准差(±s)表示,组间比较使用t检验。计数资料以[例(%)]表示,组间比较使用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的基线资料比较
研究共入选冠状动脉旋磨患者137例,其中CTO病变组32例,非CTO病变组105例。CTO病变组患者年龄小于非CTO病变组[(59±10)岁比(63±10)岁,P=0.045],高脂血症患者比例更高(90.6%比71.4%,P=0.026)。两组患者其他基线资料比较,差异均无统计学意义(均P>0.05,表1)。
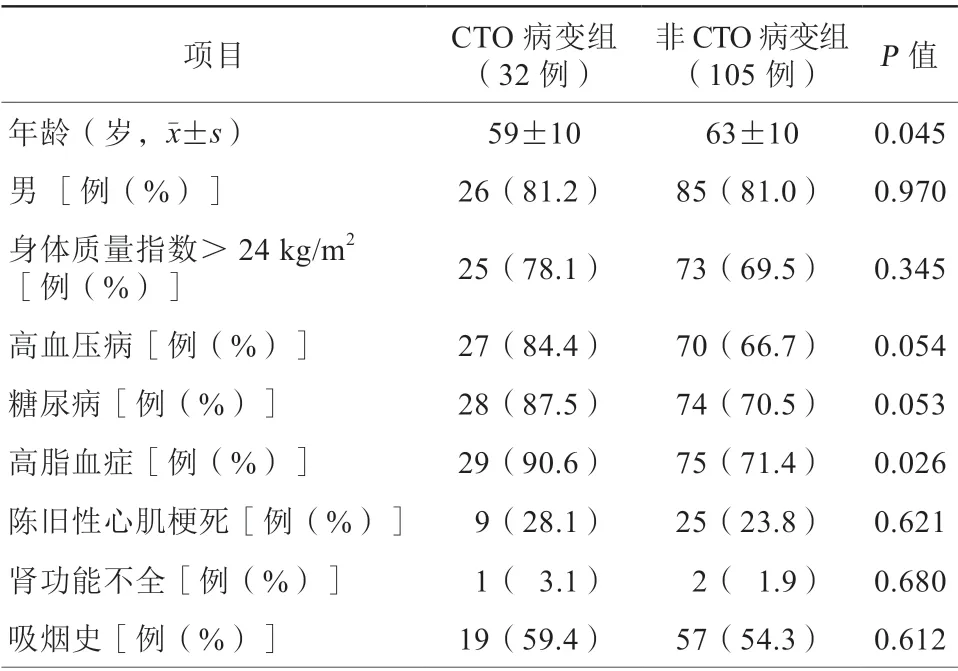
表1 两组患者基线资料比较
2.2 两组患者的介入资料比较(表2)
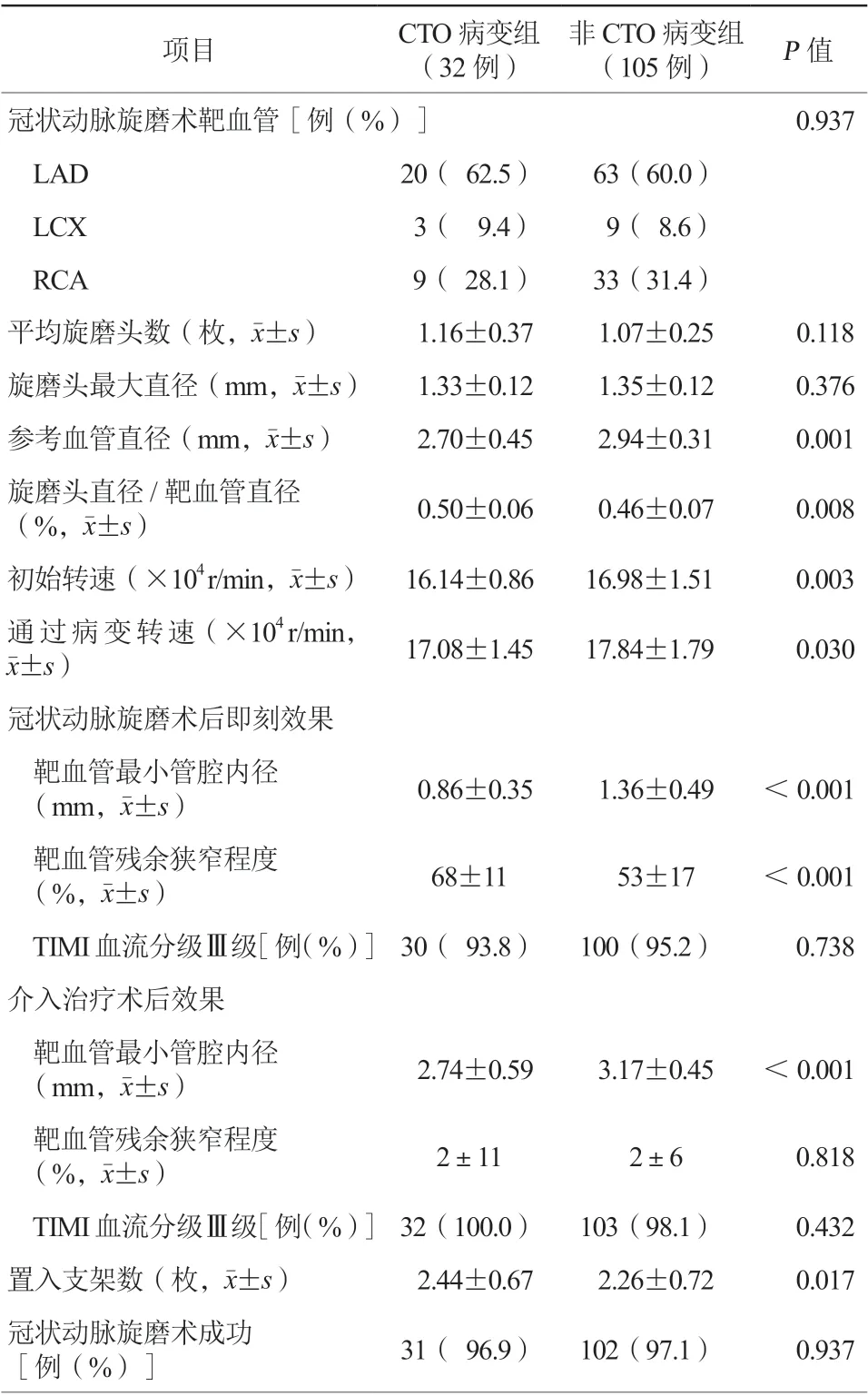
表2 两组患者介入资料比较
两组患者靶血管分布比较,差异无统计学意义(P=0.937),最常见的旋磨靶血管是左前降支,其次为右冠状动脉,左回旋支最少。CTO病变组共使用旋磨头37枚,非CTO病变组使用123枚,平均旋磨头数差异无统计学意义(P=0.118)。C TO 病变组参考血管直径显著小于非C TO 病变组[(2.70±0.45)mm比(2.94±0.31)mm,P=0.001],旋磨头直径与靶血管直径比大于非CTO病变组[(0.50±0.06)%比(0.46±0.07)%,P=0.008],旋磨初始转速和通过病变转速显著低于非CTO病变组[初始转速(16.14±0.86)×104r/min比(16.98±1.51)×104r/min,P=0.003;通过病变转速(17.08±1.45)×104r/min比(17.84±1.79)×104r/min,P=0.030]。
冠状动脉旋磨术后即刻效果:靶血管最小管腔内径和残余狭窄程度,非CTO病变组显著优于CTO病变组,差异均有统计学意义(均P<0.001),但TIMI血流分级Ⅲ级比例的差异无统计学意义(P=0.738)。介入治疗术后效果:非CTO病变组的靶血管最小管腔内径显著大于CTO病变组,差异有统计学意义(P<0.001),但残余狭窄程度和TIMI血流分级Ⅲ级比例的差异均无统计学意义(均P>0.05)。两组患者冠状动脉旋磨术成功率比较,差异无统计学意义(96.9%比97.1%,P=0.937)。
2.3 两组患者的并发症和术后不良事件比较
两组无穿孔等严重并发症发生,CTO病变组冠状动脉夹层和边支闭塞发生率略高于非CTO病变组,但差异均无统计学意义(夹层:3.1%比1.9%,P=0.680;边支闭塞:18.8%比14.3%,P=0.539)。
CTO病变组和非CTO病变组住院期间主要不良心脑血管事件的差异无统计学意义(6.2%比5.7%,P=0.910)。两组无心原性死亡和脑血管意外事件发生。CTO病变组发生2例(6.2%)心肌梗死,非CTO病变组为5例(4.8%),两组差异无统计学意义(P=0.738)。CTO病变组无靶病变血运重建,非CTO病变组1例因心肌梗死靶病变血运重建,两组差异无统计学意义(P=0.580)。
3 讨论
冠状动脉旋磨术的主要目的是通过前送高速旋转的旋磨头对血管内钙化斑块进行消蚀,从而便于进行球囊扩张和支架置入[2]。对严重钙化病变使用冠状动脉旋磨术还可改善支架置入术后的即刻管腔获得,减少残余狭窄[3]。合并严重钙化的高阻力病变是CTO病变介入治疗失败的预测因素之一[4-5],导丝失败和器械失败发生率均较高。
欧洲专家共识认为对于CTO病变,使用一个1.25 mm旋磨头即可获得更好的斑块修饰[1]。本研究两组旋磨头个数和直径比较差异均无统计学意义(均P>0.05)。CTO病变组患者中对于球囊无法通过的病变初始旋磨头直径为1.25 mm,若获得管腔不满意则更换为1.5 mm旋磨头。5例(15.6%)患者因参考血管直径≥3.0 mm,且球囊能通过但无法扩张,故初始旋磨头直径即为1.5 mm。
北美专家共识建议的旋磨头直径与靶血管直径比为0.4~0.6[2]。已有研究表明旋磨头直径与靶血管直径比>0.7不能提高手术成功率,最小管腔直径和残余狭窄方面也无进一步改善,但会增加术后肌酸激酶同工酶增高和靶病变血运重建发生率[6]。本研究中由于CTO病变组参考血管直径显著小于非CTO病变组,旋磨头直径与靶血管直径比显著高于非CTO病变组,两组直径比均在推荐范围内,在保证有效性的同时提高了冠状动脉旋磨术的安全性。
旋磨导丝送至远端真腔是进行冠状动脉旋磨术的基础。送入旋磨导丝的首选方法是使用锥形头端的微导管如Corsair(ASAHI日本)等进行导丝交换,但高阻力的钙化CTO病变通常组织更为致密,微导管难以通过病变到达远端。由于CTO导丝已通过病变,可将微导管通过旋转推送尽可能送至病变内部,撤出CTO导丝后沿该导丝形成的微孔道将旋磨导丝送至血管远段。在CTO病变段内旋磨导丝应以推送为主,并伴随适当旋转,通过闭塞段后可推送导丝,过多的旋转容易将旋磨导丝送入边支。
本研究中CTO病变组初始转速和通过病变转速显著低于非CTO病变组,这提示CTO病变中钙化组织相对松软,旋磨头更易通过病变。另一方面也可能与术者操作习惯有关。欧洲专家共识认为旋磨转速选择一般为13.5×104~18×104r/min[1]。研究表明过高的转速会增加血小板激活聚集和血栓形成的风险,过低的转速会增加旋磨头嵌顿的风险[7-8]。本研究中术中发生2例旋磨头嵌顿,每组各1例,术中无血栓事件发生。
支架时代旋磨的主要目的是斑块修饰,打断血管内的钙化环,利于术后球囊和支架通过[9-11]。本研究显示冠状动脉旋磨术后CTO病变组靶血管管腔内径显著小于且残余狭窄显著大于非CTO病变组,一方面是由于CTO病变狭窄更重,斑块负荷重,另一方面也提示这些CTO病变组织钙化程度低,内部富含弹性纤维组织,旋磨后弹性回缩更加显著。虽然冠状动脉旋磨术后CTO病变组即刻管腔获得效果不佳,但该组30例(93.8%)患者恢复TIMI血流分级Ⅲ级,且未影响后续球囊支架等器械通过,介入治疗术后效果方面两组靶血管残余狭窄程度和TIMI血流分级Ⅲ级比例差异无统计学意义。两组冠状动脉旋磨术成功率差异无统计学意义。既往有研究表明CTO病变旋磨成功率显著低于非CTO病变[12],但该研究入选患者最早为2009年,不能代表现今介入治疗水平。
本研究中冠状动脉旋磨术的术者不同,操作习惯和器械选择不同,可能带来偏差。CTO病变组入组样本量偏少,仍需更大样本规模的临床研究。虽然冠状动脉旋磨术后CTO病变即刻管腔获得更低,但该技术可用于CTO病变介入治疗。
利益冲突 所有作者均声明不存在利益冲突

