利用CRISPR/Cas9技术创制香糯型粳稻种质
邹德堂,韩政宏,郑洪亮,徐善斌,姜兴东,王敬国,刘化龙,杨洛淼,贾 琰,辛 威
(东北农业大学寒地粮食作物种质创新与生理生态教育部重点实验室,哈尔滨 150030)
水稻是世界范围内主要粮食作物之一,全世界约有一半以上人口以大米为主食[1]。随着生活水平提高,人们对稻米的需求不再局限于产量,消费者对稻米品质要求也越来越高。香味和直链淀粉含量是衡量稻米品质重要标准,改良稻米香味和直链淀粉含量已成为水稻育种重要目标之一[2]。传统育种方法主要是通过杂交、回交方式将目的基因转入受体材料,实现优良基因聚合[3]。但这种方法比较耗时,且存在基因之间连锁难题[4]。利用基因编辑技术对基因组进行定点修饰,可简捷、方便、高效实现水稻品种改良。CRISPR/Cas9 是近年兴起的一种新型基因编辑系统,由微生物适应性免疫系统发展而来[5],随着CRISPR/Cas9 系统逐步发展和完善,该技术已广泛应用于水稻遗传育种。
稻米香味主要由水稻第8 号染色体隐性基因Badh2 控制[6],该基因编码一种由503 个氨基酸组成的甜菜碱醛脱氢酶(BADH2)[7]。Buttery等研究表明,稻米中香味主要来源于2-乙酰-1-吡咯啉(2-AP),2-AP合成前体是4-氨基丁醛[8]。在非香型水稻品种中,甜菜碱醛脱氢酶催化4-氨基丁醛氧化,抑制2-AP 合成,稻米不具有香味。当Badh2 基因突变导致功能丧失后,4-氨基丁醛未被催化氧化,促进2-AP合成,使稻米产生香味。
淀粉是稻米胚乳中主要成分,主要包括直链淀粉和支链淀粉,其中直链淀粉含量(AC)是影响稻米蒸煮食味品质(ECQ)关键因素[9]。直链淀粉合成由颗粒结合淀粉合酶(GBSS 蛋白)催化,该酶由Waxy(Wx)基因编码[10],因此Wx基因座变异较大程度上决定AC 水平多样性,前人研究中发现多种Wx自然等位基因,包括Wxa、Wxb、Wxin、Wxlv、Wxmp、Wxmq、Wxop/hp、Wxmw/la和wx 等[10-12]。其中,等位基因wx是由Wx突变产生的一种糯性突变类型。非糯品种Wx 等位基因主要为Wxa和Wxb,在籼稻中,由Wxa控制高AC(25%~30%)合成,而粳稻以等位基因Wxb为主,AC 较低(15%~18%)。随着消费者需求多样化,通过调控水稻籽粒中AC 改良稻米EQC,已成为近年水稻育种新方向。
本研究以高产、高抗、优质非香非糯性粳稻品种唯农208 为研究材料,利用CRISPR/Cas9 技术同时敲除Badh2 和Wx,通过筛选得到无转基因成分且兼具香味和糯性的香糯型粳稻种质,推动新型粳稻种质选育进程。
1 材料与方法
1.1 材料
1.1.1 受体材料
本研究以高产、高抗、优质非香非糯性粳稻品种唯农208为试验材料。
1.1.2 载体
试验所用载体pYL-U3-gRNA、pYL-U6agRNA 和pYLCRISPR/Cas9Pubi-H 双元载体由华南农业大学刘耀光院士惠赠。
1.2 敲除靶点设计及载体构建
通 过NCBI(https://www.ncbi.nlm.nih.gov/)获 得Badh2(Os08g0424500)、Wx(Os06g0133000)基因序列,利用CRISPR-GE 在线网站[13](http://skl.scau.edu.cn/)“CRISPR Primer Designer”模块设计Badh2和Wx 基因靶序列,在Badh2 第7 外显子设计1 对靶点及接头引物,在Wx 第2 外显子设计1 对靶点及接头引物,两对接头引物分别为T1-F/R、T2-F/R(见表1)。并利用NCBI网站上BLAST程序进行筛选,未找到脱靶序列。
参照Ma 等方法构建Badh2-Wx 双基因敲除载体[14]。
1.3 质粒扩繁及阳性克隆筛选
将构建后载体通过热激法转入Mach1-T1 感受态大肠杆菌中,涂板培养并挑取单菌落作PCR 检测,选取阳性菌落摇菌后提取质粒,随后用AscxⅠ内切酶对质粒进行酶切检测,将酶切检测无误质粒通过热激法转入到EHA105农杆菌中。
1.4 T0代植株获得及突变类型分析
通过农杆菌介导法将CRISPR/Cas9表达载体转入粳稻品种唯农208愈伤组织,采用潮霉素筛选出阳性愈伤组织并分化成T0代植株。采用CTAB法提取T0代植株基因组DNA[15],以潮霉素基因特异性引物Hyg F/R作PCR扩增,检测阳性植株,并设计引物Badh2-seq-F/R 和Wx-seq-F/R(见表1),分别扩增Badh2 和Wx基因靶点及其附近序列,对所有转基因阳性植株作PCR 扩增,PCR 产物送至擎科生物技术有限公司(北京)测序,测序结果使用兼并序列解码(DSDecode)方法进行分析[16]。

表1 研究使用引物Table 1 Primers used in this study
1.5 T1代纯合突变及无T-DNA原件植株筛选
在T1代植株分蘖期,取叶片提取基因组DNA,利用Badh2-seq-F/R和Wx-seq-F/R引物PCR测序,筛选纯合突变植株,再利用Hyg-F和Hyg-R引物在纯合植株中筛选无T-DNA元件插入的植株。
1.6 T2代纯合无T-DNA元件株系获得
于成熟期收获T1代纯合突变且无T-DNA 元件植株种子,在大田环境下扩繁至T2代,调查农艺性状。利用SPSS 18.0软件分析数据。
1.7 香味测定
采用气相色谱-质谱联用技术,测定并分析水稻籽粒中2-乙酰-1-吡咯啉(2-AP)含量。利用SPSS 18.0软件分析数据。
1.8 直链淀粉含量测定
直链淀粉含量测定采用分光光度计分析法。利用SPSS 18.0软件分析数据。
2 结果与分析
2.1 水稻Badh2和Wx敲除靶点设计
本研究在Badh2 第7 外显子设计1 对gRNA 靶点接头引物,在Wx第2外显子处设计1对gRNA靶点接头引物,具体靶点信息见图1。
2.2 Badh2和Wx基因表达载体构建
利用“金门”克隆法将带有靶点gRNA 连接到Cas9 载体骨架上,构建后载体即为pYLCRISPR/Cas9-Badh2-Wx-gRNA载体(见图2)。
2.3 T0代转基因阳性苗获得
利用转入pYLCRISPR/Cas9-Badh2-Wx-RNA载体的农杆菌侵染粳稻品种唯农208愈伤组织。在T0代突变体植株成熟时,提取基因组DNA,运用载体特异性引物Hyg-F/R 进行PCR 检测,筛选阳性植株。结果表明,共获得转入pYLCRISPR/Cas9-Badh2-Wx-RNA载体阳性植株42株。
2.4 T0代突变体Badh2 和Wx 基因靶点突变类型分析
对已筛选阳性植株,利用引物Badh2-seq-F/R和Wx-seq-F/R进行PCR 扩增并测序分析,结果表明,42 株阳性植株中有34 株突变植株,其中Badh2 基因突变植株有17 株,Wx基因突变植株有23株,Badh2和Wx均突变植株有6株(见表2)。
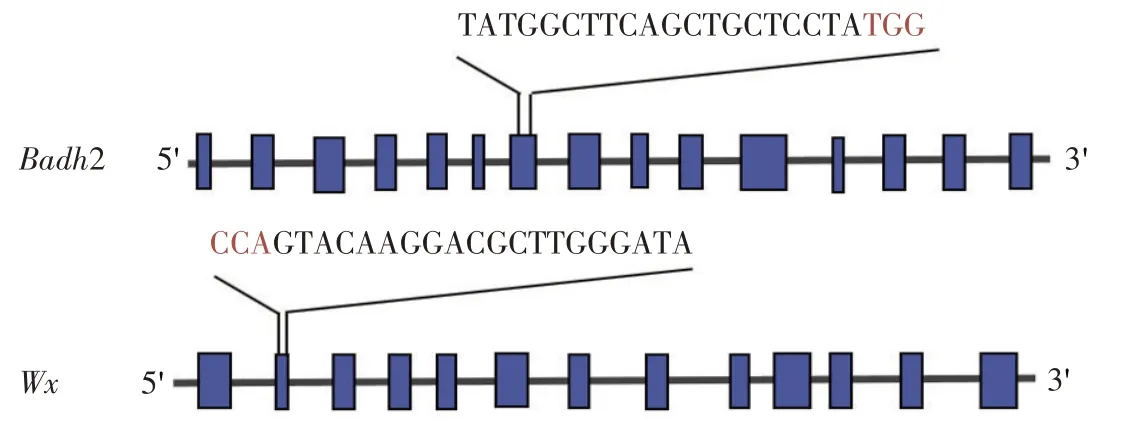
图1 Wx和Badh2基因结构及靶点位置Fig.1 Gene structure and target site of Wx and Badh2
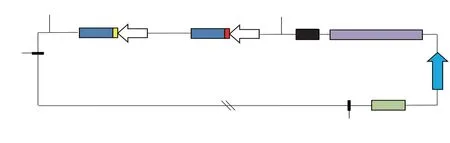
图2 pYLCRISPR/Cas9-Badh2-Wx-gRNA载体Fig.2 pYLCRISPR/Cas9-Badh2-Wx-gRNA vector

表2 T0代植株测序结果Table 2 Sequencing results of T0 generation plants
2.5 T1代纯合无T-DNA元件植株筛选
在T1代利用引物Badh2-seq-F/R、Wx-seq-F/R和HygF/R 进行PCR 扩增并测序。通过测序及筛选共得到Badh2和Wx双基因纯合突变且无T-DNA元件植株8株,包含4种不同基因型,相同基因型作为同一株系,将其重新命名为bw-1、bw-2、bw-3和bw-4,测序结果见图3。
2.6 农艺性状测定
测定野生型唯农208 与4 个T2代株系株高、穗数、每穗粒数、结实率和千粒重。结果表明,4个T2代株系与野生型相比,株高、穗数、每穗粒数、结实率无明显变化,而千粒重略降低,但未达到显著水平,整体农艺性状无明显差异(见图4)。说明WX 和Badh2 双基因突变对水稻农艺性状无显著影响。
2.7 香味测定
通过气相色谱-质谱联用技术检测野生型与突变体籽粒中2-AP 含量,测得野生型唯农208 中2-AP含量约为0.065 μg·g-1,而4个突变体株系2-AP含量较野生型均显著增加(见图5),其中BW-1M籽粒中2-AP 含量增至0.504 μg·g-1,高于其他3 个株系;而BW-3M中2-AP含量在4个突变株系中相对较低,2-AP 含量为0.410 μg·g-1。4 个突变株系籽粒中2-AP 含量平均值为0.460 μg·g-1。结果表明,编辑水稻Badh2基因,可获得香味性状明显改良的突变材料。

图3 野生型及T1代纯合突变植株测序结果Fig.3 Sequencing results of wild type and T1 homozygous mutant plants
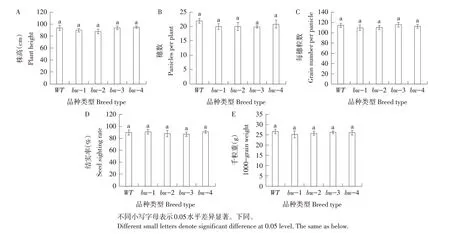
图4 野生型及突变体农艺性状Fig.4 Agronomic character of wild type and mutant plants
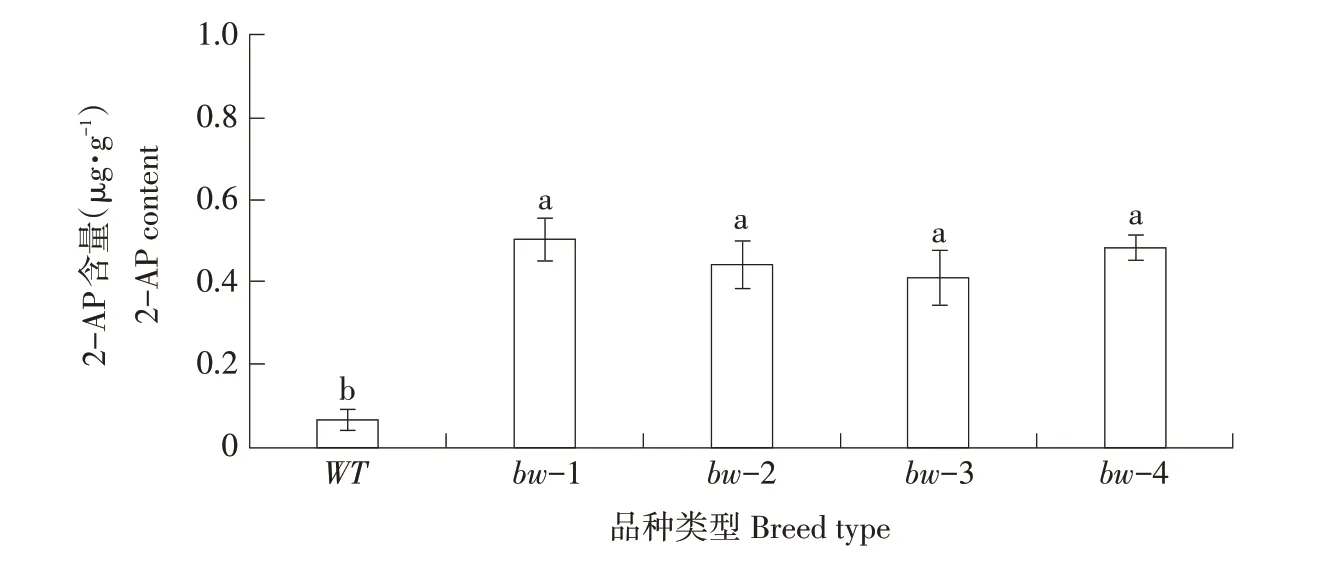
图5 野生型及突变体中香味物质2-AP含量Fig.5 2-acetyl-1-pyrroline(2-AP)content of wild type and mutant plants
2.8 直链淀粉含量测定
将野生型与突变体籽粒脱壳,鉴定糙米表观形态(见图6)。结果表明,突变株系糙米具有蜡质外观,乳白色且完全不透明,与野生型唯农208呈现的典型非蜡质、半透明外观形成鲜明对比。野生型唯农208与4个突变株系直链淀粉含量测定结果见图7,所有突变株系直链淀粉含量与野生型相比均显著下降。由17.0%下降至1.52%~1.83%,呈糯性。表型鉴定结果与直链淀粉含量测定结果均证实对Wx基因成功编辑。

图6 野生型和突变体糙米表型Fig.6 Phenotype of brown rice about wild type and mutants
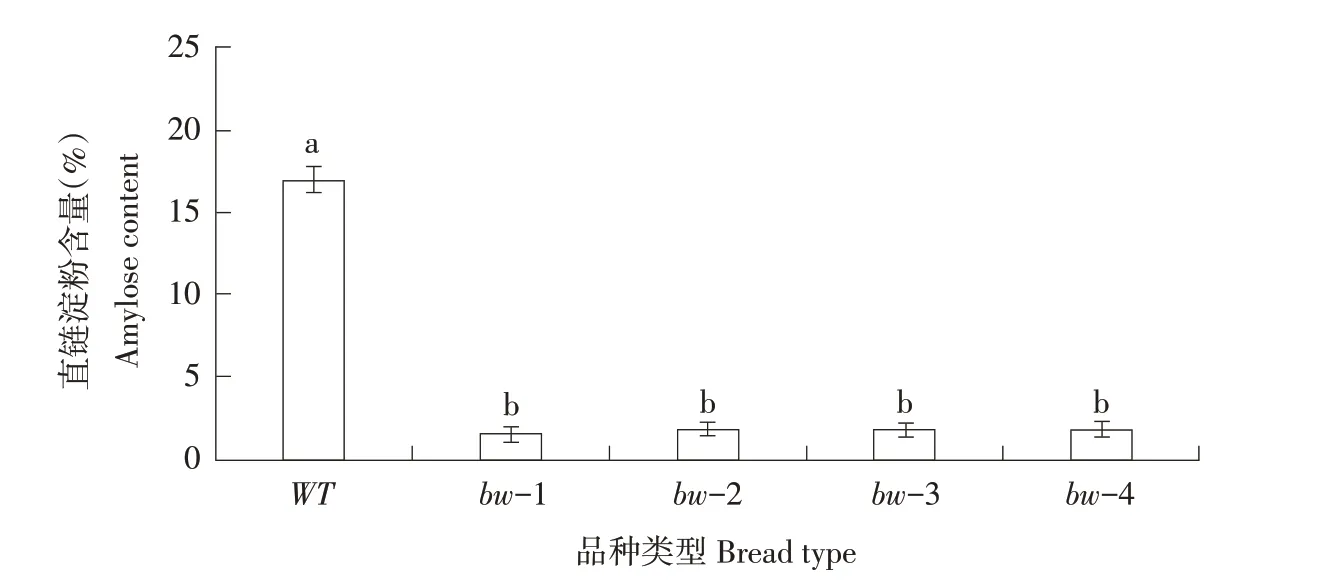
图7 野生型及突变体中直链淀粉含量Fig.7 Amylose content of wild type and mutant plants
3 讨论与结论
与传统育种相比,基因编辑技术可缩短育种年限,且克服不利基因连锁等难题。CRISPR/Cas9技术作为继ZFN 和TALEN 技术之后第三代基因编辑技术,成本更低且操作更简单,广泛应用于多种作物遗传育种[17-19]。本试验在水稻Badh2 第7 外显子和Wx 第2 外显子分别设计两条sgRNA 靶序列,构建靶向Badh2 和Wx 基因CRISPR/Cas9 敲除载体,以唯农208 为受体材料,突变序列分析表明,CRISPR/Cas9在这两个靶点均具有相对较高的基因编辑效率,Badh2 靶点突变类型以1 和5 bp 碱基缺失为主,多数突变仅在靶点前3 bp处缺失1个胞嘧啶。Wx 靶点产生的突变类型主要为1 bp 碱基插入和3 bp碱基缺失。吴明基等在Badh2第1外显子设计1 个靶点构建CRISPR/Cas9 载体,对水稻品种龙稻18 进行基因编辑,在T1代获得7 种不同纯合Badh2突变基因型[20]。而本试验中,两个基因不同突变类型较少,可能与针对单一基因设计的靶点数目以及靶点序列特征有关。本试验得到42 株T0代阳性植株,其中34 株为阳性突变植株,突变率高达81.0%,表明本试验设计的两个靶点有较高基因编辑效率。方加海等研究认为,靶序列中CG含量对突变效率有影响[21],这可能是本试验中T0代阳性植株中突变率较高的因素之一。
稻米香味性状是近年育种家关注热点之一。Shan 等利用TALEN 技术对水稻品种日本晴Badh2进行基因编辑,得到Badh2 基因功能缺失突变体,突变体籽粒香味得到明显改良[22]。祁永斌等利用CRISPR-Cas9技术对水稻香味基因Badh2进行定向编辑,得到多个香味改良且无转基因成分纯合水稻株系[23]。孙慧宇等采用咀嚼法和氢氧化钾浸泡法检测Badh2基因编辑突变体籽粒香味[24]。用咀嚼法和氢氧化钾浸泡法测定香味,主观干扰性较大,可能对结果准确性有影响。徐善斌等[25]与周俊飞等[26]使用气相色谱-质谱联用技术测定2-乙酰-1-吡咯啉(2-AP)含量检测突变体香味,与本文所用方法一致,能够有效避免上述问题出现。
Wx 是水稻直链淀粉含量主效QTL,基因编辑技术之前,主要通过反义RNA或RNAi技术降低水稻籽粒中直链淀粉含量,实现稻米淀粉品质改良。陈刚等将反义Wx 基因转入武运粳7 号,直链淀粉含量显著降低[27]。方加海等利用转反义Wx 基因导入水稻品种珍汕97B,并通过单株选择、回交转育等方法,得到遗传稳定且直链淀粉显著下降的改良水稻品系[21]。本研究利用CRISPR-Cas9技术对唯农208 的Wx 基因进行定点编辑,得到直链淀粉含量显著降低的突变体材料。与传统转基因技术相比,CRISPR-Cas9 技术可精准高效进行基因编辑,且可相对直观地从基因序列中体现出基因突变情况,因此该技术在稻米直链淀粉含量的改良育种中得到广泛应用。汪秉琨等利用CRISPR/Cas9系统以楚粳27为受体材料,在Wx基因第一和第二外显子设计靶点,突变体稻米直链淀粉含量显著降低,由原来17.50%降低至1.93%[28]。本试验以唯农208 为受体材料,对Wx 基因第二外显子进行编辑,筛选得到4个株系直链淀粉含量由17.0%降低至1.52%~1.83%,表现为糯性。结合前人结果表明,对Wx基因进行编辑可显著降低稻米籽粒直链淀粉含量,而直接编辑Wx编码序列,可获得糯性突变材料,实现新型糯稻种质创制。

