基于师范认证理念“学生中心”的课堂教学设计
——以无机化学“电极电势的应用”教学为例
解庆范,黄妙龄,崔玛琳,陈延民
(泉州师范学院 化工与材料学院,福建 泉州)
一 关于师范类专业认证及认证理念
为贯彻落实党的十九大精神,培养高素质教师队伍,按照国家教育事业发展“十三五”规划工作要求,推进教师教育质量保障体系建设,提高师范类专业人才培养质量,教育部于2017年10月26日印发了《普通高等学校师范类专业认证实施办法(暂行)》[1],我国各大高校师范类专业认证工作进入真正的实施阶段,师范类专业认证对高校师范生教育提出了新的要求。
(一) 专业认证理念
师范类专业认证以“学生中心、产出导向、持续改进”为基本理念。学生中心,强调遵循师范生成长成才规律,以师范生为中心配置教育资源、组织课程和实施教学;产出导向,强调以师范生的学习效果为导向,对照师范毕业生核心能力素质要求,评价师范类专业人才培养质量;持续改进,强调对师范类专业教学进行全方位、全过程评价,并将评价结果应用于教学改进,推动师范类专业人才培养质量的持续提升[1]。
(二) “学生中心”认证理念的理解
“学生中心”(Student-Centered,SC),即学校教育教学强调从以“教”为中心的传统模式向以“学”为中心的新模式转变。要求一切教育教学活动应遵循学生成长成才规律,以学生学习效果和个性发展为中心配置教育资源和安排教学活动。以“学生为中心”的教学活动,是将学生视为学习活动的主体和课堂教学的核心要素,在教学过程中鼓励、支持学生要主动学习、勤于思考,要善于合作学习;同时注意引导学生在学习中要善于运用已有知识积极进行思考,要乐于沟通、大胆表达自己的观点,注意培养自己的沟通合作能力,使学生学习主体意识得到最大限度的体现和发挥[2-4]。
二 基于“学生中心”的无机化学课堂教学设计
尽管学生的获取知识和能力的途径和方式多种多样,但是课堂教学一直是高校培养学生的主阵地,是高校教学工作的重点。在师范类专业认证自评报告的八大板块中,“课程与教学”体现了国家对专业人才培养体系和运行过程的质量要求,是整个专业认证的基础,课程实施与课程目标达成情况对毕业要求具有重要支撑作用;同时课程又是专业建设的核心要素,课程建设作为一个专业建设的基础,其包含的教学内容、教学方式等方面的确立,可以说在专业认证中发挥着奠基性作用[5]。
(一) 无机化学课程在化学专业的地位及教学设计流程
无机化学是师范类化学专业的一门重要的专业核心课程,该课程的教学成果对学生掌握化学学科的基本知识、基本原理和基本技能,以及知识体系的形成和其他专业课程的学习都有重要基础作用。作为无机化学课程的教师,在师范类专业认证的背景下,基于 “学生中心”的基本理念,在教学中重视课堂教学在学生培养过程中的重要作用,能够根据学生学习需求及时调整授课模式及教学方法,采取案例教学、探究教学等多种教学方法,运用慕课、翻转课堂等信息技术手段,合理安排课堂教学、课外学习,激励学生自主学习、主动参与课堂教学和团队合作学习,保证课堂教学质量。无机化学课程教学设计流程见图1。以“电极电势的应用”教学为例,介绍基于“学生中心”的课堂教学设计。
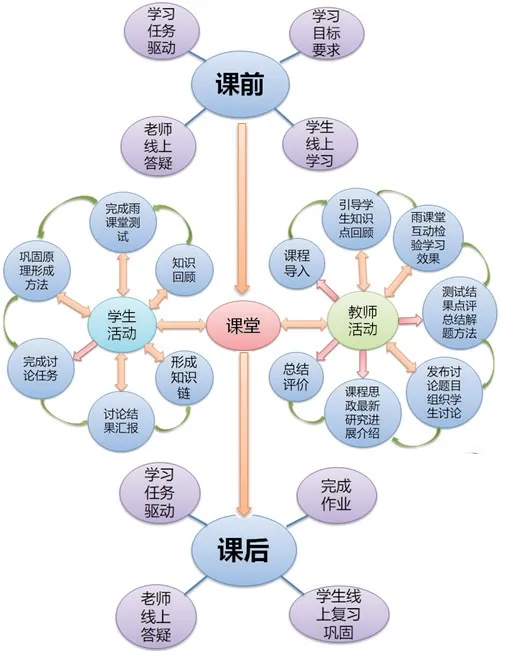
图1 无机化学课程教学设计流程
(二) 基于“学生中心”的课堂教学设计
1.基于“学生中心”的课堂教学设计要求。
(1)彻底转变教师观念,转变课堂教学唯教材、唯教师、唯标准答案、唯教师讲授的课堂教学观念,树立以学生为中心,依托学生经验和社会发展实际实施课堂教学,使课堂教学适应学生多样化发展的需求,注重产出导向,着力培养学生的学习能力、实践能力和可持续发展的能力。
(2)教学案例即要解决的实际问题的选择,一方面要在有限的课堂教学时间内,设计整合好课程内容;二是设置的案例问题难易程度的设置要恰当,案例问题难度过低,学生会因太简单而丧失研讨的兴趣;问题难度过高,多数学生会因为无从下手而丧失学习探究的积极性,使得问题的探究完成只局限于少数能力较强的学生。因此设计的案例问题的难易程度要适中,既兼顾大多数学生,又有利于能力较强的学生发挥引领作用。
2.教学设计理念和基本思路。以学生为中心,教师为主导,设计多样化教学活动。围绕学生学习,整合各种教学资源,营造自主学习环境。通过学习任务布置、导学,学生线上自主学习,教师在线答疑的方式进行知识点学习,线下通过雨课堂智慧教学手段对学生自主学习效果进行测评,以实际案例问题解决展开知识的深入学习,通过问题提出、同学交流讨论、学生讲学生评、教师案例点评等多种方式开展线下线上深度融合的教学活动。并在教学过程中适时融入思政教育和科学思维的引导,培养学生的社会责任感和实际解决问题的能力。通过对最新科研进展介绍,激发学生的创新意识。
3.教学设计案例——以“电极电势的应用”教学为例
教学环节一:课前学习任务驱动
通过观看MOOC视频和PPT,学习§7.4 电极电势的应用,达成下列学习目标:
①掌握并会用电极电势大小来判断氧化剂、还原剂强弱的方法;②掌握并学会应用电极电势来判断氧化还原反应进行的方向;③掌握并学会应用电极电势来判断氧化还原反应进行的限度;④掌握元素电势图的表达方式和应用,学会用元素电势图判断歧化反应和计算标准电极电势。
教学环节二:线上答疑,学生可以将在学习过程中遇到的问题在线进行提问,老师在线进行答疑。
教学环节三:课堂教学
【教师导课】展示课题PPT
【与学生一起进行知识点回顾】
【教师小结】启发与板书
【教师导入】“小试牛刀”通过雨课堂智慧教学工具进行测验,检验学生的学习效果。
(应用一:小试牛刀之一判断氧化还原性的相对强弱)
单选题:已知:Eθ(Cr2O72-/Cr3+)=1.33V,Eθ(Fe3+/Fe2+)=0.77V,Eθ(I2/I-)=0.535V,Eθ(Ag+/Ag)=0.80V
上述电对中的氧化型物质氧化能力由强到弱顺序正确的是

(应用二:小试牛刀之一判断氧化还原反应的方向,强氧化剂与强还原剂反应生成弱的还原剂和弱的氧化剂)
单选题:已知:Eθ(I2/I-)=0.535V
Eθ(Fe3+/Fe2+)=0.77V
在标准状况下将I2、I-、Fe3+、Fe2+混合,将发生怎样的反应?
A.I2+2Fe2+=2I-+2Fe3+
B.2Fe3++2I-=I2+2Fe2+
(应用三:小试牛刀之一元素电势图的应用)

【学生答题情况分析】
【小结】教师归纳知识要点并切入“大显身手”环节。
【大显身手】环节:引出问题,组织【小组讨论】,讨论结果进行“雨课堂”投稿形式发表各小组意见,【小组发言】环节,小组之间质疑、解答、打分。教师对答案进行修正,并对学生表现进行评价和打分。
问题1[初见锋芒PPT]在实验室如何制氯气?为什么用浓盐酸?用1mol·L-1的盐酸怎样?(此题检验3个知识点:①确认氧化还原电对;②用电动势判断氧化还原反应方向的方法;③非标准状态下的电动势如何计算即能斯特方程的应用。)
【教师引导】首先是反应物的选择,其次是状态的确定,然后是反应方向的判断。如何判断反应的方向呢?
问题2[步步深入PPT]根据已知信息,如何用电化学方法获得氯化银的标准溶度积?[此题目的:①消除认知的误区:电池反应一定是氧化还原反应(不一定);②学会设计原电池;③掌握标准电池电动势与标准平衡常数的关系(“标准”是重点又是难点)]。
问题3[更上一层楼PPT展示]学生观看视频、讨论、汇报。

视频1:常温下将锌粉和碘粉混合,没有明显现象,往混合物里加入水后,混合物发生了反应,有紫色的气体生成。该反应是一个氧化还原反应,任何的氧化还原反应都可以设计成原电池,那么如何将这个反应设计成一个原电池?用电池符号表示设计的原电池。
视频2:将锌片插入装有水的烧杯中,往一装有碘化钾的素瓷杯里加入碘粉和KI水溶液,然后把素瓷杯放入烧杯中,插入碳棒,连接导线,指针发生旋转。
【教师小结】
视频1说明:①在常温常压下干燥的锌粉和碘粉直接混合不会发生反应;②水可以起催化作用,导致发生快速反应Zn+I2=ZnI2;③有紫红色气体出现,说明该反应是放热反应,导致碘升华;④电池符号:

视频2说明:①电池需要电解质水溶液或熔融液;②要清楚盐桥的作用;③“盐桥”多种多样;④电极导电材料是必需的。
问题4[乘胜追击PPT展示]学生观看视频、讨论、汇报。
视频3:铝与碘组成的原电池与锌-碘原电池类似,但是,电机运转的现象不同,刚开始指针旋转速度较快,后来速度减慢至停下来;如果把铝片拿出来刮一刮铝片表面再放进水里,指针又转了,但一会儿又停了。
【学生讨论】①为什么指针会停下来?②发生了怎样的电极反应和电池反应?
【教师小结】
①“刮一刮铝片”又能放电,说明铝片表面形成了氧化膜;电阻增大,电流减小;②铝-碘电池放电与锌-碘电池放电反应存在很大差异。有视频4为证。

视频4:把铝粉和碘单质混合在一起,没有明显现象,往混合物中加水,可明显看出发生了反应,有紫色的气体生成(与锌-碘反应相似),混合物表面很快出现银白色膜状物质。原因是铝粉和碘单质发生了氧化还原反应,放热,使得未反应的碘单质升华。在氧化还原反应的同时,生成的铝离子水解生成氢氧化铝,受热分解为氧化铝。
所以电极反应是:负极:2Al+3H2O→Al2O3+6H++6e-
正极:I2+2e-→2I-
铝-碘电池反应:2Al+3H2O+3I2→Al2O3+6H++6I-
而锌-碘电池反应:Zn+I2→Zn2++2I-
【深入探讨】
观看视频5:这是实验室模拟铅酸蓄电池的实验,将两块铅片插入装有浓硫酸溶液的烧杯中,用导线连接电动机形成一个闭合回路,指针不动,说明没有电流产生;然后我们将导线连接到外加电源上,进行充电,我们可以观察到阴极铅片上有气泡产生,阳极铅片上有新物质产生,然后再进行放电试验,指针转动,则有电流产生;数分钟后,指针停了下来。请同学们根据视频现象完成讨论题目。

【启发质疑】同学们从视频可以发现哪些问题?
【小组讨论】“雨课堂”投稿。
【引出问题】①为什么开始没有电流产生?②充电时为什么会有气泡产生?再次充电还会这样吗?③放电发生什么反应?④电机为什么会停下来?⑤为什么正、负极的铅片都插到一个烧杯里,两个电极不应该有两个烧杯吗?⑥铅酸蓄电池为什么用浓硫酸?
【小组讨论】讨论结果“雨课堂”投稿。
【点评与小结】
①铅酸蓄电池的两个电极电对分别是PbSO4/Pb和PbO2/PbSO4,电池放电时正极的反应物是PbO2,负极的反应物是Pb,新电池两极都是Pb,未构成电池,所以无法放电。
②新电池充电时,电极反应:
阳极:Pb+2H2O=PbO2+4H++2e-
阴极:4H++2e-=H2↑
电池再次充电时,电极反应:
阳极:PbSO4+2H2O=PbO2+SO42-+4H++2e-
阴极:PbSO4+2e-=Pb+SO42-
由此可以进一步说明,为什么电池不能过度充电的原因。
③电池放电反应:

④电机停下来的原因就是两电极表面都形成PbSO4膜,电阻增加的结果。
⑤正负极都有硫酸参与反应,所以正负极使用同一电解质溶液,不需要额外的盐桥,这种电池叫单液电池(新知识点)。电池符号:

⑥为什么用浓硫酸呢?根据能斯特方程可以判断,硫酸的浓度越高,电池的电动势越大;放电时虽然硫酸有消耗,但对浓度影响不大,所以可以始终保持电压几乎不变。
【课堂总结】
【前沿知识介绍】
【课后思考题】铅是重金属,对环境会造成污染,为什么铅酸蓄电池现在还在大量使用?
在整个教学过程中,通过案例分析,以问题为导向,由浅入深,层层递进,引导学生学会发现问题、提出问题,并应用所学知识解决问题,达到学以致用的目的,充分体现了“学生中心,产出导向”的理念。该教学案例使学生真正体会到知识的学习不在于“掌握了什么”,重要的是“会做了什么”。
三 结语
基于“学生中心”的课堂教学设计,将教师由传统的知识传授者转化为学生学习的促进者和引导者,从知识记忆到知识理解、应用,再逐级递进上升到分析、评价,从不同角度、用不同方式引导、促进和激励学生学习、思考,使学生知识的学习一步步从认知水平向应用能力发展。

