非洲猪瘟病毒A137R蛋白单克隆抗体的制备与表位鉴定
向志达,李长尧,张涛清,张元峰,黄 丽,杨玉莹*,翁长江*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/基础免疫创新团队,黑龙江 哈尔滨 150069;2.长江大学动物科学学院,湖北 荆州 434025)
非洲猪瘟(African swine fever,ASF)是由ASF 病毒(ASFV)感染家猪或野猪引起的一种急性、热性和高度传染性疾病[1]。根据ASF 的不同临床表现和病理变化,可将其分为4 个阶段:极急性期表现为高热(体温41 ℃~42 ℃)、食欲不振、呼吸急促和皮肤充血;急性期最常见,感染猪临床表现为高热、皮肤红肿、淋巴结、肾脏和胃肠道黏膜明显出血[2];亚急性期的临床症状不太明显;慢性ASF 是由低毒力病毒感染引起的,以皮肤坏死性疾病和关节炎为特征。2018 年8 月,ASF 首次在中国辽宁省沈阳市出现,随后迅速蔓延至全国各省[3]。
ASFV 是一类有囊膜的双链DNA 病毒,为非洲猪瘟病毒科家族的唯一成员。根据其主要衣壳蛋白p72基因序列的差异性,可将病毒分为24 个基因型[4];基于病毒血凝素CD2 样蛋白质(CD2v)和C 型凝集素,可将其分为8 种血清型[5]。基因Ⅰ型、Ⅱ型研究最为广泛,目前在中国出现的Pig/HLJ/18 株属于强毒力基因Ⅱ型ASFV[6]。ASFV 基因组长度为170 kb~190 kb,编码151~167 个开放阅读框(ORFs)。ASFV粒子呈二十面体形态,由内向外依次由核心、核壳、内囊膜、衣壳和外囊膜组成[7]。研究表明,ASFV 的复制主要发生在细胞质中,而病毒早期DNA 的合成是在细胞核中[8-9]。
本研究室前期利用ASF 康复猪阳性血清从ASFV编码的170 种蛋白中筛选能够诱导宿主产生抗体的免疫原性蛋白,结果发现A137R 具有较强的免疫原性[10]。A137R 在病毒复制的晚期表达且定位在病毒的复制工厂,但目前还不清楚该蛋白是如何发挥功能的。基于此,本研究利用原核表达系统表达并纯化了重组A137R(rA137R),将其免疫BALB/c 小鼠,通过间接ELISA 方法筛选ASFV A137R 单克隆抗体(MAb),并对筛选的MAb 进行了一系列鉴定及初步的应用研究,并鉴定了MAb 的表位。为ASFV A137R的功能研究及开发ASFV新型诊断试剂奠定实验基础。
1 材料与方法
1.1 细胞、病毒、载体及实验动物HEK293T 细胞和骨髓瘤细胞(SP2/0)、表达载体pET-21a(+)和pGEX-6P-1 均由本实验室保存;猪肺泡巨噬细胞(PAMs)分离自30 日龄的SPF 猪;ASFV Pig/HLJ/18 株由哈尔滨兽医研究所分离保存;大肠杆菌(E. coli)DH5α、BL21(DE3)感受态细胞均购 自TaKaRa 公司;pCAGGS-Flag-A137R 真核表达质粒由金斯瑞生物科技有限公司合成;6 周龄~8 周龄雌性BALB/c 小鼠购自辽宁长生生物技术股份有限公司。
1.2 主要试剂DMEM、RPMI 培养基、胎牛血清购自Gibco 公司;HisTrap HP 亲和层析柱购自GE 公司;BCA 蛋白浓度测定试剂盒购自碧云天公司;IRDye 800CW 山羊抗兔和山羊抗小鼠IgG 购自LI-COR Bioscience 公司;HRP 标记的山羊抗小鼠IgG(H+L)购自北京博奥龙免疫技术有限公司;Alexa Fluor 488、Alexa Fluor 594 标记的山羊抗小鼠IgG(H+L)、鼠源Flag MAb、4',6-联脒-2-苯基吲哚二盐酸盐(DAPI)、低黄嘌呤-氨基嘌呤-胸腺嘧啶(HAT)、低黄嘌呤-胸苷(HT)、弗氏完全佐剂、弗氏不完全佐剂、Flag-Agarose 均购自Sigma 公司;鼠源ASFV p72 多克隆抗体、鼠源His MAb、鼠源GST MAb 由本实验室制备;鼠源GAPDH MAb、兔源β-actin MAb 和鼠源Flag MAb 均购自Proteintech 公司;1%NP-40 细胞裂解液(50 mmol/L Tris-HCl,pH7.4;1 mmol/L EDTA;150 mmol/L NaCl;5 mmol/L MgCl;10%甘油;1%NP-40)由本实验室配制;SBA Clonotyping System-HRP抗体亚类鉴定试剂盒购自SouthernBiotech 公司;用于抗原表位鉴定的一系列多肽由南京金斯瑞生物科技有限公司合成。
1.3 pET-21a-A137R 重组表达质粒的构建、蛋白的表达、纯化与鉴定根据GenBank 登录的ASFV Pig/HLJ/18 株A137R 基因序列(QBH90530.1)设计特异性引物(表1),并以提取的ASFV Pig/HLJ/18 株基因组DNA 为模板,利用A137R-F/A137R-R PCR 扩增A137R 全长基因并克隆至经BamH I/XhoI 双酶切后的pET-21a(+)载体中,构建原核表达质粒pET-21a-A137R,并经测序鉴定。选择测序正确的重组质粒pET-21a-A137R 转化到大肠杆菌BL21(DE3)感受态细胞中,37 ℃、220 r/min 培养至OD600nm值为0.6~0.8,加入IPTG 至终浓度为1 mmol/L,在16 ℃、220 r/min 条件下诱导12 h~16 h;将诱导后的菌液离心,收集菌体沉淀,超声破碎菌体后,以4 ℃,12 000 r/min 离心20 min,分别收集上清和沉淀,利用SDS-PAGE 检测rA137R 的表达。大量诱导表达目的蛋白后,利用HisTrap HP 亲和层析柱和凝胶过滤层析柱纯化rA137R,利用BCA 蛋白定量试剂盒测定该蛋白的浓度,并经SDS-PAGE 检测后,以鼠源His MAb(1∶2 000)为一抗,分别以IRDye 800CW 山羊抗兔和山羊抗小鼠IgG(1∶10 000)为二抗,经western blot 鉴定重组蛋白的纯化效果。
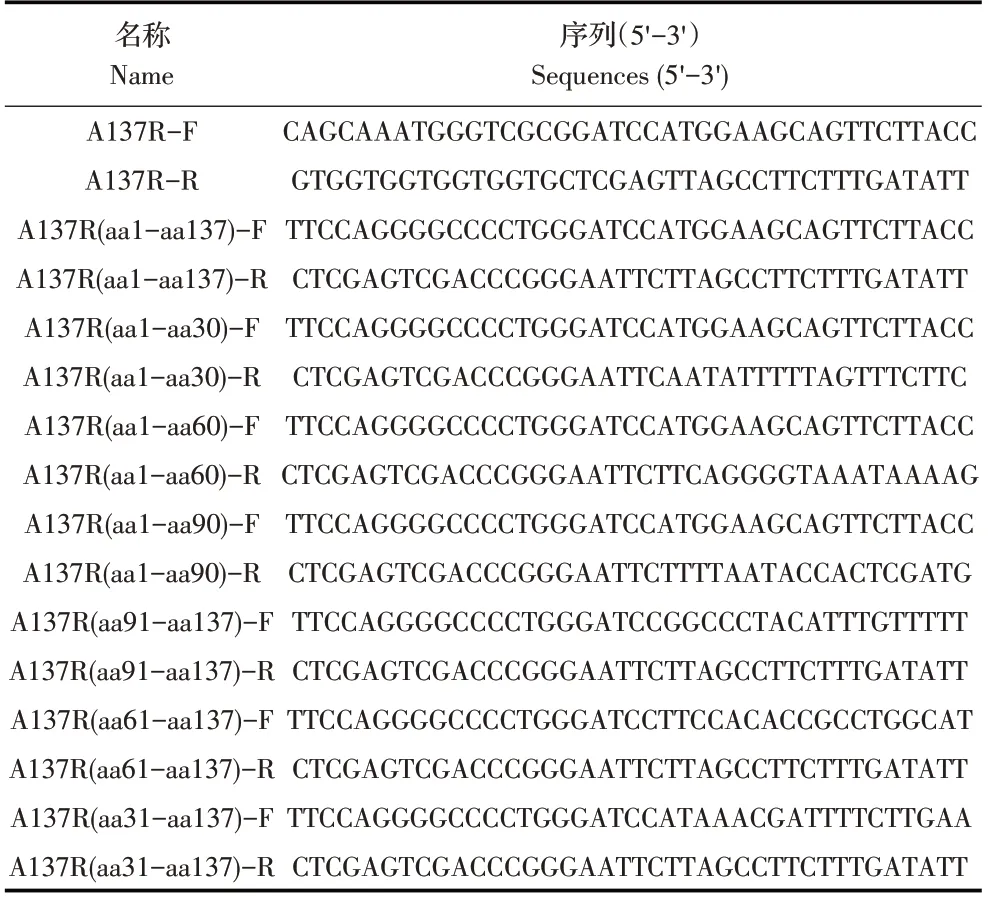
表1 ASFV A137R基因及其基因截短片段的PCR扩增引物Table 1 PCR amplification primer of ASFV A137R gene and its truncated fragment
1.4 MAb 的制备及纯化将纯化的rA137R 与等体积的弗氏完全佐剂乳化后经腹部皮下注射免疫小鼠,每隔两周采用相同的方式免疫,第二次和第三次免疫,蛋白均用弗氏不完全佐剂乳化,第三次免疫3 d~5 d 后采血分离血清,以纯化的rpA137 作为包被抗原,以小鼠血清作为一抗(1∶1 000),以HRP 标记的山羊抗小鼠IgG(H+L)(1∶5 000)作为二抗,采用间接ELISA 方法检测抗体效价。选取抗体效价较高的小鼠迫杀,将免疫的脾细胞与SP2/0 细胞融合并经间接ELISA 方法[11]筛选稳定分泌A137R MAb 的杂交瘤细胞株,并及时扩大培养并冻存。将弗氏不完全佐剂(200 μL/只)注射到8 周龄BALB/c 小鼠腹腔中致敏,3 d~7 d 后,将杂交瘤细胞悬液按105个/只注射于小鼠腹腔内,5 d~7 d后收集腹水,利用Protein G亲和层析介质纯化获得小鼠腹水并经SDS-PAGE 检测。
1.5 MAb 的效价及亚类测定用碳酸盐缓冲液(0.05 mol/L,pH9.6)将纯化的rpA137稀释至2.5 μg/mL,用PBST 将制备的两株MAb 10 倍倍比稀释后作为一抗,以HRP 标记的羊抗鼠IgG(1∶5 000)为二抗,利用间接ELISA 方法[12]检测MAb 效价。利用SBA Clonotyping System-HRP 抗体亚类试剂盒鉴定获得的两株MAb 的亚类。
1.6 MAb 反应原性的western blot 鉴定将真核表达质粒pCAGGS-Flag-A137R 以不同剂量(0、0.5 μg、1 μg、2 μg)转染HEK293T细胞,置37 ℃5%CO2培养24 h 后 收 集 细 胞;将ASFV HLJ/18 株 以MOI 0.1 感染PAMs,分别在感染后不同时间(0、2 h、4 h、6 h、8 h、12 h、24 h)后收集细胞。用含1% NP-40 裂解液裂解细胞,离心后取上清,加入4×loading buffer 煮沸10 min,SDS-PAGE 电泳后转印至聚偏二氟乙烯膜(PVDF 膜),分别以纯化的MAb(根据MAb 效价的检测结果选择一株效价相对较高的MAb 用于该试验及后续试验)(1∶1 000)和鼠源ASFV p72 多克隆抗体(1∶1 000)为一抗,以IRDye 800CW 标记的山羊抗小鼠IgG(1∶10 000)为二抗,经western blot 检测MAb 与293T 细胞中过表达的Flag-A137R 和PAMs 中天然表达的A137R 的反应原性。
1.7 MAb反应原性的间接免疫荧光试验(IFA)将真核表达质粒pCAGGS-Flag-A137R以2 μg转染293T细胞,同时设pCAGGS-Flag空载体转染的293T细胞为阴性对照。36 h后用4%多聚甲醛固定细胞30 min,再经通透、封闭后,以纯化的MAb(1∶1 000)为一抗,以Alexa Fluor 488 标记的山羊抗小鼠IgG(H+L)(1∶2 000)为二抗,DAPI 染核30 min 后,经IFA 进一步检测MAb 与293T细胞中过表达的Flag-A137R的反应原性。
1.8 MAb 用于鉴定A137R 细胞定位的激光共聚焦试验将ASFV Pig/HLJ/18株以MOI 0.1 感染PAMs,在感染后不同时间(0、2 h、4 h、6 h、8 h、12 h、24 h)收集细胞,以纯化的MAb(1∶100)、兔β-actin MAb(1∶100)作为一抗,Alexa Fluor 488 标记的山羊抗小鼠IgG(H+L)(1∶2 000)和Alexa Fluor 594 标记的山羊抗兔IgG(H+L)(1∶2 000)分别作为二抗,DAPI 染核30 min 后,置激光共聚焦显微镜下观察ASFV 感染PAMs 后A137R 的定位。
1.9 MAb 用于检测293T 细胞中过表达A137R 的免疫共沉淀试验(Co-IP)将真核表达质粒pCAGGSFlag-A137R转染293T细胞,同时设立pCAGGS-Flag空载体转染的293T细胞作为阴性对照。24 h后收集细胞样品,用100 μL 1%NP40裂解细胞离心后取上清并分为两份,一份在25 μL上清中加4×loading buffer,煮沸10 min,常温放置作为Input样品;在剩余样品中加入30 μL Flag-Agarose,4 ℃旋转孵育6 h,用1%NP-40洗涤Flag-Agarose 后,加入2×loading buffer,煮沸10 min作为IP样品。两份处理后的样品经SDS-PAGE电泳、转膜、封闭后分别以鼠源Flag MAb(1∶2 000)、纯化的MAb(1∶1 000)和鼠源GAPDH MAb(1∶5 000)为一抗,以IRDye 800CW标记的山羊抗小鼠IgG(1∶10 000)为二抗,经western blot 检测外源过表达的Flag-A137R 与Flag-Agarose 结合后与MAb 的反应性。
1.10 MAb 抗原表位的鉴定分别以提取的ASFV Pig/HLJ/18 株基因组DNA 为模板,利用表1 中的各截短片段的扩增引物经PCR扩增A137R全长和各该基因的截短片段并克隆至pGEX-6P-1载体中,构建的所有的质粒均经测序鉴定。将上述重组质粒分别转化到BL21(DE3)感受态细胞中,经IPTG诱导表达后分别以纯化的MAb(1∶1 000)和鼠源GST MAb(1∶2 000)为一抗,以IRDye 800CW标记的山羊抗小鼠IgG(1∶10 000)为二抗,利用western blot 初步鉴定两株MAb 的表位;为进一步确定抗原表位的精确区域,根据western blot结果,以前后各1 个氨基酸为步移合成一系列多肽作为包被抗原,并分别以表达的rpA137R 及表达的GST作为阳性对照和阴性对照,以获得的MAb(1∶2 000)为一抗,以HRP 标记的山羊抗小鼠IgG(H+L)(1∶5 000)为二抗,经间接ELISA 精确鉴定MAb 3D1 识别的抗原表位;同样根据western blot结果,将MAb识别的片段再逐步截短表达后再经western blot 精确鉴定MAb 2C3识别的抗原表位。为了进一步验证筛选出的抗原表位的正确性,将两株MAb识别的抗原表位的基因分别克隆至pGEX-6P-1载体中,构建重组质粒,阳性和阴性对照与上述同,将上述质粒原核表达后以获得的MAb(1∶2 000)为一抗,以IRDye 800CW 标记的山羊抗小鼠IgG(1∶10 000)为二抗,经western blot 检测MAb 与抗原表位的反应性。
2 结 果
2.1 rA137R的表达、纯化及其反应性鉴定结果将从ASFV Pig/HLJ/18株扩增得到的A137R基因克隆至原核表达载体pET-21a中,构建重组质粒pET-21a-A137R。经测序鉴定正确后转化大肠杆菌BL21(DE3),IPTG诱导后经SDS-PAGE检测。结果显示,出现一条约15 ku的目的条带,与预期大小一致(图1)。部分重组蛋白以包涵体的形式表达,但大部分在细菌裂解液上清中表达(图1)。大量诱导表达重组蛋白并经HisTrap HP亲和层析柱和凝胶过滤层析柱纯化,SDS-PAGE 结果显示,在约15 ku处出现单一目的条带,且该蛋白与His MAb 反应后在约15 ku 处出现一条特异性条带(图1)。BCA蛋白定量试剂盒测得该蛋白浓度为5.0 mg/mL。表明获得了纯度较高的rA137R,可以用于后续免疫小鼠。
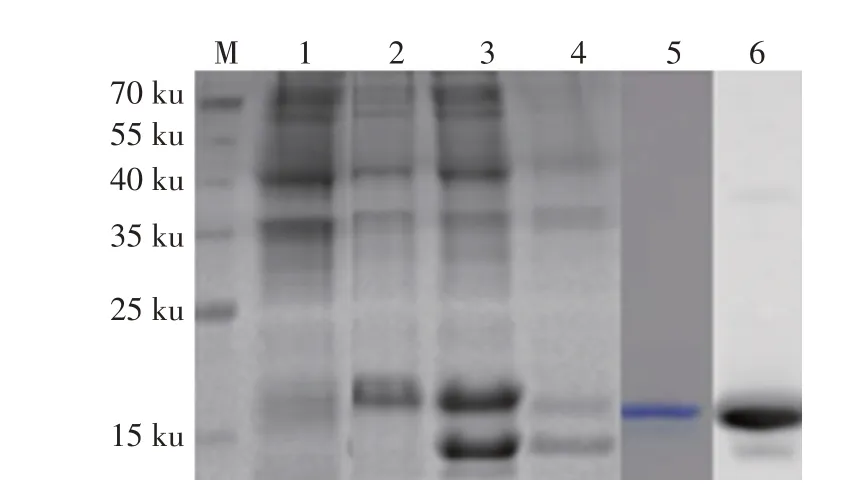
图1 rpA137R表达、纯化的SDS-PAGE及其反应性的western blot鉴定Fig.1 SDS-PAGE of rpA137R expression,purification and its reactivity identification by western blot
2.2 MAb 的制备及纯化结果免疫后的小鼠脾细胞与SP/20 细胞融合后,经间接ELISA 检测,最终筛选到了两株能够稳定分泌A137R MAb 的杂交瘤细胞株,分别命名3D1 和2C3。获得的小鼠腹水通过Protein G 亲和层析介质纯化,SDS-PAGE 结果显示,在55 ku(重链)和25 ku(轻链)处各出现一条蛋白条带(图2),表明制备的MAb 纯化效果良好。
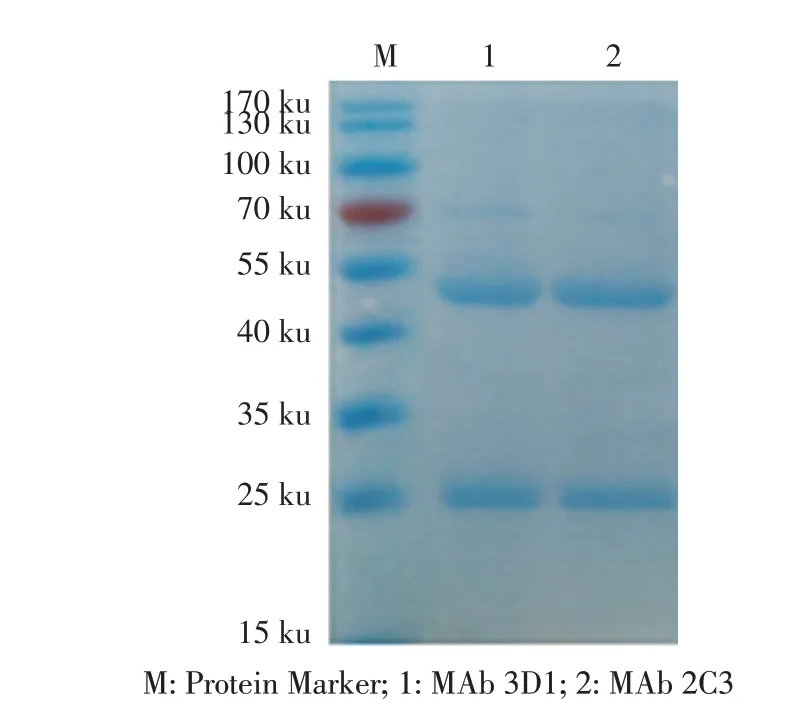
图2 MAb纯化的SDS-PAGE鉴定Fig.2 Identification of purified MAb by SDS-PAGE
2.3 MAb 效价及亚类的测定结果经间接ELISA 方法检测,MAb 3D1 和2C3 的效价分别为1∶218和1∶217,所以选择3D1 用于后续鉴定试验。SBA Clonotyping System-HRP 抗体亚类试剂盒鉴定结果显示,MAb 3D1 和2C3 重链均为IgG1,轻链均为Kappa 链。
2.4 MAb 3D1 与不同来源A137R 反应性的western blot 鉴定结果将真核表达质粒pCAGGS-Flag-A137R 以不同剂量转染HEK293T 细胞24 h 后收集细胞;将ASFV Pig/HLJ/18 株以MOI 0.1 感染PAMs,在感染后不同时间收集细胞。将收集的2 种细胞常规处理后采用western blot 检测MAb 3D1的反应性。结果显示,HEK293T 细胞出现了约15 ku 的特异性条带,且随着转染质粒浓度的增加,蛋白表达量也随之增加。未转染质粒的293T 细胞中无该条带(图3A);以纯化的MAb 3D1 为一抗时,在感染ASFV Pig/HLJ/18株后8 h 的PAMs 中出现了约15 ku 的特异性条带,且随着感染时间的延长,蛋白表达量也随之增加。以鼠ASFV p72 多克隆抗体为一抗时,在感染该株病毒后8 h 的PAMs 中出现了约73 ku 的特异性条带。p72蛋白为ASFV 编码的衣壳蛋白,检测该蛋白是为了证明病毒在细胞中获得复制且随着感染时间的增加其复制水平增加(图3B)。上述结果表明,制备的MAb 既能够与293T 细胞中过表达的A137R 也能够与ASFV感染的PAMs中天然表达的A137R反应,反应性较强,且ASFV感染PAMs约8 h后表达A137R。
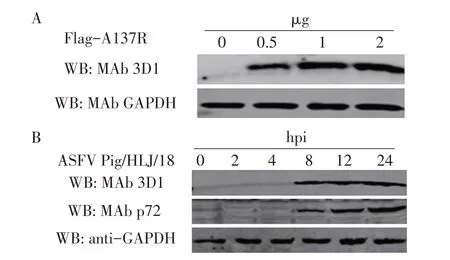
图3 MAb 3D1分别与293T细胞中过表达的pA137R(A)及ASFV感染的PAMs中天然表达的pA137R(B)反应性的western blot鉴定结果Fig.3 Western blot identification of the reactivity of MAb 3D1 with pA137R overexpressed in 293T cells(A)and pA137R naturally expressed in PAMs after ASFV infection(B)
2.5 MAb 与293T 细胞中过表达的A137R 反应性的IFA鉴定结果真核表达质粒pCAGGS-Flag-A137R转染HEK293T细胞36 h后采用IFA检测MAb 3D1与过表达的A137R 的反应性。结果显示,转染pCAGGSFlag-A137R 的293T 细胞出现绿色荧光,而转染空载体的293T 细胞无任何荧光(图4)。进一步表明制备的MAb 3D1能够与293T细胞中过表达的A137R反应。
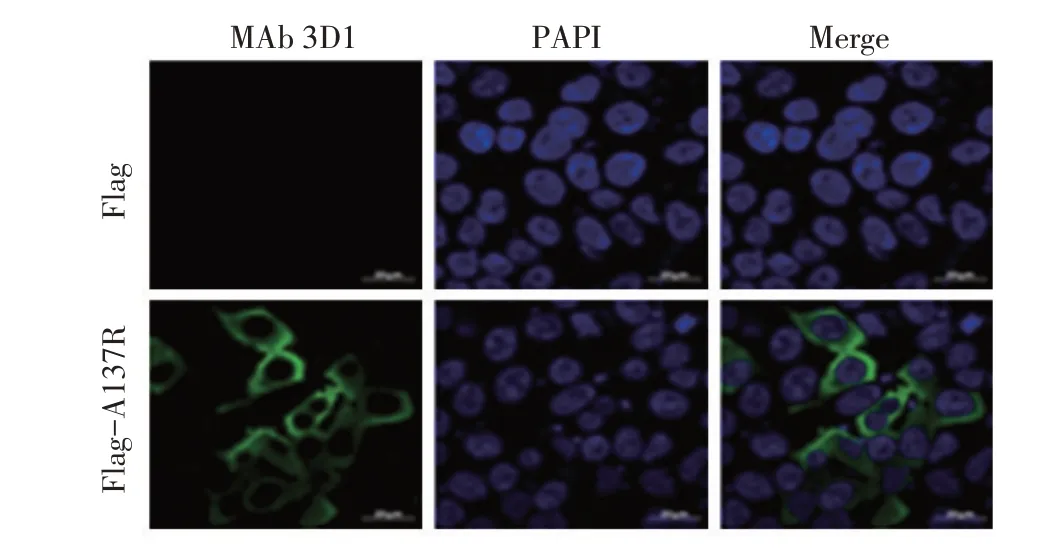
图4 MAb 3D1与293T细胞中过表达pA137R反应性的IFA鉴定结果Fig.4 IFA identification of MAb 3D1 reactivity with overexpressed pA137R in 293T cells
2.6 MAb 3D1 用于鉴定A137R 细胞定位的激光共聚焦试验结果将ASFV Pig/HLJ/18 株以MOI 0.1 感染PAMs,感染后不同时间点固定细胞,经相应一抗二抗作用后通过激光共聚焦显微镜观察。结果显示,ASFV 感染PAMs 6 h 后出现绿色荧光,且荧光主要在细胞质中,随着感染时间的延长,绿色荧光逐渐增多增强(图5)。进一步表明纯化的MAb 能够与病毒感染PAMs 后天然表达的A137R 反应,且A137R定位于细胞质中。
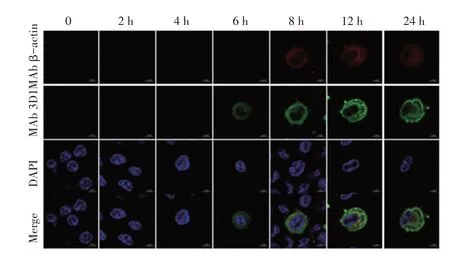
图5 pA137R细胞定位的激光共聚焦试验结果Fig.5 Results of confocal laser localization of pA137R cells
2.7 MAb 3D1用于检测293T细胞中过表达A137R的Co-IP 试验结果将pCAGGS-Flag-A137R 质粒转染293T 细胞,24 h 后收集细胞样品,裂解取上清并分为两份,一份上清样品煮沸后常温放置;另一份上清样品加入Flag-Agarose 6 h后洗涤、煮沸。两份上清样品通过SDS-PAGE 并转膜、封闭,加入相应的一抗二抗后,经western blot检测。结果显示,在Input样品中,转染pCAGGS-Flag-A137R 的293T 细胞与MAb 反应后出现了特异性条带,而转染pCAGGS-Flag 空载体的293T 细胞中无该特异性条带;在IP 样品中,转染pCAGGS-Flag-A137R 的293T 细胞中,A137R 与Flag-Agarose 的结合物可以与纯化的MAb 反应出现特异性条带,而转染pCAGGS-Flag的293T细胞中无该特异性条带(图6)。A137R 与Flag-Agarose 结合后,MAb 可以与结合在Beads 上的A137R 反应。表明纯化的MAb 3D1 可以用于Co-IP 试验。
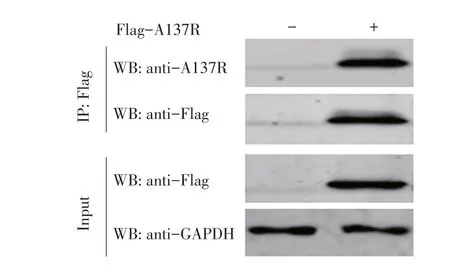
图6 MAb 3D1 用于Co-IP试验检测293T细胞中过表达的pA137RFig.6 MAb 3D1 was used to detect overexpressed pA137R in 293T cells by Co-IP assay
2.8 MAb 3D1 和2C3 表位的鉴定结果为了确定MAb 3D1 和2C3 的抗原表位,将A137R 截短为6 段进行原核表达,通过MAb 3D1 和2C3 对截短表达的多肽进行western blot 鉴定。结果显示,MAb 3D1 和2C3识别的位点分别为aa1~aa30(D1)和aa61~aa90(D11)(图7A)。进一步将D1 和D11 截短为4 段,经融合表达后再经western blot 鉴定,结果显示,MAb 3D1 和2C3 识别的位点分别位于A137R 的aa11~aa30(D10)和aa61~aa80(D13)(图7B);为了更进一步确定MAb 3D1 识别的最小表位,按照最小表位通常为10 个氨基酸的原则以1 个氨基酸为步移合成一系列多肽作为包被抗原,利用间接ELISA 检测,结果显示,MAb 3D1 识别的表位为18NFHRCAWEE26(图7C);为了明确MAb 2C3 识别的最小表位,将D13(aa61~aa80)逐步截短,并经融合表达后经western blot 鉴定,结果显示,MAb 2C3 识别的表位为64AWHEVPE CREFI75(图7D)。为验证MAb 3D1 和2C3 识别表位的正确性,将编码P1(18NFHRCAWEE26)和P2(64AWHE VPECREFI75)的基因分别克隆表达后经western blot 验证,结果显示,18NFHRCAWEE26(P1)和64AWHEVPE CREFI75(P2)确实分别为MAb 3D1 和2C3 识别的表位(图7E)。
3 讨 论
目前,ASF 呈全球蔓延之势,由于无ASF 商品化疫苗,对该疫情只能采用被动防控(扑杀)的措施,给世界猪养殖业造成了巨大的经济损失,因此,研发用于预防ASF的疫苗迫在眉睫。各种疫苗中,灭活疫苗多数保护作用较差,减毒活疫苗无法提供良好的异源保护,并可能出现副作用和毒力返强的问题,而亚单位疫苗作为一种标记疫苗,则具有研究前景。ASFV CD2v、p30 和p54 单独或联合使用以及其他亚单位疫苗均具有部分保护效果[13-14]。利用表达EP402R、p54 和p72 等基因的重组腺病毒载体疫苗和表达B646L、EP153R 和EP402R 等基因的重组牛痘病毒疫苗的“鸡尾酒”免疫后,均能够诱导猪产生较强的体液和细胞免疫应答[15-16]。制备亚单位疫苗的关键是寻找有良好免疫原性的蛋白靶标。本研究室发现A137R 能与ASFV 感染后的康复猪血清发生特异性反应,表明A137R 具有良好的抗原性。因此,本研究将A137R基因克隆到原核表达载体pET-21a 中,表达并成功纯化出高质量的rA137R,并利用rA137R 制备了鼠源MAb。
制备ASFV 蛋白的MAb 是研究该病毒基因功能的基础,也为ASFV 检测和疫苗研究提供了材料,因此,针对ASFV 蛋白MAb 的制备成为了热点。赵少若等制备的ASFV DP96R 蛋白MAb,能够特异性识别DP96R 蛋白,筛选的14 株MAb 效价均不低于1∶2 560 000[17]。赵亚茹等利用重组K205R 蛋白免疫BALB/c小鼠获得了3株MAb且均具有很好的反应性和特异性,且其效价均在1∶51 200 以上[18]。本研究以纯化的rA137R 免疫小鼠,通过间接ELISA 筛选,获得了A137R 的两株MAb 3D1 和2C3。经间接ELISA 方法检测,MAb 3D1和2C3的效价分别为1∶218和1∶217,选择效价高的3D1 用于后续鉴定试验。Western blot、IFA 和激光共聚焦试验均证明MAb 3D1 能特异性地识别在HEK293T 细胞中表达的A137R 以及ASFV 感染PAMs 后天然表达的A137R。且激光共聚焦试验结果证明,ASFV 感染PAMs 6 h 后表达A137R 并定位于PAMs 的细胞质。Co-IP 试验结果表明,制备的MAb 3D1 可以用于Co-IP 试验来鉴定p293T 细胞中过表达的A137R。
根据文献报道,通常采用western blot 鉴定MAb所识别的表位[19]。本研究在将MAb 的抗原表位定位到19 个氨基酸后,按照最小表位通常为10 个氨基酸的原则并以1 个氨基酸为步移合成一系列多肽,再通过ELISA 方法鉴定MAb 3D1 的表位,优点在于合成的多肽更加经济方便,且间接ELISA 方法敏感性更高。本试验结果显示,MAb 3D1 能与包被的多肽F6(17QNFHRCAWEE26)和F7(18NFHRCAWEET27)分 别反应,表明18NFHRCAWEE26作为多肽F6 和F7 的氨基酸重叠部分能够被MAb 3D1 识别,而MAb 2C3 识别的抗原表位为64AWHEVPECREFI75。将表达这两个表位的重组质粒分别与ASFV 康复猪血清反应,结果均未出现特异性反应,推测这两个抗原表位可能不是A137R 的免疫原性区域,也可能是由于动物种属之间的差异引起的,但这两个表位的鉴定为ASFV 的检测及疫苗研究提供了参考依据。

