伏隔核在睡眠觉醒及全身麻醉意识调控中的作用综述
张 洁,刘程曦,桂 欢,张 益
1 遵义医科大学第二附属医院 麻醉科,贵州遵义 563000;2 遵义医科大学 贵州省麻醉与器官保护基础研究重点实验室,贵州遵义 563000
伏隔核(nucleus accumbens,NAc)是位于基底神经节与边缘系统交界的重要结构,与大脑许多区域有着解剖学和功能学联系[1-2],与奖赏、成瘾、摄食、学习及睡眠-觉醒等密切相关[3-4]。随着神经环路示踪、光遗传学和膜片钳等技术的发展以及新型转基因小鼠技术的出现,NAc的功能及其相关机制的研究不断取得进展。有研究发现,光遗传特异性激活NAc内表达D1受体的神经元可延迟小鼠七氟烷麻醉诱导时间,并促进其麻醉苏醒[5],表明NAc在全身麻醉意识调控中亦有不可忽视的作用。本文围绕NAc的结构、纤维投射通路及其在睡眠觉醒和全身麻醉中的作用进行综述,以期较全面地认识NAc在意识调控中的作用。
1 NAc结构及其投射通路
1.1 NAc含有多个亚型受体 NAc由背外侧包绕前联合的核(NAc core,NAcc)以及在内侧、腹侧和腹外侧包围核的新月形壳(NAc shell,NAcsh)构成[6]。NAc约95%是中型多棘的γ-氨基丁酸(γaminobutyric acid,GABA)能神经元(striatal medium spiny neurons,MSNs),其次是GABA能中间神经元与大而无棘的胆碱能神经元,大概占5%[3,7]。NAc含有丰富的多巴胺(dopamine,DA)受体,主要为多巴胺D1受体(dopamine recepter 1,D1R)和D2受体(dopamine recepter 2,D2R)。根据特征性多巴胺受体和神经肽表达谱将MSNs分为D1RMSNs、D2R-MSNs两个不同的亚群,前者共表达强啡肽、P物质、M4胆碱能受体和腺苷A1受体(adenosine receptors 1,A1R),后者共表达脑啡肽、神经降压素和腺苷A2A受体(adenosine receptors 2A,A2AR)[3]。有报道表明,10% ~ 20% MSNs共表达D1R和D2R[3,8]。研究发现D1R密度为D2R密度的2 ~ 3倍,两种受体都表现为从NAc头侧到尾侧和从外侧到内侧的密度下降梯度[9]。
1.2 NAc与睡眠-觉醒相关核团存在纤维投射联系 随着光遗传学和化学遗传学结合转基因动物模型等创新方法的使用,关于脑区及核团在意识调控中作用的研究取得了丰硕的成果。先前的研究表明,化学遗传学抑制中脑腹侧被盖区(ventral tegmental area,VTA)多巴胺能神经元使小鼠清醒时间增加,非快动眼睡眠(non-rapid eye movement sleep,NREMs)减少[10];化学抑制或直接毁损丘脑室旁核(paraventricular thalamic nucleus,PVT)神经元,可减少小鼠在明暗周期中暗阶段的觉醒时间并降低觉醒维持能力[11];毁损外侧僵核(lateral habenula,LHb)会导致睡眠剥夺后睡眠反弹时间缩短[12]。利用全脑神经示踪技术发现NAc与脑内众多参与调控睡眠-觉醒的核团有着密切的投射联系。其最多的输入来源于海马,也是脑内多巴胺能核团黑质(substantia nigra,SN)与中脑腹侧被盖区的主要输入靶区[13]。此外,NAc还接受来自内侧前额叶皮质、前边缘皮质[3,14]、基底外侧杏仁核[3,13]、丘脑室旁核和丘脑层间核的谷氨酸能[13]、脑桥脚和外侧被盖核的胆碱能[15]、蓝斑去甲肾上腺素能[15]、下丘脑、苍白球、中脑的GABA能[14-15]以及中缝背核五羟色胺能[15]纤维的投射。同时发出纤维投射到外侧下丘脑[16]、外侧视前区[16]、外侧僵核[14]等脑区,也可通过腹侧苍白球(ventral pallidum,VP)向多巴胺能核团VTA投射[14]。NAcsh主要与下丘脑和中脑有相互的投射,而NAcc接受来自海马体和杏仁核的投射[17]。见图1。
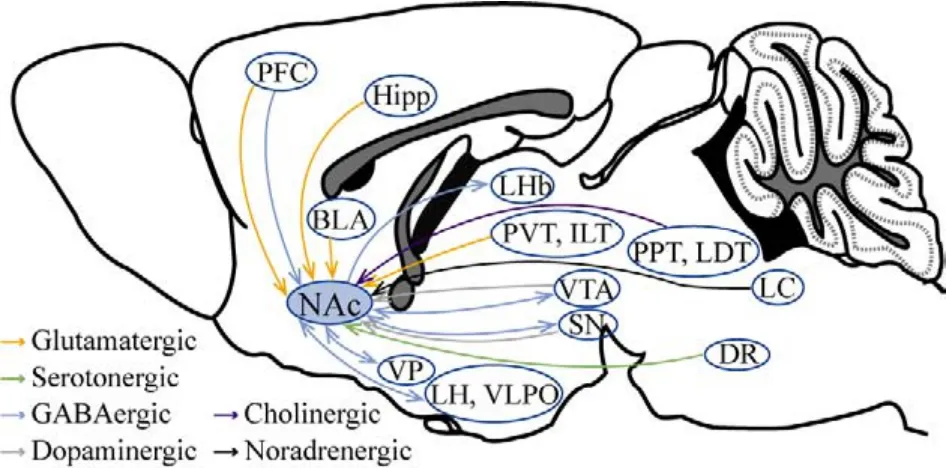
图1 NAc与脑内睡眠-觉醒相关核团的投射Fig.1 Projections between NAc and sleep-wake related nuclei in the brainBLA: basolateral nucleus of amygdale; DR: dorsal raphe nucleus; LC: locus coeruleus; LDT: laterodorsal tegmental nucleus; LH: lateral hypothalamus; LHb: lateral habenula;PFC: prefrontal cortex; PPT: pedunculopontine tegmentum;PVT: paraventricular thalamus; SNr/SNc: substantia nigra pars reticulata/compacta; Hipp: hippocampus; VLPO:preoptic area of ventral lateral hypothalamus; VP: ventral pallidum
2 NAc参与调控睡眠-觉醒
目前,有大量研究证实NAc可调控睡眠-觉醒状态的转换[4,18]。利用鹅膏蕈氨酸分别毁损大鼠NAcc及NAcsh,结果发现,与对照组相比,毁损NAcc和NAcsh分别可导致剥夺睡眠6 h后的大鼠每天总清醒度增加26.5%和17.4%,睡眠剥夺和睡眠中断后的睡眠反弹减少,但NAcc毁损有更强的促觉醒效应[19]。这可能与NAcc中DA利用率较高相关[14]。Qiu等[20]也报道,伊博丁酸对NAcc的非特异性损伤可导致觉醒程度的增加。因此,NAc在睡眠-觉醒状态转换中发挥着重要的作用。
2.1 NAcD1R、NAcD2R神经元在睡眠-觉醒中的作用 NAc中不同的多巴胺受体亚型神经元在睡眠-觉醒的调控中发挥着不同功能。体内微透析实验结合多导睡眠记录显示,NAc细胞外DA递质水平在NREM睡眠期间降低,而在清醒和快动眼睡眠(rapid eye movement sleep,REMs)期间显著升高[21],且D1R、D2R在自然睡眠觉醒过程中发挥着重要的作用[22-23]。运用光遗传学激活NAcD1R神经元可使小鼠立即从NREMs过渡到清醒状态,诱导皮质立即激活,表现为脑电图慢波活动减少;而抑制NAcD1R神经元抑制觉醒,增加筑巢行为;化学遗传学激活NAcD1R神经元同样使小鼠清醒时间增加,NREMs和REMs减少[4]。化学遗传学抑制NAcD2R神经元后小鼠觉醒增加,NREMs和REMs显著减少[4]。上述研究表明NAcD1R神经元可促进自然觉醒过程,而NAcD2R神经元发挥相反的作用,抑制觉醒过程。
2.2 NAcA1R、NAcA2AR神经元在睡眠-觉醒中的作用 目前的研究已证实脑内腺苷受体在NAc大量表达[24]。脑内腺苷通过激活腺苷A1R和A2AR诱导睡眠[25-27],且具有脑区依赖性[25]。在Lazarus等[26]的研究中,将A2AR激动剂注入基底前脑,可在NAc观察到c-Fos的表达,将其直接微注射到NAc
可诱导小鼠产生慢波睡眠。利用化学遗传或光遗传学激活NAcc的A2AR阳性神经元可诱导小鼠产生明显的慢波睡眠,而抑制该神经元可使慢波睡眠减少[18]。表明NAcA2AR神经元在睡眠诱导中发挥重要作用,但目前NAcA1R神经元在睡眠中的研究较少,其作用有待进一步探索。
2.3 NAc投射通路在睡眠-觉醒中的作用 大量研究已表明VTA多巴胺能神经元发挥促进觉醒的作用[10,28-29]。而VTA参与睡眠-觉醒状态的调控主要由VTA-NAc的投射介导[10]。光遗传学激活NAc内VTA多巴胺能投射末梢可促进小鼠从NREMs转为觉醒,且觉醒总时间增加[10],提示激活VTANAc多巴胺能通路可能通过激活VTADA神经元作用于NAc中多巴胺受体产生促觉醒效应。NAc和VTA相互连接,形成一个控制清醒状态的NAcGABA-中脑GABA-VTADA-NAcGABA环路。激活从NAc到中脑的抑制性投射,通过抑制GABA神经元,解除DA神经元抑制,增加NAc中DA的释放,释放的DA作用于D1R和D2R,激活D1R神经元,抑制D2R神经元,从而促进觉醒,这可能是一个正反馈过程[4]。同时机体通过睡眠物质腺苷的调节平衡睡眠觉醒,维持睡眠稳态。此外,有研究发现,PVT终末释放的谷氨酸调节NAc多巴胺的释放[30]。光激活PVT-NAc的投射通路诱导小鼠从NREMs和REMs到清醒的转换,化学遗传学抑制该通路降低觉醒水平;毁损NAc神经元后,PVT诱导觉醒的作用减弱[31],提示该通路可能是PVT调控觉醒的效应通路。另有研究采用顺行和逆行示踪、电生理方法等证实了VP的最大输入来自NAc,且80%以上为GABA能投射神经元[2]。NAcA2AR神经元对VPGABA能神经元的抑制性投射,已被证实在促进NREM睡眠中发挥了关键作用[32]。而化学遗传或光遗传技术激活VPGABA能神经元与启动和(或)维持觉醒相关[33]。在探究NAcD1R神经元促觉醒的可能机制的研究中,以20 Hz光刺激激活NAcD1R神经元分别投射到中脑和LH的轴突末梢,诱导小鼠从NREMs向清醒的转变,清醒总时间分别增加了86.4% 和79.4%,表明NAc-中脑、NAc-LH环路介导了NAcD1R神经元对觉醒的调控;在该研究中,化学遗传学激活NAcD1R神经元后,观察到LH食欲素能神经元c-Fos表达增加,因此NAcD1R-LH环路参与觉醒调控可能部分是因为激活了LH中促觉醒的食欲素能神经元[4,34]。综上所述,NAc中各亚型神经元可通过脑内多个核团的投射参与调节睡眠-觉醒过程,主要发挥促进觉醒作用。
3 NAc参与全身麻醉意识的调控
全身麻醉已广泛应用于临床,但全身麻醉药导致可逆性意识消失的机制至今仍不明确。研究发现,在全身麻醉中,大脑的觉醒系统均处于受抑制的状态[35]。而且全身麻醉引起的神经电活动与睡眠类似,如α振荡与梭形波[35-36],提示全身麻醉导致的可逆性意识消失可能受到睡眠-觉醒核团或通路活性变化的调节。利用光纤钙信号技术监测到丙泊酚麻醉诱导期的大鼠NAc中神经元钙信号活性下降,并在麻醉苏醒期恢复,表明丙泊酚麻醉抑制了NAc神经元的活性[37]。在NAc区域微注射D1R激动剂,可促进小鼠在异氟醚麻醉下的苏醒,皮质脑电显示δ波减少,γ波增加,给予D1R拮抗剂可使其苏醒时间延迟[17],说明NAc也参与了全身麻醉意识的调控。
3.1 NAc中D1R/D2R、A1R/A2AR在全身麻醉意识调控中的作用 Bao等[5]利用光纤钙信号技术发现七氟烷诱导及维持期间NAcD1R神经元钙信号活性下降,神经元活性降低;苏醒期钙信号活性上升神经元活性增加。本课题组前期研究发现,在NAc中微注射D1R选择性激动剂明显缩短丙泊酚麻醉苏醒时间,皮质脑电图δ波段功率下降,β波段功率增加,且能通过D1R拮抗剂预处理来阻止。随后利用膜片钳全细胞记录发现,丙泊酚增加了NAcD1R神经元的抑制性突触后电流(inhibitory postsynaptic current,IPSC)的频率和衰减时间,D1R激动剂减弱了丙泊酚对IPSC频率的影响,并通过预先应用D1R拮抗剂消除了激动剂的影响,但给予D2R激动剂或拮抗剂后小鼠行为学及脑电无明显变化[37]。可能是D1R选择性激动剂激活多巴胺D1受体,可引起NAc神经元去极化和向内电流,从而激活D1-MSNs,通过其直接投射的中脑促觉醒区域,如VTA,产生促觉醒效应。在NAc腺苷受体的研究中,使用高选择性A2AR激动剂CGS21680显著延长丙泊酚诱导意识消失的时间,增加伏隔核c-Fos的表达,抑制了伏隔核-中缝背核和伏隔核-扣带回皮质的功能连接;而A2AR拮抗剂SCH58261产生了相反的作用[38]。但目前关于NAc内A1R在全身麻醉中的作用未见报道。综上所述,NAc可能通过其神经元表达的受体参与全身麻醉意识的调控,其中D1R促进觉醒,A2AR诱导睡眠,D2R、A1R在全身麻醉意识调控中的作用需进一步研究。
3.2 NAc投射通路在全身麻醉意识调控中的作用 本课题组前期研究中利用光遗传学和化学遗传学激活VTA-NAc多巴胺能通路,延长了小鼠七氟烷麻醉的诱导时间,明显缩短其苏醒时间,皮质脑电图δ波段减少,γ波段增加,抑制该通路产生相反的作用[21]。说明VTA-NAc多巴胺能通路调控七氟烷麻醉的诱导及觉醒过程。Qiu等[39]的研究中腹腔给予右美托咪定后,化学遗传学激活或抑制小鼠VTADA神经元后脑电图慢波活动相应减少或增加;同时采用多巴胺递质探针记录到腹腔注射右美托咪定后内侧前额叶皮质和NAc内多巴胺递质增加,说明右美托咪定可激活VTA多巴胺神经元,增加相关前脑投射区多巴胺浓度,使右美托咪定镇静深度减弱,降低唤醒阈值,这从一定程度上解释了右美托咪定镇静易唤醒的原因,也说明了VTA-NAc多巴胺能通路在促进全身麻醉觉醒中起着重要作用。另有研究发现抑制NAc-VP的输出通路可延迟小鼠从氟烷或戊巴比妥麻醉中苏醒,使全身麻醉的效应增强[40]。因此NAc-VP投射通路也参与了全身麻醉的觉醒调控过程。
4 结语
综上所述,NAc含有多种神经元亚型及神经投射,其中NAcD1R及NAcA2AR神经元发挥促进觉醒和诱导睡眠的作用,并且NAc可通过与VTA及VP等核团的投射参与睡眠-觉醒及全身麻醉的调控,但NAc其他亚型神经元及神经投射在睡眠觉醒及全身麻醉的调控中的作用目前仍不明确。本文综述NAc在脑内的解剖结构及其在睡眠-觉醒和全身麻醉中的调控作用,为睡眠障碍相关疾病的治疗以及寻找全身麻醉药物的作用机制提供理论依据。

