胃癌患者完全3D腹腔镜与腹腔镜辅助全胃切除、食管空肠Roux-en-Y吻合术围术期疗效比较
刘帛岩,高子贺,林海冠,李松岩
1 解放军总医院第一医学中心 普通外科医学部,北京 100853;2 战略支援部队特色医学中心,北京 100101
近年来我国胃癌发病率不断增长,已成为发生率第3位的恶性肿瘤[1]。同时,胃癌根治术的研究取得重大进展,癌灶根治率和患者远期生存率均有显著提高,尤以腹腔镜手术为代表的微创术更具优势[2]。全胃切除术主要应用于贲门、胃底、胃体上部的恶性肿瘤[3-4]。腹腔镜辅助全胃切除术具有术中出血少、腹部切口小、术后患者疼痛感轻、消化道功能恢复快及住院时间短等优点[5],已被广泛认可。随着手术技术的革新,完全腹腔镜全胃切除术也逐渐成熟。有研究报道,完全腹腔镜全胃切除术手术创伤更小,出血更少,淋巴结清扫更彻底[6]。但比较两种手术方式围术期安全性及临床疗效等方面的研究仍较少。本研究对根治性全胃切除、食管空肠Roux-en-Y吻合术治疗的155例胃癌患者的临床资料进行分析,通过对比围术期疗效,探讨完全腹腔镜根治性全胃切除术的安全性及可行性。
资料与方法
1 患者资料 选取解放军总医院第一医学中心2018年1月- 2020年12月接受完全3D腹腔镜全胃切除手术和腹腔镜辅助全胃切除手术的胃癌患者临床资料,纳入标准:1)年龄18 ~ 75岁;2)体质量指数(body mass index,BMI)18.5 ~ 30.0 kg/m2;3)经组织学或细胞学诊断确诊为胃癌;4)术中清扫范围包括第二站淋巴结;5)临床分期为T1-4N0-2M0;6)手术采用完全3D腹腔镜全胃切除手术或腹腔镜辅助全胃切除手术。排除标准:1)因出血、穿孔、梗阻等行急诊手术;2)术前影像学检查发现肿瘤远处转移。
2 手术方式 1)完全3D腹腔镜全胃切除术:腹腔镜手术设备为OLYMPUS公司生产的3D腹腔镜成像系统,包括所有腹腔镜技术需要的标准配置,术中所用超声刀为强生公司生产。患者全麻气管插管成功后取平卧位,双腿分开。常规消毒铺无菌单,取脐下长约1 cm横行切口,布巾钳提起腹壁,小心穿刺置入气腹针建立气腹,保持二氧化碳气腹压力为12 mmHg (1 mmHg=0.133 kPa),拔除气腹针并穿刺置入10 mm Trocar,由此送入腹腔镜镜头进行腹腔探查。探查完毕后电视监视下于右上腹部分别置入10 mm和5 mm Trocar,左上腹分别置入12 mm和5 mm Trocar,分别送入超声刀及无创抓钳进行手术操作。以超声刀沿横结肠上缘切开胃结肠韧带,打开小网膜腔,并继续切开胃结肠韧带,向右至肝结肠韧带,向左至脾结肠韧带,游离切开脾胃间韧带,分离出胃网膜左动、静脉,切断并用外科夹夹闭上述血管,清除周围淋巴脂肪组织。游离出胃短血管,以超声刀切断并以外科夹结扎胃短血管,继续向上游离至食管左侧,清扫第2组淋巴结及周围脂肪组织。暴露胰头,游离出胃网膜右动脉及胃网膜右静脉,切断并结扎上述血管,清扫第6组淋巴结及周围脂肪组织。将游离好的胃及大网膜向上挑起,显露胰腺上缘。分离脂肪组织并暴露肝固有动脉、胃右动脉、肝总动脉,仔细解剖出胃左血管,于根部切断结扎胃左血管,清除周围淋巴脂肪组织。于根部切断、结扎胃右动脉,清扫第5组淋巴结及周围脂肪组织,清扫第8a组、9组、10组、11组、12a组淋巴结及周围脂肪组织,游离十二指肠上段(图1A)。肝下缘切断胃小网膜,向右分离至肝十二指肠韧带左侧缘,向左分离至贲门区。显露并游离贲门部,清扫第1组淋巴结及周围脂肪组织,充分游离食管下段约6.0 cm,以超声刀锐性切断迷走神经前后干,于幽门下2 cm处用直线切割闭合器切断闭合十二指肠。将胃管前端退至食管内,于贲门上1 cm处用直线切割闭合器切断闭合食管(图1B)。距离Treitz韧带约30cm处用直线切割闭合器切断闭合空肠。将切除标本装入取物袋内,解除气腹。取上腹部正中切口长约5 cm,逐层切开进入腹腔。取出取物袋及标本。经过切口提出远近端空肠断端,松解空肠相应系膜,距远断端空肠50 cm处置入直线切割闭合器与近断端空肠行侧侧吻合,全层连续缝合空肠共同开口,吻合口、共同开口及断端浆肌层缝合加固,关闭肠系膜裂孔。重建气腹,距离近断端空肠10 cm对系膜缘作一小切口并置入直线切割闭合器钉砧与食管行侧侧吻合(图1C),腔镜下缝合食管与空肠共同开口(图1D),重置胃管,行注气实验,检查吻合口无漏气,再次检查各吻合口通畅,无张力。严格止血,大量蒸馏水冲洗并浸泡腹腔后0.9%氯化钠注射液冲洗腹腔,于吻合口左右两侧分别放置一根粗乳胶引流管并分别从左右腹壁Trocar口引出固定,再次检查腹腔内无活动性出血,吻合口周围及手术创面放置可吸收止血材料,肝表面留置氟尿嘧啶缓释剂1 g,逐层关腹并逐一缝合腹部各Trocar口。术毕。
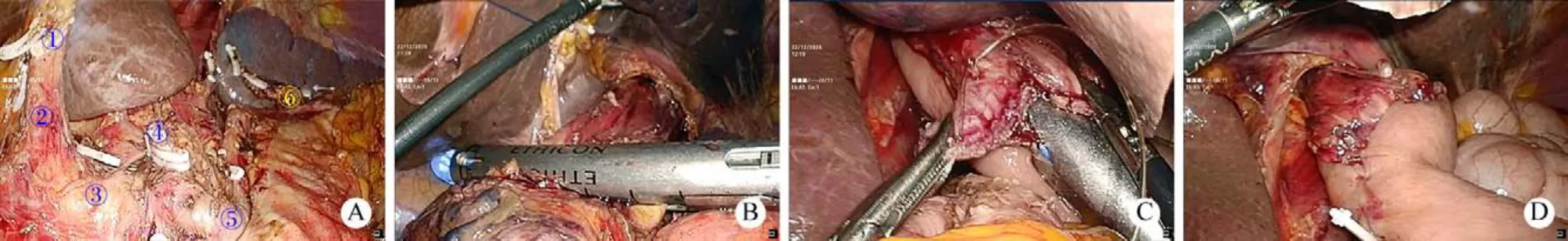
图1 完全3D腹腔镜全胃切除术手术关键步骤A:清扫胰腺上缘及脾门淋巴结(①胃右动脉断端;②肝固有动脉;③肝总动脉;④胃左动脉断端;⑤脾动脉主干;⑥脾动脉分支);B:闭合切断食管;C:食管空肠吻合;D:缝合食管空肠共同开口Fig.1 The key procedures of complete 3D laparoscopic total gastrectomyA: Dissect upper margin of pancreas and hilar lymph nodes (①broken end of right gastric artery; ②proper hepatic artery; ③common hepatic artery; ④broken end of left gastric artery; ⑤trunk of splenic artery; ⑥branches of splenic artery); B: Close and cut esophagus;C: Esophagojejunal anastomosis; D: Suture the common esophagojejunum opening
2)腹腔镜辅助全胃切除术:手术设备与完全3D腹腔镜全胃切除术一致。淋巴结清扫及手术步骤至切断食管前同完全3D腹腔镜全胃切除术。取上腹部正中切口长约10 cm,逐层切开进入腹腔。将游离好的全胃及网膜提至腹腔外,将胃管前端退至食管内,在贲门上约2 cm置荷包钳并置荷包缝合线,切断食管移走大体标本。碘伏消毒食管断端后置入24号胃肠吻合器抵针座,收紧荷包线留待吻合用(图2A)。浆肌层缝合加固十二指肠残端。距离Treitz韧带约30 cm处用直线切割闭合器切断闭合空肠。距远断端空肠50 cm处置入直线切割闭合器与近断端空肠行侧侧吻合,缝合空肠共同开口,吻合口、共同开口及断端浆肌层缝合加固,缝合关闭肠系膜裂孔。自远断端空肠5 cm置入24号胃肠吻合器与食管预置抵针座衔接,行食管空肠吻合(图2B),重置胃管检查吻合口通畅,距离食管空肠吻合口约3 cm用直线切割闭合器切断闭合空肠(图2C),吻合口及断端浆肌层缝合加固(图2D)。再次检查各吻合口通畅,无张力。严格止血,大量蒸馏水冲洗浸泡腹腔后0.9%氯化钠注射液冲洗腹腔,于吻合口左右两侧分别放置一根粗乳胶引流管并分别从左右腹壁Trocar口引出并固定,再次检查无活动性出血,吻合口周围及手术创面放置可吸收止血材料,肝表面留置氟尿嘧啶缓释剂1 g,逐层关腹并逐一缝合腹部各Trocar口。术毕。

图2 腹腔镜辅助全胃切除术手术重要步骤A:食管断端置入吻合器钉座;B:食管-空肠吻合;C:闭合空肠开口;D:加固空肠残端及吻合口Fig.2 The important procedures of laparoscopic-assisted total gastrectomyA: Stapler seat was inserted at the broken end of esophagus; B: Esophagus-jejunum anastomosis; C: Close the jejunal opening;D: Reinforce jejunum stump and anastomosis
3 观察指标 比较两组手术持续时间、术中出血量、腹部切口长度、术后胃管留置时间、术后首次排气时间、总住院时间、吻合口瘘发生率、吻合口出血发生率、十二指肠残端瘘发生率、术后病理切缘阳性率、淋巴结检出数及阳性率。
4 统计学分析 使用SPSS20.0软件进行统计分析。分类变量使用例数(百分数)描述,使用χ2检验或Fisher精确检验。连续变量以±s表示,使用t检验或χ2检验。P<0.05为差异有统计学意义。
结 果
1 两组一般资料比较 共纳入符合条件患者155例,其中完全3D腹腔镜全胃切除手术组87例(T组),腹腔镜辅助全胃切除手术组68例(L组)。所有患者术后均按照NCCN指南进行治疗。两组年龄、性别、ASA分数、BMI及术后病理TNM分期差异均无统计学意义(P>0.05),而T组腹部手术史少于L组(P<0.05)。见表1。

表1 两组胃癌患者一般资料比较Tab. 1 Comparison of general data between the two groups
2 两组围术期指标比较 两组手术时间比较,差异无统计学意义(P>0.05)。但T组在术中失血量及手术切口长度上小于L组(P<0.001)。T组术后拔除胃管时间为术后1 d左右,而L组多在3 d以上。同时,T组术后排气时间也较L组早,因而早期进食流食时间也较早。此外,T组的住院时间也较L组短(P<0.001)。见表2。
3 两组术后早期并发症比较 155例中仅1例(L组)发生术后吻合口瘘。该患者合并高血压及糖尿病,术后5 d发现吻合口瘘,后经过放置空肠营养管给予肠内营养支持及腹腔引流管持续冲洗,痊愈出院。两组术后均未发生切口感染,故两组术后早期并发症差异无统计学意义。
4 两组切缘阳性率、淋巴结检出率及淋巴结阳性率比较 术后病理回报显示155例均未出现切缘阳性的情况。在淋巴结检出方面,完全3D腹腔镜全胃切除术检出淋巴结数较腹腔镜辅助全胃切除术多,但差异无统计学意义(P>0.05)。两组阳性淋巴结检出率差异无统计学意义(P>0.05)。见表2。

表2 两组患者围术期指标比较Tab. 2 Comparison of perioperative indicators between the two groups
讨 论
随着腹腔镜技术的发展,其“创伤小、恢复快”的微创优势与现阶段外科医师所追求的快速康复理念不谋而合,外科医师通过腹腔镜技术的优势来减少传统开腹手术所带来的创伤、疼痛,从而减少患者的痛苦,同时缩短术后恢复时间及住院时间[7]。国内外一系列多中心前瞻性随机对照研究证实了在治疗早期胃癌方面,腹腔镜手术与开腹手术有相同的安全性、近期疗效、肿瘤根治性及远期生存率[8-10]。对于进展期胃癌,一项关于根治性腹腔镜全胃切除术与开腹手术疗效比较的研究显示,腹腔镜组与开腹组淋巴结清扫数目差异无统计学意义[11]。
患者的自身因素也决定了手术方式的选择。本研究结果显示,既往存在腹部手术史的患者,更多采用腹腔镜辅助方式完成手术。其主要原因可能在于存在既往腹部手术史的患者腹腔往往粘连较重,增加了手术难度与风险。同时,既往腹部手术史也会改变手术相关解剖结构,为了患者手术安全性考虑,手术医生更加倾向选择腹腔镜辅助的手术方式。
目前常用的全胃切除术的消化道重建术式以食管-空肠Roux-en-Y吻合为主[12-13]。本文纳入的病例均采用此种重建方式。完全腹腔镜全胃切除术食管空肠常用重建方式主要包括圆形吻合、线形吻合和手工吻合[14]。本研究中T组应用食管空肠侧侧交叠吻合法(Overlap),其主要优点包括无须荷包缝合、吻合口直径较大等,特别适用于术区暴露难度大的患者[15]。然而,这种吻合方式需要保留较长食管下端,这也是本研究中T组游离食管断端较长的原因之一。对于肿瘤累及食管下段的患者,手术时应充分游离食管,预留足够的长度完成吻合。若术中怀疑肿瘤侵犯食管下段较高,应及时开胸完成手术。
完全腹腔镜全胃切除术和腹腔镜辅助全胃切除术都是治疗胃癌的常规方法。本研究显示,完全腹腔镜全胃切除术在保证安全性的前提下具有患者痛苦小、术后恢复快等优点。两种术式的区别主要体现在消化道重建的过程中,所以重建的难度等因素也成为了选择两种手术方式的重要指标。BMI过高的患者,内脏脂肪多,腹腔空间较小,重建消化道时难度较大;胸廓狭窄的患者往往肋弓较低影响操作,在游离食管下段时困难较大。同时在利用腔镜下直线切割闭合器进行镜下消化道重建时,也会面临较大困难。对于此类患者,应及时调整手术方式。
本研究还存在以下问题值得进一步探讨:1)病例总数的限制决定了其研究的局限性,与之伴随的包括术后康复速度、手术时间、手术创伤等因素的分析均在一定程度上受到了约束。2)T组术后病理回报中淋巴结检出率较L组高,而两组手术的差异始于消化道重建部分,前期的淋巴结清扫步骤基本没有差异。我们推测,这可能与T组手术过程中食管游离长度更长从而使淋巴结清扫更为彻底有关。另外还有研究分析“线性吻合器通常放置在切除线的两侧,并且可能会妨碍到切缘附近的组织的病理学评估”[16]。但对出现这一结果的具体可能原因,学界仍未得出明确的解释。
综上所述,与腹腔镜辅助全胃切除术相比,完全3D腹腔镜全胃切除术是一种完全可行的术式。此种术式不仅可以为术者提供更清晰细致的手术视野,还同时具备手术创伤小、患者痛苦轻、术后恢复快等优势。未来应更加关注两种手术的安全性及有效性研究,特别是远期疗效研究,明确不同手术方案的适应人群,为不同患者个性化治疗提供基础。

