TBP-D2EHPA协萃体系分离盐湖卤水中锂镁
王德卿 王海北, 谢 铿 王子豪
(1.北京矿冶研究总院,北京 102628;2.矿冶科技集团有限公司,北京 100160)
我国卤水锂资源较为丰富,居世界第四位,总量达388.9万t(以Li计,下同),占我国锂资源总量的71.9%[1]。其中青海盐湖卤水锂资源储量为59.94万t[2]。中国目前已经成为全球第一大锂盐生产国和消费国,随着锂矿开采加工的工艺及环境成本不断上升,锂资源开发利用的重心逐渐转向成本低、能耗低、资源量大的盐湖提锂,开展盐湖卤水提锂技术研究具有重要意义。
卤水提锂的方法主要有碳酸盐沉淀法、离子交换吸附法、电渗析法、膜法、萃取法、煅烧法等[3]。其中,萃取法具有选择性高、生产设备结构简单、易于操作维护等优点,在我国青海高镁锂比盐湖卤水开发上具有诸多优势,极具发展潜力。国内外学者围绕盐湖卤水萃取提锂进行了广泛研究。NELLI等[4]针对高镁锂比卤水,首先提出有机溶剂萃锂工艺,使用20%TBP-80%二异丁基酮萃取体系,添加FeCl3促进锂萃取,开创了TBP-FeCl3萃取体系。1980年,黄师强等[5]进行从大柴旦盐湖卤水中萃取锂的研究,使用TBP-FeCl3体系,以盐湖中天然的高浓度MgCl2作为盐析剂,萃锂效果显著。此后诸多学者对TBP-FeCl3体系进行了优化与改进。朱慎林等[6]比较了3种中性磷类萃取剂TBP、DBBP和TOPO在FeCl3存在情况下的萃锂效果,发现TBP的萃取效果最好,并得到了萃取最优条件。许庆仁[7]构建了20%N503-20%TBP-煤油萃取体系,使用浓盐酸进行反萃。在此基础上,时东等[8]研究了N523-TBP混合萃取体系,发现FeCl3是最佳的共萃剂,卤水中MgCl2是萃取锂天然的最佳盐析剂,N523-TBP不适于从含钙较高的卤水中萃取锂。陈正炎等[9-12]研究了SK-SE萃取体系并分析了萃取机理。孙锡良等[13]研究了TBP-溶剂汽油体系,锂的单级萃取率可达到70%。JI等[14]使用40%TBP-20%DOP萃取体系,经3段逆流萃取,锂萃取率达99.5%,降低了TBP浓度同时避免了三相生成,减少了有机相在水中溶损。
矿冶科技集团有限公司(原北京矿冶研究总院)在盐湖卤水萃取分离锂镁方面取得了一些优异的研究成果。针对青海大柴旦盐湖资源,使用TBP-FeCl3体系,首次将厢式串级萃取槽应用于工业化提锂,建成了年产1万t高纯氯化锂联产2.5万t精硼酸工程[15]。谢铿等[16,17]使用A1416从混盐型高锂卤水中萃取分离硼并优选了TBP-MIBK体系萃取锂,改善了相分离性能和消除了第三相的产生,在较低TBP浓度时构建了稳定的液-液两相萃取体系,锂的单级萃取率大于79%。薛宇飞等[18-20]研究了40%TBP-20%MIBK-40%260#溶剂油萃锂工艺,优化条件下锂的单级萃取率达90%,同时研究了TBP-BA及TBP-NX混合萃取体系萃取锂,并根据氯桥理论及离子缔合萃取理论分析了LiFeCl4的共萃取现象。TBP-协萃剂-FeCl3体系萃锂技术发展至今仍面临着一些问题,如TBP浓度较低时易出现第三相、高浓度TBP对设备溶胀腐蚀、TBP高酸度中易降解、反萃过程高酸度对设备腐蚀、萃取工艺流程长、有机相再生消耗试剂多等。基于此前研究,本文筛选出具有纯水温和反萃与有机相直接回用等优势潜质的TBP-D2EHPA-FeCl3协萃体系,优化了其萃取和反萃效果。
1 实验方法
1.1 原料及试剂
实验原料为兴华锂盐有限公司提供的青海某盐湖酸化除硼后老卤,pH值约2.0,主要成分及含量见表1。使用的试剂主要有工业纯二(2-乙基己基)磷酸酯(D2EHPA)、260#溶剂油,以及分析纯FeCl3·6H2O。

表1 盐湖酸化除硼后老卤成分
1.2 实验方法
有机相由TBP、D2EHPA、260#溶剂油按一定体积比配制,水相为酸化除硼后盐湖卤水按一定铁锂摩尔比加入FeCl3·6H2O。有机相及水相按一定相比加入分液漏斗,在恒温分液漏斗振荡器中振荡10 min,静置分层后记录分相情况及分相所用时间。取下层水相,测定离子质量浓度。反萃实验使用去离子水作为反萃剂,将萃取实验后的负载有机相及去离子水按一定相比加入分液漏斗中,在恒温分液漏斗振荡器中振荡10 min,取下层水相,测定离子质量浓度。
2 结果与讨论
2.1 萃取实验
2.1.1 TBP-260#溶剂油萃取实验
首先进行不添加协萃剂的对照实验,固定Fe/Li摩尔比为1.3、相比O/A=2、卤水pH=2.0,改变TBP的体积分数并研究其对锂镁萃取分离效果的影响,实验结果如图1所示。
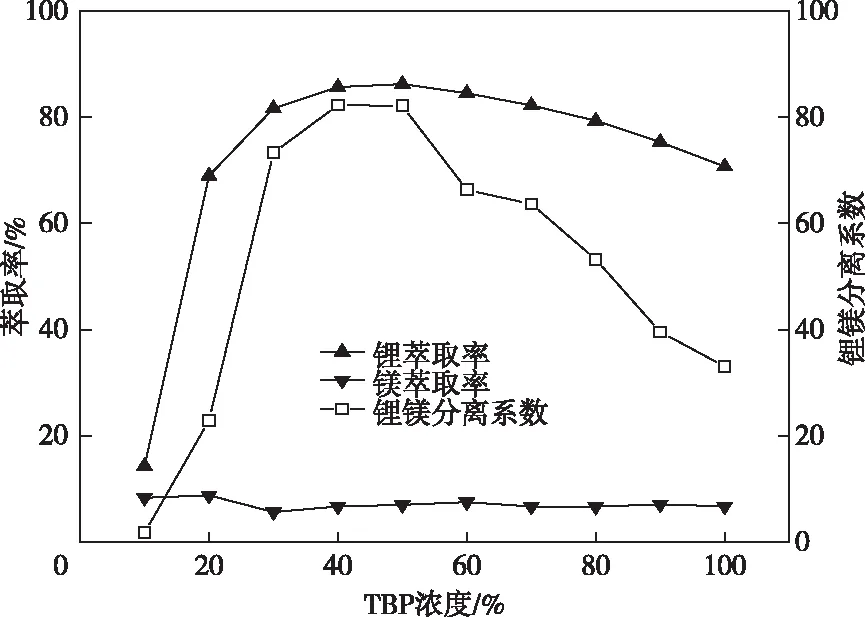
图1 TBP浓度对锂镁萃取的影响Fig.1 Effects of TBP concentration on lithium and magnesium extraction
从图1可以看出,当TBP浓度低于20%时,锂未能被有效萃取到有机相;低于50%时出现第三相,原因是Li萃合物在有机相中溶解度较低[21]。TBP浓度在50%时萃取性能最佳,达86.20%。锂镁分离系数达82.1,分相完全且分相速率快。TBP浓度高于50%时后萃取率缓慢下降,纯TBP萃取时萃取率仅70.69%。各浓度条件下Mg萃取率基本稳定在7%左右。锂镁分离效果取决于Li萃取率,因此锂镁分离系数下降。据此协萃体系成分选择围绕低于60%TBP浓度展开。
2.1.2 有机相组成配比对萃取效果的影响
萃取有机相由TBP、D2EHPA、260#溶剂油组成,三者的体积比对体系的萃取反萃能力以及分相速率有一定影响。固定Fe/Li摩尔比为1.5、相比O/A=2、卤水pH=2.0、D2EHPA浓度为20%,改变TBP的浓度进行萃取实验,实验结果如图2所示。
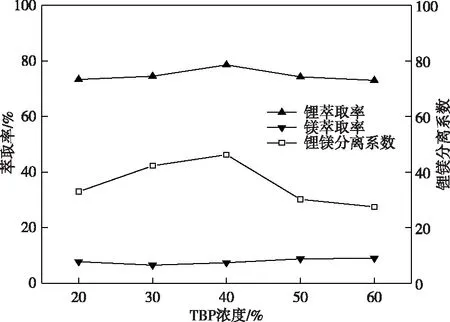
图2 添加D2EHPA后TBP浓度对锂镁萃取的影响Fig.2 Effects of TBP concentration on lithium magnesium extraction after adding D2EHPA
加20% D2EHPA作为协萃剂后,对比单纯TBP萃取,出现三相的TBP浓度从50%下降到20%,TBP萃取过程的分相情况得到了改善。从图2可以看出,TBP浓度为40%时,萃取效果最好,锂萃取率达78.56%,锂镁分离系数为46.26,在1 min内基本分相完全。提高TBP浓度至60%,锂萃取率下降至72.99%,镁萃取率由7.34%升至8.96%,导致锂镁分离系数大幅下降至27.45。且TBP浓度升高增加液相黏度、降低两相密度差,不利于分相,加剧设备溶胀损耗降低使用寿命。综上原因,选择协萃体系中TBP浓度为40%。
固定Fe/Li摩尔比为1.5、相比O/A=2、卤水pH=2.0、TBP浓度为40%,改变D2EHPA的浓度进行萃取实验,实验结果如图3所示。
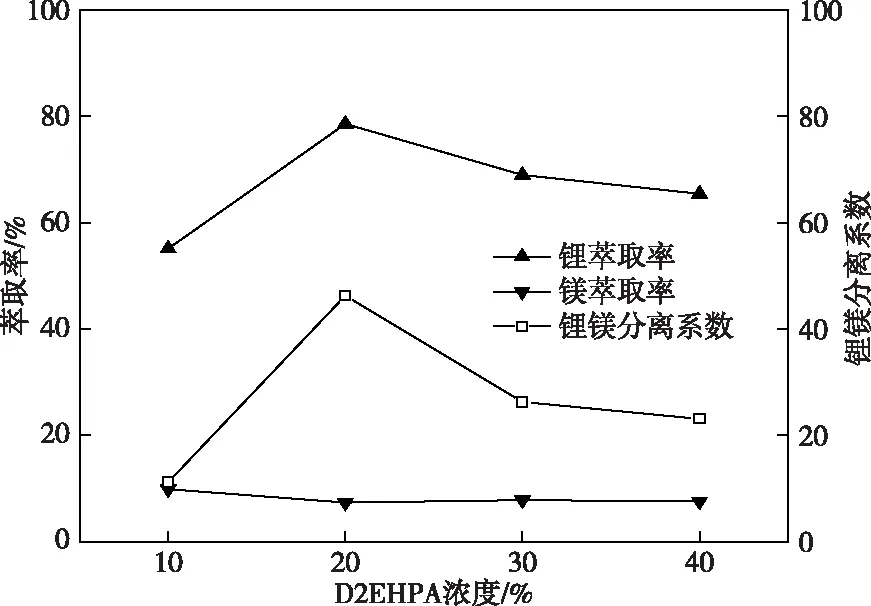
图3 D2EHPA浓度对锂镁萃取的影响Fig.3 Effects of D2EHPA concentration on lithium magnesium extraction
从图3可以看出,添加20% D2EHPA时,萃取效果最好,锂萃取率达78.56%,锂镁分离系数为46.26,在1 min内基本分相完全。提高D2EHPA浓度至40%,则锂萃取率下降至65.41%,锂镁分离系数大幅下降至23.10。综上原因,协萃体系中添加20% D2EHPA是合适的。
对比不加协萃剂的TBP-260#溶剂油萃取实验,添加D2EHPA对锂萃取有一定抑制作用。因为D2EHPA属于弱酸性磷萃取剂,其羟基氢会部分游离在水相中,由于H+与Li+在萃取过程中的竞争关系[22],水相H+离子浓度升高进而导致Li+的萃取率下降。但是,D2EHPA添加后可改善低浓度TBP萃锂出现三相的问题,与其它协萃剂相比,D2EHPA与TBP结构相似,对Fe3+有着优异的协同萃取效应,能够增强萃取过程。经过上述实验,优选有机相组成为40%TBP-20%D2EHPA-40% 260#溶剂油。
2.1.3 铁锂摩尔比对萃取效果的影响
固定萃取条件有机相组成为40%TBP-20%D2EHPA-40% 260#溶剂油、相比O/A=2、卤水pH=2.0等条件,改变水相中Fe/Li摩尔比分别为1.0、1.3、1.5、1.7、2.0、2.5,实验结果如图 4 所示。
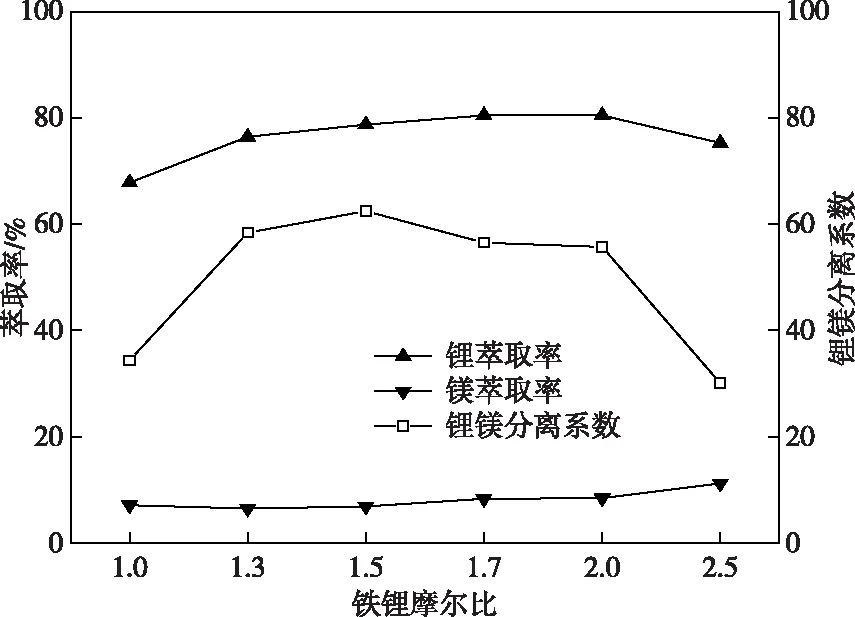
图4 铁锂摩尔比对锂镁萃取的影响Fig.4 Effects of iron lithium molar ratio on lithium magnesium extraction
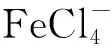
2.1.4 萃取相比对萃取效果的影响
有机相组成为40%TBP-20%D2EHPA-40% 260#溶剂油,在Fe/Li摩尔比1.5、卤水pH=2.0固定萃取条件下,改变有机相与水相相比(O/A)分别为0.5、1.0、1.5、2.0、2.5、3.0,实验结果如图5所示。
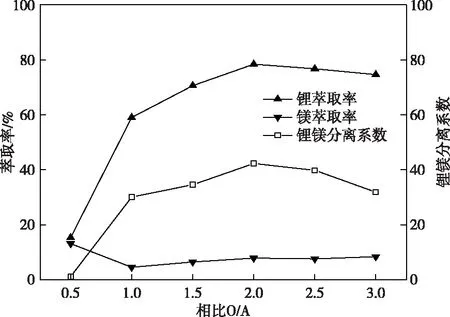
图5 萃取相比对锂镁萃取率和锂镁分离系数的影响Fig.5 Effects of phase ratio on Li-Mg extraction rate and Li-Mg separation coefficient
从图5可以看出,随有机相与水相相比(O/A)增大,Li+单级萃取率从O/A =0.5时的15.36%快速升高至O/A=2.0时的78.40%,随后开始略微下降。O/A 从1.0变化至3.0的过程中,Mg2+萃取率从4.58%上升至8.44%。锂镁分离系数在O/A=2.0时取得最大值42.29,之后开始下降。这是由于随着相比增大,有机相中萃取剂TBP物质的量增多,萃取Li+及Mg2+等杂质离子的能力均变强;但同时有机相中协萃剂D2EHPA物质的量也增加,导致解离到水相中的H+增多,额外的HFeCl4也参与到LiFeCl4及Mg(FeCl4)2的竞争萃取过程中,降低了萃取Li+的能力。综合锂的萃取率、锂镁分离系数以及有机试剂用量等因素,萃取实验中优选相比(O/A)为2.0。
2.2 洗涤与反萃实验
首先在有机相组成为40%TBP-20% D2EHPA-40% 260#溶剂油、固定Fe/Li摩尔比为1.5、相比O/A=2、水相pH=2.0、常温20 ℃、振荡10 min的优选条件下,对卤水进行萃取实验,对得到的负载有机相进行接下来的洗涤实验。
图6给出的是洗涤相比对锂、镁、铁洗涤的影响结果。从图6可以看出,与萃取过程优先萃取Li+相反,洗涤过程中Mg2+被优先洗涤出来。随着相比O/A增大,Mg2+洗涤率先增大后逐渐降低,在O/A=15时达到最大值82.63%,但此时Li+洗涤率也高达60.85%,不利于二者通过洗涤分离。随着相比O/A增大,Li+洗涤率基本呈现先快速下降,后缓慢下降趋近于0的趋势,O/A=3时为最大值84.48%,O/A=60时反萃率下降到仅为3.09%。这是因为,随着相比增大,进入水相的MgCl2浓度增大,反应及扩散的浓差驱动力降低,Mg2+洗涤率下降。随着进入水相的MgCl2浓度增大,水相中Cl-浓度也明显增大,相较于Mg2+自身更加显著的抑制了一价阳离子Li+的洗涤,所以Li+洗脱率呈快速下降的趋势。高相比洗涤过程中,O/A=60时,Mg2+洗涤率为45.07%,Li+洗涤率为3.09%,锂镁分离系数为25.7。在O/A=30~60时,Fe3+洗涤率低于0.1%基本不被洗涤;锂镁分离效果较好,该范围内相比较低时,Mg2+洗涤率较高,但是Li+洗脱率也相对较高;相比较高时Mg2+洗涤率中等,Li+洗脱率相当低,可通过增加洗涤级数增强洗涤效果,但进一步增加洗涤相比将导致相比过大,传质困难,分相速度慢等问题,综合考虑确定O/A=60为最佳洗涤相比。
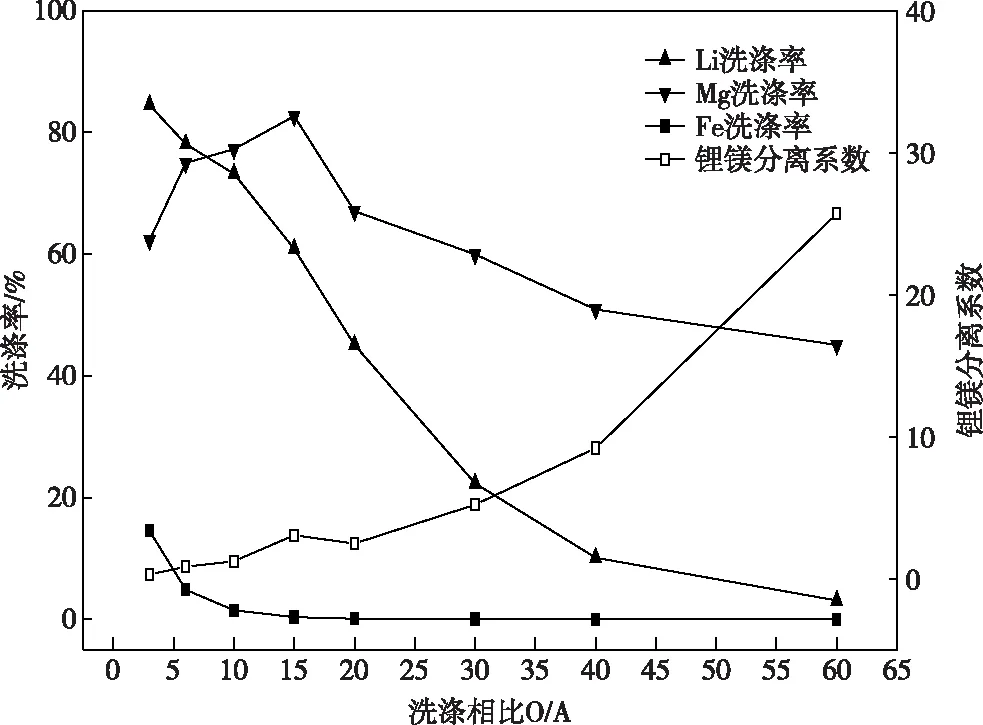
图6 洗涤相比对锂镁铁洗涤的影响Fig.6 Effects of washing ratio on lithium magnesium iron washing
在优选条件有机相组成为40%TBP-20%D2EHPA-40% 260#溶剂油、固定Fe/Li摩尔比为1.5、相比O/A=2、水相pH=2.0、常温20 ℃、振荡时间10 min的条件下,对卤水进行萃取实验,对得到的负载有机相用去离子水在O/A=60的最佳洗涤相比下进行2段洗涤,以洗涤后的负载有机相进行反萃实验,结果如图7所示。
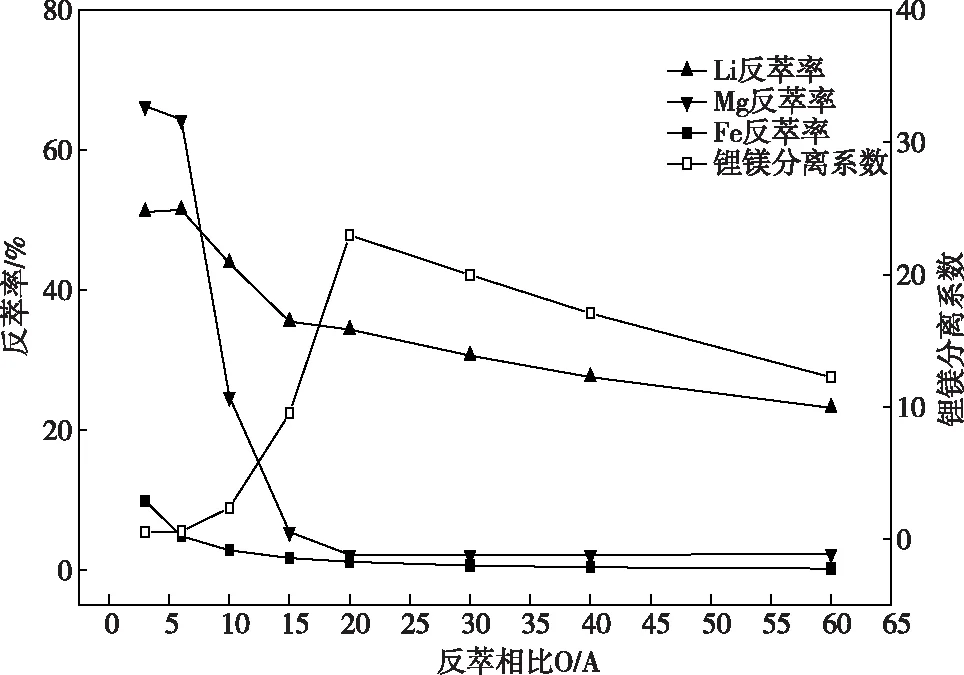
图7 反萃相比对锂镁铁反萃的影响Fig.7 Effects of stripping ratio on lithium magnesium iron stripping
图7给出的是反萃相比对锂、镁、铁反萃的影响结果。从图7可以看出,随着相比增大,Mg2+及Li+反萃率均经历了快速下降后缓慢降低的过程,在O/A=20时,Li+反萃率为34.38%,Mg2+反萃率仅2.2%,锂镁分离系数为22.97,达到最佳分离效果。相比的选择要在关注如何保持较高Li+反萃率同时有低的Fe3+洗脱率。总体来看,Fe3+在有机相中稳定存在,尤其是O/A>15时之后。这是因为,TBP和D2EHPA对Fe3+的协同萃取[23]使得Fe3+基本不被反萃。为了维持较高的Li+反萃率以及低的Mg2+及Fe3+洗脱率,综合考虑,确定O/A=20为最佳反萃相比。此时Li+反萃率为34.38%,Mg2+反萃率仅2.2%,Fe3+洗脱率0.12%,锂镁分离系数达22.97。采用O/A=20反萃相比得到的水相含Li+4.13 g/L、Mg2+0.117 g/L、Fe3+0.47 g/L,经过萃取洗涤反萃将镁锂比从69.06降低到0.03,成功实现了高镁锂比盐湖卤水提锂并分离锂镁。
3 结论
1)引入协萃剂D2EHPA,构建TBP-D2EHPA-FeCl3协萃体系用于盐湖卤水提锂,实现了温和反萃锂的技术突破,只需使用水即可洗脱镁和反萃锂,同时负载铁的有机相可直接循环使用,解决了传统TBP-FeCl3体系萃取提锂工艺需要高酸反萃的问题。
2)采用TBP-D2EHPA-FeCl3协萃体系实现了青海某高镁锂比盐湖卤水中锂镁的良好分离,在有机相组成为40%TBP-20%D2EHPA-40% 260#溶剂油、卤水初始pH值2.0、Fe/Li摩尔比1.5、相比O/A=2和萃取时间10 min的优化条件下,Li+单级萃取率为78.56%,Mg2+单级萃取率为7.34%,锂镁分离系数达46.26。
3)通过调控相比实现了负载有机相中镁的洗脱和锂的反萃,当相比O/A=60时,Mg2+单级洗涤率为45.07%,Li+损失率仅为3.09%,锂镁分离系数达25.7;相比O/A=60时进行两段洗涤,反萃相比O/A=20时,Li+单级反萃率为34.38%,Mg2+单级反萃率为2.2%,Fe3+损失率为0.12%,锂镁分离系数达22.97。

