儿童脉络丛乳头状癌1例并文献复习
阴鲁鑫,李中林,谢满意,王强,王胥
脉络丛乳头状肿瘤占颅内肿瘤的0.4%~0.6%,主要发生在儿童,极少数病例于出生前或出生时确诊。肿瘤发病原因不明,多起源于脑室有脉络丛存在的部位,通常认为侧脑室和第三脑室是儿童脉络丛肿瘤的好发部位,成人的脉络丛肿瘤更易发生在第四脑室,极少数肿瘤可以发生在桥小脑角区[1]。脉络丛乳头状肿瘤可沿脑脊液播散,约10%的肿瘤可癌变。脉络丛乳头状癌(choroid plexus carcinoma,CPC)作为脉络丛乳头状肿瘤的一种恶性分型,起源于脉络丛上皮,是一种罕见的颅内恶性肿瘤,约占颅内肿瘤的0.05%~0.1%[2]。CPC发病率低,预后差,容易误诊,给临床工作带来挑战。本研究回顾性分析徐州医科大学附属医院2016年9月收治的1例儿童CPC患者的临床资料,结合相关文献进行复习,对CPC的临床表现、影像学特点、病理特征和治疗原则进行探讨,以求提高诊断正确率和治疗效果。
1 临床资料
1.1 一般资料 患儿男,2岁,因“突发抽搐3 d”,门诊拟“左侧脑室肿瘤”收入院。3 d前患儿无明显诱因突发肢体抽搐,意识丧失,四肢强直,口吐白沫,持续约5~6 min后自行缓解,急诊就诊于外院,头颅MR示“左侧侧脑室肿瘤”,为求进一步治疗入院。病程中,患儿精神可,饮食睡眠可,无发热,无呕吐。查体:生命体征平稳,神志清楚,双侧瞳孔等大等圆,直径约3 mm,对光反射存在,颈软,无抵抗,双肺呼吸音清,心率尚齐,腹平软,四肢活动自如。
1.2 影像学检查 头颅MR示,左侧侧脑室后角旁巨大团块状异常信号影,边界模糊,呈分叶状,囊实性,大小约46.2 mm×55.4 mm×64.8 mm;病灶实质部分T1序列呈等、长T1信号,T2序列呈等、长T2信号影;肿块与左侧侧脑室脉络丛关系密切,邻近脑干和丘脑受压移位,左侧侧脑室受压变形,中线结构稍右移(图1)。
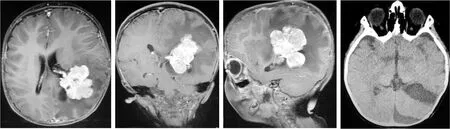
图1 患儿术前MRI检查结果图2 患儿术后CT检查结果
1.3 处理及随访 入院后完善相关检查,择期行侧脑室三角区入路肿瘤切除术,肿瘤全切(图2),病理结果为脉络丛乳头状癌(图3)。患儿术后恢复可,电话随访3年,肿瘤无复发。

异形细胞增生,核大深染,核分裂易见
2 讨 论
CPC是一种罕见的颅内恶性肿瘤,约占全部脉络丛肿瘤的20%,具有高侵袭性生物学行为,为WHO Ⅲ级,儿童发病远多于成人。80%的肿瘤于儿童期生长,其中在1岁以内发生CPC的可能性约为20%[3]。CPC好发于侧脑室三角区,也可发生于第三、第四脑室及桥小脑角区,具有较高的转移和侵袭能力,可以发生于脑室外脑组织[4],手术切除后容易复发,预后较差。
CPC临床症状常无特殊表现,一般常表现为进行性颅高压;头痛、呕吐是常见症状,局灶定位体征少见[5]。儿童因骨缝闭合不全,肿瘤导致的梗阻性脑积水可使头围扩大,前额饱满,囟门凸起,呈现 “落日征”,并可能出现精神淡漠,嗜睡或易激惹等精神异常表现。由于肿瘤大小、部位和颅内压高低不同,患者还可以出现癫痫发作和脑神经瘫、偏瘫、昏迷等神经功能缺陷。位于侧脑室生长的肿瘤,因其压迫颞叶视觉传导束或听觉皮层中枢,经常出现视物模糊、偏盲及听力下降等症状;后颅窝肿瘤压迫后组颅神经使表现患者表现出声嘶、吞咽困难、咽反射迟钝等症状[6]。
根据2016年WHO 神经系统肿瘤分类标准,将脉络丛肿瘤分为脉络丛乳头状瘤(WHO Ⅰ)、非典型脉络丛乳头状瘤(WHO Ⅱ)和CPC(WHO Ⅲ)。有研究发现脉络丛乳头状瘤有癌变的可能,认为CPC由脉络丛乳头状瘤恶变而来[3-4]。
CPC位于脑室内,多为“菜花样”肿块,分叶状,瘤体边缘不规则,实质和间质界限消失,紧贴脑室壁生长,瘤内可有囊变和出血,瘤蒂可附着于脉络丛及血管茎。CPC于显微镜下可见乳头结构不规则,可见片巢状、实性、分化差的组织。肿瘤细胞多为高柱状或多角形,部分细胞密度增高,可见明显的细胞异型性和多形性,常见瘤巨细胞及多核瘤巨细胞,被覆上皮异形细胞增生,核大深染呈多形性,并可见病理性核分裂象。部分病例还可以见到细胞内、外较多大小不等的球形透明小体及钙化[1]。在组织免疫组化方面,CPC尚无特异性标记物。CPC多表达CK、CEA、S-100、vimentin和EMA,也有表达GFAP的报道[7]。另外,有文献报道脉络丛乳头状瘤Ki-67平均标记指数为1.9%[8]。
脉络丛乳头状癌在X线平片上可表现为颅内压增高征(成人压痕增多,儿童颅缝分离),15%~20%可见钙化。在CT上一般表现为等密度至高密度的脑室内占位,24%的病例在CT扫描上表现出钙化,可以是分散的点状钙化也可以遍布整个病灶。CPC的MRI 影像学表现如下:(1)病灶呈乳头状或分叶状,边缘不规则;(2)T1WI 呈稍低信号,而T2WI 呈稍高信号影;(3)肿瘤周边可有水肿,程度不一,这常被认为是该病的重要影像学特征,是肿瘤向脑室外侵犯的征象;(4)CPC常表现为囊变、出血和钙化,但没有特异性;(5)病灶在增强扫描时呈明显不均质强化,血供较为丰富,内部可囊变坏死,周围大片指压状水肿带,瘤周水肿是CPC向脑室外侵犯的重要征象,并有不同程度脑积水[9-11]。CPC在CT和MRI上表现出较脉络丛乳头状瘤更强的反应坏死和对脑实质侵袭的不均一性,如果脉络丛肿瘤出现脑实质的延伸,脑白质的血管源性水肿,则提示CPC的诊断。脉络丛乳头状癌易误诊或漏诊,影像学诊断需注意观察其恶性特征,并结合临床表现及病理特征做出判断[12]。
CPC 应与以下疾病相鉴别:(1)脉络丛乳头状瘤:起源于脉络丛组织,主要位于脑室内,边界较清楚,呈稍长T1稍长T2信号灶,瘤体轮廓清楚欠规则,中线结构移位少见,可出现梗阻性脑积水,1H-MRS 和ADC值有助于其与CPC的鉴别;(2)室管膜瘤:轻至中度强化,50%可有钙化,和CPC相比囊变较多,呈塑型生长,瘤周水肿较轻;(3)脑膜瘤:表现为等T1等T2信号影,可有钙化灶,出现“脑膜尾征”,侧脑室脑膜瘤的瘤体多呈圆形或椭圆形,强化方式多样,边缘光滑,而CPC边缘凹凸不平,增强明显强化,内部可见颗粒状低强化区;(4)畸胎癌:由于原始生殖细胞或具有分化潜能的裂球错位所产生的肿瘤,多发生在松果体区,钙化常见,小部分可存在脂肪组织[13-17]。当然,仅依靠上述形态学特点鉴别诊断仍显不足,CPC需依靠病理和免疫组织化学检查进行最终诊断。
CPC生长迅速,预后较差,5年存活率仅为40%。目前以手术治疗为主,应尽可能全部切除肿瘤组织。肿瘤能否全切是影响预后生存时间的最关键因素,但CPC侵袭性强,血供非常丰富,瘤体边界与周围组织界限不明确,全切肿瘤较为困难,术中常因无法控制的出血而停止手术。因其解剖部位特殊,手术时易损伤脑室毗邻的重要组织,需要术者有熟练的显微手术经验和技巧。完善术前的影像学及血液学检查,选择最合适的手术入路,对全切肿瘤有显著的帮助。有文献报道,肿瘤位于侧脑室者多采用经胼胝体前入路及经皮质入路,而位于第四脑室的肿瘤多采用正中孔一小脑蚓部入路及脉络膜下髓帆入路[6]。
CPC恶性程度高,呈浸润性生长,因边界不清晰而不易彻底切除,国内外许多医疗机构尝试对患者采用放疗或化疗等辅助治疗措施,但从目前的资料来看,不能完全肯定其有效性[18]。目前多数文献报道主张局部大野照射组织量40 Gy,脑脊液转移后也可全脑照射[19]。放疗对于3岁以下儿童的发育影响很大,因此不主张常规放疗,但近年来放射神经外科技术的发展,使部分患者能接受伽玛刀治疗[20]。由于针对CPC的化疗药不易通过血脑屏障且毒性较大,达到药物有效浓度十分困难,因此术后是否需要化疗还存在争议。国外针对CPC的化疗策略认为任何治疗腺癌的化疗方案均可尝试,但这一观点缺乏有力的证据,临床应用中也未见明显疗效,故不能作为CPC常规治疗手段。目前临床上常用化疗药物有顺铂、VP-16、CCNU等[20]。
分子靶向治疗已经成为当今肿瘤治疗研究的新热点,经研究发现小鼠白血病细胞株在转录时His-1基因在脉络丛中显著激活;在小鼠CPC模型中证实有该基因的高表达,推测His-1基因是CPC的特异性致癌基因,如果这一研究得到进一步证实,那么将为该疾病开辟分子靶向治疗的新途径[18]。揭示CPC的分子结构有助于风险分层,为未来的治疗干预带来希望,目前已筛选出的目标靶点有Shh、Notch、PDGFR、PI3K-mTOR和ATR抑制剂,其疗效可能还有待进一步证实[21]。
利益冲突:所有作者均声明不存在利益冲突。

