肝细胞生长因子交联于胶原导管构建神经导管用于面神经损伤修复
田娅媛,张文川,王寒明,王欢,马富凯
面神经炎症反应,创伤,肿瘤或手术操作均可能引起周围性面神经麻痹,周围性面神经麻痹常常引起患者功能缺失,造成患者审美、心理方面的问题[1-4]。通常情况下,将神经断端直接缝合重建神经连接是治疗面神经损伤的最佳方法,当神经断端较长时,无法将神经断端直接缝合。目前,自体神经移植被认为是连接神经断端的金标准方法,因为它含有雪旺氏细胞和基板,能有效促进神经再生。然而,自体神经移植来源有限,因此需要寻找新的替代自体神经移植的治疗策略[5-6]。
前期的研究显示,使用胶原管连接神经断端,修复神经损伤时生物兼容性较好。胶原管惰性强,植入体内后不易引起慢性炎症反应形成疤痕[7-8],因此本研究使用胶原管桥接神经断端。研究显示,肝细胞生长因子(hepatocyte growth factor,HGF)在体外实验中对运动神经元、感觉神经元有营养支持作用[9]。本研究前期使用Traut’s和Sulfo-SMCC,通过两步化学交联成功将胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)交联到胶原材料上[10]。该化学交联方式不影响GDNF的生物学活性且GDNF的释放速度得到了有效地控制。为防止HGF从损伤局部大量扩散,本研究探索采用前期工作中的化学交联法,将HGF通过化学交联中构建神经导管连接神经断端,观察该方法对损伤的面神经的修复作用, 旨在为面神经损伤的治疗提供依据。现报告如下。
1 材料与方法
1.1 主要试剂及胶原管 HGF购自(Peprotech,Rocky Hill,NJ,USA)。胶原管购自(Renerve,NIPRO,Osaka,Japan)。Traut’s和Sulfo-SMCC购自(Thermo scientific)。雄性SD大鼠购自斯莱克实验动物有限公司。
1.2 面神经损伤模型制备及动物分组 本实验严格遵循科技部2006年9月发布的《关于善待实验动物的指导性意见》的相关规定进行。将1 cm长的胶原管与Traut’s试剂反应0.5 h,Sulfo-SMCC试剂与HGF反应0.5 h。随后将胶原管置于Sulfo-SMCC试剂与HGF反应液中0.5 h,通过化学交联将HGF锚定在胶原导管内。雄性SD大鼠12只, 体质量180~200 g, 随机将动物分为HGF组(实验组)和磷酸缓冲液(phosphate buffer solution,PBS)组(对照组),每组6只。大鼠经4%戊巴比妥纳(30 mg/kg) 腹腔麻醉后,在其左侧面部切开皮肤,暴露面神经颊支,仔细分离神经及周围组织,使用手术剪剪去8 mm长面神经颊支,由于神经收缩,造成1 cm长神经缺损,用胶原管连接神经断端,逐层缝合肌肉、皮肤。在HGF组,2 μg HGF锚定在胶原导管内构建神经导管,对照组胶原管中填充PBS。
1.3 行为学观察 正常情况下大鼠触须向前竖起,并有节律拂动。面神经损伤后,触须即向尾侧垂下,且失去拂动能力。术后8周,使用运动评分分析大鼠的功能恢复情况。评分规则如下[11],0分:触须无运动;1分:触须有微量可观测到的运动;2分:触须有少量运动;3分:触须不对称运动;4分:触须对称运动。
1.4 电生理监测 术后8周,将各组大鼠经腹腔麻醉后,使用电生理仪检测再生神经传导速度。将刺激电极置于面神经近端,接收电极置于面神经远端,检测再生神经的传导速度。刺激强度为5 V,波宽为0.2 ms,频率1 Hz。实验操作在室温下进行。
1.5 免疫组化 术后8周,将大鼠通过心脏灌注处死。仔细分离、暴露再生的面神经,将新生神经使用4%多聚甲醛固定2 d。随后将新生神经包埋于石蜡中行切片。经脱水、抗原修复后,使用3%牛血清白蛋白在室温下将切片封闭40 min。加入抗神经丝蛋白200一抗,将切片放于湿盒内再放入4 ℃冰箱孵育过夜。使用PBS将切片洗涤3次,加入山羊抗鼠IgG二抗,再次使用PBS将切片洗涤3次,加入适量新鲜配置的DAB溶液,放入湿盒内37 ℃孵育;最后使用Harris苏木素中染色5 min左右,在倒置荧光显微镜下采集图像;阳性染色为棕黄色,细胞核染色为蓝色。
1.6 透射电镜观察 术后8周,经心脏灌注将大鼠处死,切取左侧面神经,将新生神经迅速投入电镜固定液4 ℃固定2~4 h。使用0.1 M PBS(pH 7.4)漂洗3次,每次15 min。1%的锇酸·0.1 M PBS(pH 7.4)室温(20 ℃)固定2 h。0.1 M PBS(pH 7.4)漂洗3次,每次15 min。组织依次置入50%~70%~80%~90%~95%~100%~100%酒精上行脱水,每次15 min。丙酮∶812包埋剂=1∶1混合液渗透过夜,纯812包埋剂渗透过夜。60 ℃聚合48 h。切片机切片60~80 nm超薄切片。铀铅双染色(2%醋酸铀饱和水溶液,枸橼酸铅,各染色15 min),切片室温干燥过夜。透射电子显微镜下观察,采集图像分析。
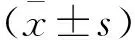
2 结 果
2.1 运动功能分析 各组大鼠面神经损伤后,大鼠触须即向尾侧垂下, 失去拂动能力, 口角歪向健侧。术后各组大鼠触须开始拂动,口角歪斜减轻,随着时间延长,拂动的幅度加大。HGF组大鼠恢复速度大于PBS组大鼠。至术后第8周时,HGF组大鼠功能评分显著高于PBS组大鼠,且差别有统计学意义(P<0.01)。见表1。
2.2 电生理结果 术后第8周,对两组大鼠进行电生理测试,HGF组大鼠的神经传导速度显著高于PBS组大鼠[(47.17±7.13),(22.5±4.03),P<0.01] 。见表1。

表1 神经导管修复面神经损伤的效果分析(均值±标准差)
2.3 透射电镜观察 术后第8周,透射电镜结果显示,HGF组有髓鞘神经纤维直径显著大于PBS组,纤维分布较均匀,排列较为规则,纤维间有毛细血管和结缔组织,部分纤维呈束状生长。HGF组髓鞘厚度亦显著大于PBS组,且差别有统计学意义(P<0.01)。见图1、表1。

图1 电镜下大鼠各组面神经损伤后再生面神经髓鞘形态
2.4 免疫组化 术后第8周,使用一抗对神经纤维进行染色,观察HGF组和PBS组面神经的再生情况。结果显示单位面积下,神经纤维阳性面积在HGF组显著高于PBS组。统计学结果显示差别有统计学意义(P<0.01)。见图2、表1。

阳性染色为棕黄色(免疫组化染色,×40)
3 讨 论
周围神经再生是再生医学中的研究热点[12-14]。迄今,面神经损伤后神经功能修复仍然没有取得满意的效果。神经横断缺损较长,无法通过直接缝合重建神经连接时需要导管连接,引导神经从近端向远端生长[15-16]。在面神经再生的众多研究中,很少有解决神经散乱生长和临床联带运动这样的问题[17]。前期的研究显示,一些生长因子能够促进神经损伤后的再生[18-19]。HGF是一种有效的营养因子,最初在干细胞的原代培养中被用作丝裂原而被发现和应用[20]。随后的研究发现,HGF还参与其他生理活动,如器官再生、血管发生、肿瘤浸润神经系统的发育等[21]。有研究显示,周围神经损伤后HGF受体升高,然而内源性HGF不足以促进神经损伤,外源性HGF在神经损伤修复的早期阶段起着重要作用[22]。
本研究将HGF通过化学交联锚定于胶原导管内构建神经导管用于连接神经断端,术后8周发现神经导管能桥接神经断端,引导神经丛近端向远端生长,到达靶器官,促进运动功能恢复。以胶原导管为载体,将HGF锚定于胶原导管中能防止HGF随体液流动而大量扩散,使得HGF在损伤局部维持有效的浓度,该神经导管能有效促进神经修复;本研究同时进行了功能和形态学的分析。术后8周,形态学方面,透射电镜和免疫组化结果显示,有髓神经纤维的数量和髓鞘厚度在HGF组显著高于PBS组。功能学方面,触须运动评分和电生理结果显示,运动评分和神经传导速度在HGF组显著高于PBS组,功能学结果与形态学结果相似。本研究使用胶原导管作为HGF的载体,通过化学交联防止HGF溶液在体液中大量扩散。研究结果提示,将HGF通过化学交联锚定于胶原导管构建神经导管能有效促进神经损伤修复。
利益冲突:所有作者均声明不存在利益冲突。

