槐杞黄辅治哮喘疗效及对ILC2s上下游因子的影响
豆赛赛 武 怡 刘 琳 孟令建 吴 铭
支气管哮喘的主要临床特征是可逆性气道阻塞及气道高反应性,是儿童最常见的慢性炎症性疾病之一[1,2]。该疾病发病机制尚不明确,传统免疫学认为哮喘是由Th2细胞介导的炎性反应,但近年来研究发现Ⅱ型固有淋巴细胞(type-2 innate lymphoid cells,ILC2s)作为一种先天性免疫细胞,同样参与哮喘始动环节[3]。当气道受到多种炎症因素刺激时,上皮源性细胞因子IL-25、IL-33大量分泌,并刺激ILC2s表达Th2细胞因子IL-5、IL-13,引起Th2型免疫[4]。Th2型免疫反应加重气道炎症,促使哮喘发生。
槐杞黄作为一种免疫调节剂,可激发机体免疫系统,提高机体非特异性抗感染能力[5,6]。研究结果显示,槐杞黄可以调节机体Th1/Th2平衡,纠正Th1/Th2向Th2偏移,进而减少哮喘的发作[7]。但槐杞黄是否亦可通过调节其他通路控制哮喘报道较少,因此,笔者对轻度持续哮喘儿童展开了一项前瞻性的随机对照研究,观察槐杞黄联合吸入糖皮质激素对轻度持续哮喘患儿的治疗效果及对IL-25、IL-33、IL-5、IL-13的影响,从而寻求治疗哮喘的更佳方法。
对象与方法
1.研究对象与分组:选取2020年3月~2021年2月在徐州医科大学附属医院门诊就诊的4~14岁轻度持续哮喘患儿90例,符合《儿科支气管哮喘诊断与防治指南(2016年版)》诊断标准[8]。排除标准:①合并重度鼻炎使用孟鲁司特钠咀嚼片患儿和(或)使用脱敏治疗患儿;②合并心脏、肝脏、肾脏或其他器官、系统慢性病者;③合并癫痫或其他中枢神经系统疾病者;④合并自身免疫性疾病者;⑤不能配合肺功能检查者;⑥入组前3个月内应用免疫调节剂。所有入组患儿家长均签署知情同意书,并经笔者医院医学伦理学委员会同意后留取标本。将入选患儿按随机数字表法分为 A组(n=45)和B组(n=45),但90例中有8例失访退出,实际收集病例82例,A组(n=38)、B组(n=44),其中A组男患儿15 例,女患儿23例,患儿平均年龄为7.50±2.22岁。B组男患儿20例,女患儿24例,患儿平均年龄为7.50±2.22岁。两组患儿在性别、年龄、体重等方面比较,差异无统计学意义(P>0.05),具有可比性。
2.治疗方法:A组给予槐杞黄颗粒(启东盖天力药业有限公司,规格:10克/袋,1袋/次,2次/天;批准文号:国药准字B20020074)口服及吸入用布地奈德(AstraZeneca Pty Ltd,规格:1毫克/支,100微克/次,2次/天;批准文号:进口药品注册证号 H20140475)雾化。B组予吸入用布地奈德(AstraZeneca Pty Ltd,规格:1毫克/支,100微克/次,2次/天;批准文号:进口药品注册证号 H20140475)雾化。槐杞黄疗程为3个月,用药开始后的1、3、6个月门诊随访,记录喘息的发作次数,并监测用药前及用药第3个月时血清IL-25、IL-33、IL-5、IL-13水平及肺功能情况。
3.观察指标:(1)治疗前及治疗后3个月,采集空腹肘静脉血,离心留取上层血清,ELISA 法检测血清IL-25、IL-33、IL-5、IL-13水平,同时监测肺功能。(2)随访6个月,分别记录治疗前1个月、开始治疗后1、3、6个月喘息发作次数。
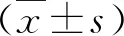
结 果
1.IL-25、IL-33比较:治疗前,A、B组患儿IL-25、IL-33水平比较,差异无统计学意义(P>0.05);治疗后,A、B组患儿IL-25、IL-33水平较治疗前下降,差异有统计学意义(P<0.05);A组患儿IL-25、IL-33水平较B组下降明显,差异有统计学意义(P<0.05),详见表1。
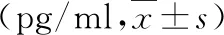
表1 两组IL-25、IL-33水平比较
2.IL-5、IL-13比较:治疗前,A、B组患儿IL-5、IL-13水平比较,差异无统计学意义(P>0.05);治疗后,A、B组患儿IL-5、IL-13水平较治疗前下降,差异有统计学意义(P<0.05);A组患儿IL-5、IL-13水平较B组下降明显,差异有统计学意义(P<0.05),详见表2。
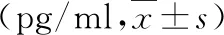
表2 两组IL-5、IL-13水平比较
3.肺功能比较:治疗前,A、B组患儿FEV1%pred、PEF%pred、MMEF75/25%pred比较差异无统计学意义(P>0.05);治疗后,A、B组患儿FEV1%pred、PEF%pred、MMEF75/25%pred较治疗前升高,差异有统计学意义(P<0.05);A组患儿FEV1%pred、PEF%pred、MMEF75/25%pred较B组升高明显,差异有统计学意义(P<0.05),详见表3。
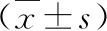
表3 两组患儿肺功能比较
4.两组患儿各期喘息发作次数比较:两组患儿治疗前及治疗后1个月喘息次数比较,差异无统计学意义(P>0.05),A组患儿治疗后3及6个月喘息次数较治疗前减少,差异有统计学意义(P< 0.05),详见表4。
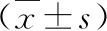
表4 两组患儿各期喘息发作次数比较
5.安全性评价:研究过程中两组患儿治疗期间均未报告严重哮喘进展事件,且均无严重不良反应事件的发生。
讨 论
近年来,我国儿童支气管哮喘发生率呈上升趋势[9,10]。哮喘的反复发作及哮喘相关的死亡事件,给社会和家庭带来沉重的负担[11]。治疗哮喘是一个刻不容缓的问题,目前,布地奈德等糖皮质激素是临床治疗小儿支气管哮喘的常用药物,但由于家长对激素不良反应的恐惧,导致用药依从性较差[12]。因此在加强哮喘宣传教育的同时,也有必要寻求其他的辅助治疗手段[13]。
槐杞黄颗粒是由槐耳菌质、枸杞和黄精三味药构成,广泛应用于免疫反应所造成的过敏性疾病中,在哮喘治疗方面,有研究显示,槐杞黄辅助治疗哮喘可明显减少呼吸道感染、哮喘发作次数,赵德育等研究显示,槐杞黄联合ICS可以更明显地改善肺功能,另有研究显示,槐杞黄可降低Th2相关细胞因子水平、提高Th1相关细胞因子水平,从而达到治疗哮喘的目的,但哮喘发病机制复杂,哮喘的发生、发展有多种细胞及因子参与,槐杞黄颗粒的具体机制尚不明确,因此笔者在轻度持续哮喘患儿常规ICS治疗上,加用槐杞黄颗粒,探究其疗效及其可能的机制。
ILC2s是近年来发现的一种与T淋巴细胞密切相关的重要固有免疫细胞,对T淋巴细胞具有显著调控作用[14]。在早期即可参与哮喘气道炎性反应及Th2相关的免疫应答,对气道重塑、修复也起重要作用[15]。ILC2s虽然总细胞数量远不如机体内的CD4+Th2细胞数量庞大,但活化后的ILC2s可产生大量IL-5、IL-13等Th2型细胞因子参与哮喘的发病机制中,其具有比CD4+Th2细胞更强大的生物学活性[16]。抑制ILC2s活化是治疗哮喘的新的靶点,通过研究其上下游因子间接反映其活化水平。
IL-25、IL-33是新近发现的与哮喘炎性反应密切相关的细胞因子,是活化ILC2s的经典分子,IL-5、IL-13是ILC2s的效应细胞因子,IL-5可以高效调节嗜酸性粒细胞的产生、活化及分布,促进 IgE 合成,参与过敏反应的发生,导致气道炎性反应,IL-13具有多效性,其能在TNF-α转化酶诱导下,促进呼吸道杯状细胞增生及黏液分泌增加参与机体多种慢性炎性反应,也可同IL-5一样促进 IgE 产生,促使过敏反应的发生,导致气道内反应性增高参与气道的重塑,在哮喘发生过程中两者分泌会增加,经槐杞黄联合ICS治疗后IL-25、IL-33、IL-5、IL-13水平较单纯ICS其他B组降低明显,进一步证实槐杞黄颗粒治疗哮喘的可行性,其可以降低 IL-25、IL-33水平,抑制ILC2s活化进而减少IL-5、IL-13,从而减轻哮喘气道炎性反应。
肺功能检查指标是判断气流受限的重要客观指标[17,18]。它可以反映哮喘患儿肺和气道的病变情况及疾病的严重程度,判断气道的通气状况,治疗后A组FEV1%pred、PEF%pred、MMEF75/25%pred均高于B组,由此分析槐杞黄联合ICS较单纯ICS改善气道通气更佳,通过观察临床喘息发作情况得知槐杞黄足疗程应用可降低哮喘患儿喘息发作次数,减轻临床症状。
综上所述,槐杞黄颗粒可以通过下调IL-25、IL-33水平而抑制ILC2s活化减少IL-5、IL-13释放达到治疗哮喘目的,它联合ICS治疗哮喘较单纯ICS治疗更具有优势,可更明显改善肺通气,降低喘息发作次数,提高生活质量,在临床中具有一定的应用前景。

