多酶级联系统制备蒜糖醇的细胞工厂构建及工艺优化
赵婧邑 郭 燕 冯婷婷 陈 静 孙钦菊 刘继栋
(1.广西大学 轻工与食品工程学院, 广西 南宁 530004;2.广西南亚热带农业科学研究所, 广西 龙州 532415;3.广西农业职业技术大学 食品工程系, 广西 南宁 530007)
蒜糖醇是一种高值的六碳稀有糖醇,是多种稀有糖转化的中间体,具有热量低、降血压、防便秘等特性,对糖尿病及其并发症有明显的防治作用[1]。当前,蒜糖醇主要从海滨锦葵中提取,然而,蒜糖醇在自然界中存在量极少,产物提取源受产地、季节、植物提取部位等因素限制,难以满足日益增长的市场需求[2]。 D-葡萄糖经化学电解还原法可以生产蒜糖醇,但生产过程会消耗大量能源,污染环境,且副产物多,难以推广至工业化生产[3]。 相比之下,生物合成具有反应条件温和、环境友好等优势,利用生物技术生产高值化合物已处于新兴主导地位。
多酶级联是指在一个反应系统中至少有2 个酶催化反应同时进行的合成策略,反应过程中无需对中间产物进行分离,可以直接获得目标产物[4]。 基于稀有糖转化(Izumoring)策略,Zhu 等[5]利用级联技术建立了D-果糖转化为蒜糖醇的细胞工厂,100 mmol/L 的果糖为底物可以产生10.62 g/L 的蒜糖醇。 为了进一步降低底物成本,Wen 等[6]通过在胞外固定化葡萄糖异构酶(glucose isomerase, GI),联合体外酶催化和静息细胞生物转化,以50 g/L葡萄糖为底物生产得到12.7 g/L 蒜糖醇。 然而,酶的纯化和固定化步骤繁琐,催化终点处蒜糖醇产率低下,且存在中间产物传递受阻的问题。 与之相比,利用体内多酶级联策略构建细胞工厂使催化剂在空间位置上靠得更近,缩短了催化反应底物传输的路径,有利于提高催化效率[7]。 本研究拟通过在大肠杆菌(Escherichia coli,E.coli)体内构建多酶级联表达系统,创新性实现D-葡萄糖到蒜糖醇的胞内从头合成,并对生产条件以及体内级联催化系统的结构进行优化,旨在为低成本、规模化生产蒜糖醇提供参考依据。
1 材料与方法
1.1 材料与试剂
来源于产碱普罗威登斯菌(Providencia alcalifaciens)的核糖醇编码基因rdh和假丝酵母(Candida boidinii)的甲酸脱氢酶编码基因fdh,由生工生物工程(上海)股份有限公司经密码子优化后合成,分别连接至表达载体pET -32a( + )。 菌株E. coliDH5α、E. coliBL21(DE3),质粒pACYCDuet -1、pETDuet-1、pRSFDuet-1,携带Bacillussp. (NCIM 59)gi基因的表达载体pET32a( +)-gi和携带Clostridium bolteae dpe基因的表达载体pET32a( +)-dpe,广西大学发酵工程实验室保存。 PrimeSTAR、限制性核酸内切酶,宝生物工程(大连)有限公司;无缝克隆试剂盒、DNA Marker、NAD+粉末、DNA 连接酶、SDS-PAGE 电泳试剂盒及蛋白Marker,生工生物工程(上海)股份有限公司;2 ×Rapid Taq Master Mix、质粒DNA 提取试剂盒、产物回收试剂盒,南京诺唯赞生物科技有限公司;D-阿洛酮糖标准品、蒜糖醇标准品,上海源叶生物科技有限公司。
1.2 仪器与设备
HPLC 1260 型高效液相色谱仪,美国安捷伦科技公司;JY92-IIN 细胞破碎仪,宁波新芝生物科技股份有限公司;WIX-easyPRO4 型蛋白电泳仪,北京韦克斯科技有限公司;5424R 型高速冷冻离心机,美国艾本德有限公司;ZWYR-2403B 型恒温震荡摇床,上海智城分析仪器制造有限公司;ST3100 型精密pH 计,常州奥豪斯仪器有限公司;T100 型PCR仪,上海伯乐生命医学产品有限公司;BMJ-160C 型霉菌培养箱,上海博迅医疗生物仪器股份有限公司。
1.3 实验方法
1.3.1 大肠杆菌培养
LB 培养基配置(g/L):酵母提取物5、氯化钠10、蛋白胨10。 调pH 值为7,121 ℃灭菌20 min 后用于E. coli的培养。E. coli抗性筛选时,氯霉素、氨苄青霉素和卡那霉素的终质量浓度分别为50、100、50 μg/mL。
1.3.2 重组表达菌株的构建
核酸序列测定、引物合成由生工生物工程(上海)股份有限公司完成,以质粒pET-32a( +)-gi、pET-32a( +)-dpe、pET-32a( +)-rdh和pET-32a( +)-fdh为模板,采用相应的引物(表1)对目的基因进行PCR 扩增,将目的基因依次连接至表达载体pACYCDuet-1、pETDuet-1、pET-32(a) +、pRSFDuet - 1, 以 构 建 重 组 载 体 pAgidpe、 pEfdhrdh、32fdhlrdh和pRgidpe,并转于克隆菌株E. coliDH5α进行验证。 将验证正确的目的重组载体共转于重组菌E. coliBL21(DE3),通过双抗筛选阳性转化子,验证正确即得到双质粒共表达重组菌。

表1 引物序列Tab.1 Sequences of primers
1.3.3 重组菌株蛋白表达测定
将表达菌株接种至含有相应抗生素的5 mL LB液体培养基中,于37 ℃、200 r/min 震荡培养12 h。培养后的菌液以1%接种量接种至装有50 mL LB培养基的500 mL 锥形瓶中,于37 ℃、200 r/min 震荡培养2 ~3 h 至OD600为0.6 ~0.8,加入终浓度为1 mmol/L 的异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG),于20 ℃、200 r/min 诱导24 h。收集诱导后的菌体,重悬后超声破碎细胞,细胞破碎仪的工作条件为功率400 W 工作2 s,间歇3 s,总时间15 min。 将破壁后的菌体悬浊液于4 ℃、8000 r/min 条件下离心20 min,取上清液进行SDSPAGE 鉴定。
1.3.4 酶活测定
以25 g/L D-葡萄糖、D-果糖作为催化底物,加入200 μL GI、D-阿洛酮3-差向异构酶(D-psicose 3-epimerase,DPEase) 粗酶液及1 mmol/L 的Co2+,40 ℃、pH 值8.0 催化10 min 后,立即沸水浴10 min终止反应;以25 g/L D-阿洛酮糖作为催化底物,加入200 μL 核糖醇脱氢酶(ribitol dehydrogenase,RDH) 粗 酶 液、1 mmol/L 的Co2+及0.03 g/L 的NADH,40 ℃、pH 值8.0 催化10 min 后,立即沸水浴10 min 终止反应;以100 mmol/L 甲酸钠作为催化底物,加入200 μL 甲酸脱氢酶(formate dehydrogenase,FDH)粗酶液及1 mmol/L 的NAD+,40 ℃、pH 值8.0 催化2 min 后,立即沸水浴10 min 终止反应。 GI、DPEase、RDH 和FDH 酶活定义为单位时间内,标准条件下生成1 μmol 目标产物所需的酶量。
1.3.5 发酵条件优化
为优化细胞产酶条件,200 r/min 条件下,分别改 变 IPTG 终 浓 度(0.25、 0.50、 0.75、 1.00、1.25 mmol/L)、发酵温度(15、20、25、30、35 ℃)和诱导时间(6、12、18、24、30 h)。 诱导结束后分别测定发酵终点的OD600与全细胞催化活性。
1.3.6 蒜糖醇合成条件优化及全细胞催化活性测定
为优化多酶级联系统催化效率,将终质量浓度25 g/L 的葡萄糖、1 mmol/L 的Co2+、不同质量浓度的甲酸钠(0.5、1.0、3.0、5.0、7.0 g/L)和不同终质量浓度的全细胞(0.01、0.02、0.03、0.04、0.05、0.06 g/mL)加入至50 mmol/L 的Tris-HCl 缓冲体系中,改变缓冲体系pH 值(7.0、7.5、8.0、8.5、9.0)和反应温度(30、35、40、45、50 ℃),反应30 min 后煮沸10 min 终止反应。 葡萄糖、果糖、阿洛酮糖及蒜糖醇的检测采用Carbomix Pb-NP 色谱柱(7.8 mm ×300 mm,10 μm)和1260 RID (G1362A)检测器,柱温78 ℃,流动相为超纯水,流速为0.5 mL/min,单次样品分析采集时间为40 min[6]。 全细胞催化活性定义为1 g 干细胞单位时间内催化合成蒜糖醇的量,将最高全细胞催化活性定义为相对酶活100%。 细胞质量浓度(CB)按式(1)计算[8],单位g/L。

1.3.7 糖蜜预处理
1.4 数据处理
所有实验均测定3 次,采用Origin 9 处理数据,Adobe Illustrator 2020 处理图片。
2 结果与分析
2.1 上下游酶系表达载体与蒜糖醇细胞工厂的基础构建结果
为建立一种经济、绿色、高效的合成蒜糖醇的方法,实现葡萄糖生成蒜糖醇,分别对GI、DPEase、RDH 及FDH 4 种酶转化能力进行验证。 将分别携带4 种酶编码基因的BL21(DE3)/pET32a( +)系列重组菌进行诱导表达后,进行SDS-PAGE 分析和酶活测定,测定结果见图1。 由图1(a)可知,泳道1 ~4 分别在Snapgene 软件预测结果的相应位置处(63.0、52.2、43.9、58.2 kDa)有明显的条带,分别对应GI、DPEase、RDH 和FDH 蛋白。 以BL21(DE3)/pET32a( +)为对照菌株进行吸光度和酶活测定,结果见表2。 4 种酶均显示出相应的催化活性,说明已成功实现GI、DPEase、RDH 和FDH 在E. coliBL21(DE3)的可溶性表达,且四酶级联系统有催化葡萄糖生产蒜糖醇的潜力。

表2 GI、DPEase、RDH、FDH 在大肠杆菌中的酶活Tab.2 Enzymatic activities of GI, DPEase, RDH and FDH in E. coli
按照1.3.1 构建蒜糖醇基础细胞工厂BL21(DE3)/pAgidpe-pEfdhrdh,其SDS-PAGE 结果见图1(b)。图1(b)结果显示,与对照相比,泳道1 和2分别在预测结果处显示明显蛋白条带(46.9、34.7、26.4、42.1 kDa),对应GI、DPEase、RDH 及FDH 蛋白,表明四酶体系在表达宿主E. coliBL21(DE3)中同时成功表达,蒜糖醇基础细胞工厂构建成功。

图1 重组大肠杆菌表达产物的SDS-PAGE 分析Fig.1 SDS-PAGE analysis of expression products of recombinant E. coli
2.2 基础细胞工厂发酵条件优化结果
基础细胞工厂发酵条件优化结果见图2。 用乳糖操纵子作为启动子进行蛋白质表达时需要诱导物进行诱导,IPTG 是一种作用极强的诱导剂,在结构上与乳糖相似,不被细菌代谢而十分稳定[9]。 IPTG浓度对菌体的生长和产酶水平有着显著的影响。 由图2(a)可知,重组菌的生物量随着IPTG 浓度的增加而下降,当IPTG 浓度为1.25 mmol/L 时,重组菌OD600骤降至1.25,可能是由于高浓度的IPTG 对大肠杆菌细胞产生了明显的毒性,抑制了细胞的生长。然而,随着IPTG 浓度在0.25 ~1.00 mmol/L 升高,由于单位菌体产酶量逐渐增加,全细胞催化活性逐渐提升,当IPTG 浓度为1.00 mmol/L 时,催化活性达到最大值。 因此,最终确定IPTG 的优化诱导浓度为1.00 mmol/L。

图2 不同发酵条件对重组细胞生物量和催化活性的影响Fig.2 Effect of different fermentation conditions on biomass and catalytic activities of recombinant strains
诱导温度对菌体生长、质粒稳定性和外源蛋白合成等都有重要影响[10]。 大肠杆菌最适生长温度为37 ℃,然而一方面,过高的诱导温度会导致胞内蛋白质合成速率过快,进一步导致蛋白质因无法正确折叠而形成无活性的包涵体,因此在对重组菌进行诱导表达时常控制诱导温度在35 ℃以下;另一方面,温度过低会影响重组菌的生长繁殖。 因此,确定最佳诱导温度对平衡细胞产活性酶和重组菌的生物量至关重要。 由图2(b)可知,当诱导温度高于25 ℃时,全细胞催化活性明显下降,可能是由于诱导温度的升高导致胞内包涵体蛋白量增加。 综合实验结果,确定20 ℃为优化诱导温度。
尽可能在短时间内达到最高的催化活性对工业生产有良好的指导意义。 由图2(c)可知,随着诱导时间的延长,菌体量和催化活性逐渐升高,诱导18 h后,催化活性基本趋于稳定,24 h 后催化活性无明显增加,且细胞密度有所降低,可能是由于IPTG 长时间在胞内不能被菌体代谢,对细胞产生了毒害作用。最终确定优化诱导时间为24 h。
2.3 静息细胞催化条件优化结果
多酶级联系统中,各个元件酶都有其最适的催化条件,协调这些催化条件才能使得整个催化系统发挥出整体最大的催化效率。 在多酶级联系统的温度阈值范围内,提高温度可以促进级联反应向生成产物方向推进,然而超过阈值后,温度的升高会影响蛋白酶的折叠,破坏蛋白酶大分子的三维结构,导致酶失去活性[11]。 全细胞催化条件优化结果见图3。由图3(a)可知,全细胞催化活性随温度升高而逐渐增加,当温度达到40 ℃时达到最大值;随着温度继续升高,活性显著下降,当催化温度为50 ℃时,催化活性只有最大值的51.94%。 因此,确定40 ℃为优化催化温度。
pH 值通过影响蛋白质的空间构型、稳定性以及底物的解离状态影响多酶级联系统的催化效率[12]。由图3(b)可知,pH 值7.0 ~9.0 时,当pH 值小于8.0 时,催化活性随着pH 值的增加而升高;在pH值为8.0 时,催化活性达到最大;然而当pH 值继续升高时,活性呈现下降趋势,证明过低或过高的pH值均不利于级联反应的进行。 因此,合成蒜糖醇的优化pH 值为8.0。
2018 International training workshop on environment friendly and safety of household care chemical products convered 10 59
在单位体积内,全细胞催化活性与菌体质量浓度成正比,然而,转化效率不会随着菌体质量浓度的增加而持续增加,为平衡经济性与高效性,需确定最高转化效率时的菌体质量浓度。 由图3(c)可知,当底物质量浓度固定为25 g/L,催化体系中细胞质量浓度在0.01 ~0.05 g/mL 时,催化活性随菌体质量浓度的增加而显著提高;随着菌体质量浓度的继续增加,催化活性趋于稳定。 最终确定在25 g/L 的底物条件下,催化体系中优化菌体质量浓度为0.05 g/mL。
在多酶级联系统中,甲酸钠作为辅底物参与了下游酶系中的氧化还原反应模块,因此甲酸钠的质量浓度对蒜糖醇的生成率也有一定的影响,因此探究了甲酸钠添加量对全细胞催化活性的影响。 由图3(d)可知,除辅底物终质量浓度为1.0 g/L 外,全细胞催化活性随甲酸钠质量浓度的增加而提升;当甲酸钠的质量浓度为5.0 g/L 时,全细胞催化活性最高;继续提高甲酸钠质量浓度,催化活性无明显变化。 因此,确定甲酸钠的优化质量浓度为5.0 g/L。
采用优化催化条件对基础细胞工厂BL21(DE3)/pAgidpe-pEfdhrdh的转化能力进行验证,结果见图4。 0 ~12 h 内,催化体系内蒜糖醇产量明显增多;12 ~15 h,体系内蒜糖醇的合成速率下降,蒜糖醇产量趋于稳定。 在催化终点处,体系内剩余4.95 g/L 葡萄糖,转化率为80.20%,并有19.33 g/L蒜糖醇生成,产率达77.32%。 因此,本研究构建的多酶级联系统能够正常催化D-葡萄糖合成蒜糖醇。然而,反应过程仍存在细胞催化活性低,反应前期中间产物有大量积累的问题,且催化终点处仍有底物D-葡萄糖未被转化。 因此需要进一步优化表达体系,从而提高全细胞多酶级联系统的催化效率。

图4 BL21(DE3)/pAgidpe-pEfdhrdh 催化D-葡萄糖生成蒜糖醇Fig.4 Biosynthesis of allitol from D-glucose by BL21(DE3)/pAgidpe-pEfdhrdh
2.4 体内多酶级联系统优化结果
2.4.1 上游基因质粒拷贝数提升结果
大肠杆菌双表达框质粒pACYCDuet -1、pETDuet-1 和pRSFDuet-1 的基因拷贝数分别为10、40和100[13]。 为提升底物的转化率,需提高上游酶系的表达量。 本研究选择了高拷贝载体pRSFDuet-1作为表达载体骨架进行上游酶系的构建。 将重组质粒pRgidpe和pEfdhrdh共转化于表达菌株E. coliBL21(DE3),经Kan 与Amp 双抗性筛选阳性转化子,得到蒜糖醇细胞工厂BL21(DE3)/pRgidpe-pEfdhrdh,构建示意图见图5(a)。 细胞工厂BL21(DE3)/pRgidpe-pEfdhrdh的SDS-PAGE 结果见图5(b)。由图5(b)可知,与对照组相比,泳道3 在46.9、34.7、26.4、42.1 kDa 处显示明显的蛋白条带,分别与GI、DPEase、RDH 和FDH 蛋白质的预测结果大小一致,表明四酶体系在表达宿主E. coliBL21(DE3)中同时成功表达。
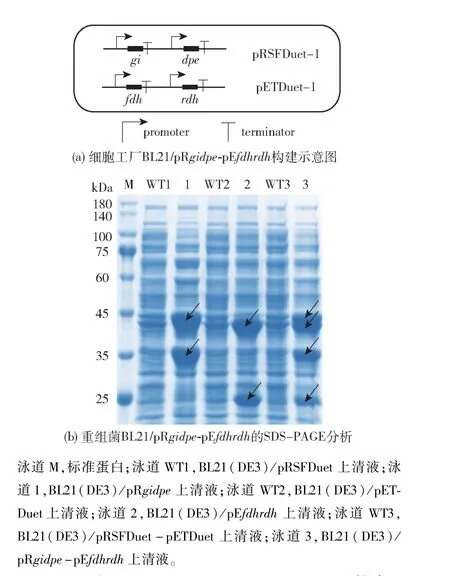
图5 细胞工厂BL21(DE3)/pRgidpe-pEfdhrdh 构建示意图和SDS-PAGE 分析Fig.5 Schematics and SDS-PAGE analysis of cell factory BL21(DE3)/pRgidpe-pEfdhrdh
2.4.2 下游酶系的融合表达结果
蛋白质融合可以在多酶活性中心位点间形成底物通 道, 甘 氨酸 G 和 丝 氨 酸 S 的 GS 组 合(GGGGS)n可以通过改变n的大小实现结构域之间距离的放大和减小[14]。 为减少中间产物的积累,将辅酶循环系统中的RDH 和FDH 通过柔性linker(GGGGS)3进行连接,在缩短两蛋白质空间距离的同时,实现结构域的分离,保证RDH 和FDH 的单独活性,构建示意图见图6(a)。 将重组质粒pRgidpe与32fdhlrdh共转化于表达菌株E. coliBL21(DE3),经Kan 与Amp 双抗性筛选阳性转化子,得到蒜糖醇细胞工厂 BL21 (DE3)/ pRgidpe-32fdhlrdh,其SDS - PAGE 结果见图6 (b)。 由图6(b)可知,与对照组相比,泳道6 在预测结果46.9、34.7、85.1 kDa 处显示明显的蛋白质条带,表明多酶体系在表达宿主E. coliBL21(DE3)中同时成功表达。
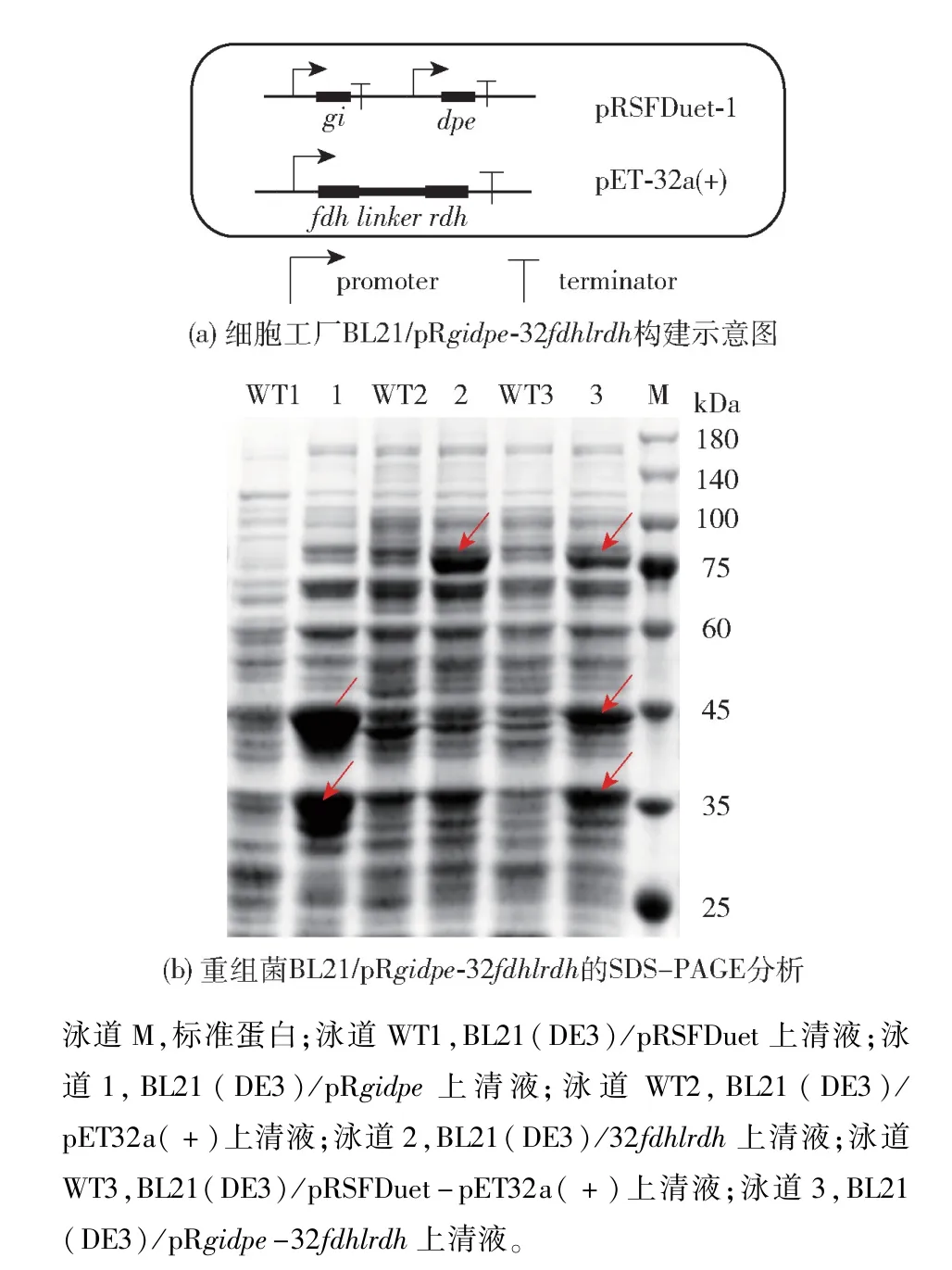
图6 细胞工厂BL21(DE3)/pRgidpe-32fdhlrdh构建示意图和SDS-PAGE 分析Fig.6 Schematics and SDS-PAGE analysis of cell factory BL21(DE3)/pRgidpe-32fdhlrdh
2.5 重组大肠杆菌全细胞合成蒜糖醇结果
在优化催化条件下,分别对BL21 (DE3)/pRgidpe- pEfdhrdh和 BL21 ( DE3)/pRgidpe-32fdhlrdh多酶级联催化系统的反应特性进行研究,反应进程产物变化见图7。 由图7(a)可知,与基础细胞工厂BL21(DE3)/pAgidpe-pEfdhrdh相比,在相同的反应条件下,0.05 g/mL 细胞工厂BL21(DE3)/pRgidpe-pEfdhrdh对底物D-葡萄糖的利用率有所提升,催化终点葡萄糖的残糖量降至4.05 g/L,蒜糖醇的产量达到20.27 g/L,然而在反应前期中间产物仍有明显积累。 由图7(b)可知,进一步融合表达下游酶系后,0.05 g/mL 细胞工厂BL21(DE3)/pRgidpe-32fdhlrdh催化进程显示,反应达到终点的时间由12 h 缩短至9 h。 反应前期中间产物的质量浓度明显降低,反应终点处D-葡萄糖残留量进一步下降至3.70 g/L,蒜糖醇的产量达到21.12 g/L。 相较于Wen 等[6]的研究,本研究利用更低质量浓度的葡萄糖(25 g/L)为底物,以全细胞为催化剂,将蒜糖醇的产量提升了66.28%。

图7 不同细胞工厂催化D-葡萄糖生物合成蒜糖醇Fig.7 Biosynthesis of allitol from D-glucose by different cell factories
废糖蜜是制糖过程中在进行末端糖膏分离时的主要副产物,价格低廉,含有丰富的糖类物质,现已作为一种廉价碳源被广泛用于发酵行业。 微波硫酸法可以有效地将糖蜜中的蔗糖水解为葡萄糖和果糖。 预处理后的糖蜜样品中含有(1.17 ±0.63) g/L蔗糖、(116.97 ± 0.29) g/L 葡萄糖和(110.10 ±1.37) g/L 果糖。 为探究pRgidpe-32fdhlrdh菌株的工业适用性,在优化条件下,取220 μL 糖蜜样品作为唯一碳源进行催化实验,结果见图8。 由图8 可知,催化终点处生成37.62 g/L 蒜糖醇,证明pRgidpe-32fdhlrdh是利用糖蜜生产蒜糖醇的潜力菌株。

图8 葡萄糖和蒜糖醇HPLC 检测结果Fig.8 HPLC detection results of glucose and allitol
3 讨 论
随着稀有糖的需求量不断提升,开发一种高效、廉价的蒜糖醇生产方法已成为近年来的研究热点。与以纯酶或粗酶参与的体外级联方式相比,体内多酶级联系统采用全细胞方式催化整个反应,无需复杂的蛋白质纯化步骤[15]。 同时,由于微生物可以将酶与恶劣的外环境隔离,使酶在内环境中保持更稳定的催化活力[16]。 构建完成的细胞工厂可以通过发酵培养快速大量获得,对于多酶级联系统的工业规模化应用具有重要的意义。 本研究构建了携带GI、DPEase、RDH 和FDH 编码基因的重组大肠杆菌,成功实现以葡萄糖为底物合成蒜糖醇。 然而,在优化反应条件下,仍存在细胞催化活性低,反应时间长的问题。
外源基因的表达量通常随质粒拷贝数的增加而提高,因此,质粒拷贝数的变化影响了目标产物的得率[17]。 有研究使用高拷贝质粒使得目标酶在微生物宿主中充分表达,然而进一步研究发现,由于所表达蛋白质的性质差异,工程菌所携带的质粒拷贝数与蛋白质表达量不一定成比例关系,高拷贝质粒会增加细胞的代谢压力,且导致蛋白质的错误折叠[18-19]。 因此,进一步了解质粒拷贝数对蒜糖醇合成酶系的影响,对于提高葡萄糖的利用率,进而增加目标产物的产率是十分必要的。 本研究结果表明:质粒拷贝数的提高使得葡萄糖转化率升高,即使用高拷贝数质粒有效提高了上游酶系的胞内表达量,该结果与何成等[20]的研究结果相似。
在多酶级联催化系统中,缩短蛋白酶之间的距离可以促进中间产物的转运,减少中间产物的积累[21]。 通过基因融合引入linker 连接肽将多酶组装形成复合体,可以拉近蛋白酶活性中心之间的空间距离,形成相应的底物通道,是一种高效、经济的提高多酶催化效率和辅因子再回收的组装策略[22]。 Jeon 等[23]将乙醇脱氢酶(ADH)和单加氧酶(BVMOs)进行融合,构建了从长链仲醇到酯的大肠杆菌转化平台,相较于游离表达2 个酶,融合蛋白ADH-Gly-BVMO 的表达使细胞催化效率提高了40%。 然而也有研究表明,不同组分和长度的连接肽可能会导致蛋白质在胞内错误折叠,使其催化活力损失[24]。 本研究结果表明:融合酶维持了结构域灵活性和2 个亲代酶功能的特性,有效促进了中间产物的转运和辅因子的循环,进而解决了反应前期中间产物大量积累的问题,缩短了反应到达终点的时间。
4 结论
本研究以大肠杆菌为底盘细胞,利用GI、DPEase 和RDH 催化葡萄糖生成蒜糖醇,并偶联FDH 进行辅酶再生,成功实现了利用微生物细胞工厂以廉价底物合成高值化合物蒜糖醇的目的。通过上游酶系拷贝数的提升与下游酶系的融合表达,在促进了葡萄糖转化的同时,也减少了反应前期中间产物的积累,缩短了反应达到催化终点的时间,进一步提升了蒜糖醇的产量与全细胞催化活性。 本研究旨在为蒜糖醇的工业生产建立一种简单、经济和生态友好型的生物合成方法,为有效提高制糖工业的经济效益和废糖蜜的进一步综合利用提供途径。

