甲壳类水产品过敏原及其致敏性消减技术研究进展
李振兴, 赵金龙
(中国海洋大学 食品科学与工程学院, 山东 青岛 266003)
甲壳类水产品,主要包括虾、龙虾和螃蟹,在人类营养中起着至关重要的作用,含有多种优质蛋白和营养物质,也是多不饱和脂肪酸和维生素的丰富来源[1-2]。 据联合国粮食及农业组织(Food and Agriculture Organization of the United Nations, FAO)于2020年发布的《世界渔业和水产养殖报告》数据,2018年全球每年直接消费甲壳类水产品超过93.87万t,其中南美白对虾(Litopenaeus vannamei)消费量占比高达52.9%。 甲壳类水产品除直接烹食外,还可用做加工原料,制成如调味品、休闲食品等甲壳类加工食品。 甲壳类水产品、甲壳类加工食品等甲壳类食品是FAO 认定的8 大类主要致敏食品之一。微量的甲壳类食品成分就可以诱发严重的过敏反应,不仅阻碍了甲壳类食品过敏患者对味道鲜美、营养丰富的甲壳类食品的摄入,而且对潜在过敏人群存在严重的安全隐患,已经成为一个严重的全球公共卫生问题[2-3]。
甲壳类食品过敏问题一直备受关注。 随着甲壳类食品消费的增加,其致敏率也越来越高,目前全世界高达2.5% 的人群遭受甲壳类食品过敏的痛苦[2]。 甲壳类食品过敏主要为IgE 介导的I 型超敏反应,是在外源甲壳类食品过敏物质的激发下,产生足够量的IgE 抗体,并与肥大细胞或嗜碱粒细胞上的高亲和力受体结合,进一步诱导肥大细胞或嗜碱性粒细胞脱释放致敏介质,而引发机体产生一系列生理功能紊乱[4-5]。 与牛奶和鸡蛋等其他食物过敏不同,甲壳类食品过敏主要流行于成年人群中,并可能伴随一生。 甲壳类食品过敏可诱发过敏患者出现皮肤红肿、瘙痒、皮疹、荨麻疹和血管性水肿等皮肤症状,以及恶心、呕吐、 腹痛和痉挛等胃肠道反应[3]。
由于食物致敏机理的复杂性,目前在临床上尚没有安全有效根治食物过敏的手段,严格规避含有甲壳类食品致敏成分是当前最有效的防治措施。 为了全面保障甲壳类食品的食用安全,除了必要的标签标示管理之外,国内外研究者针对甲壳类食品的过敏原及其消减技术展开了一系列的研究,致力于开发低致敏性或脱敏甲壳类食品,保障甲壳类食品过敏人群的安全。 本文阐述了目前国内外有关甲壳类食品主要过敏原及其致敏性消减技术的研究现状,以期为甲壳类食品过敏的预防与控制提供理论指导。
1 甲壳类水产品过敏原
大部分甲壳类水产品过敏原主要存在于可食用肌肉部分,它们的生理功能是参与肌肉运动和能量代谢。 随着蛋白质鉴定和过敏原定性技术的发展,一些甲壳类水产品的过敏原已经被陆续鉴定。 目前,国内外学者已从甲壳类水产品中鉴定出10 余种过敏原组分,其中主要过敏原蛋白为原肌球蛋白(tropomyosin,TM),其次是精氨酸激酶(arginine,AK)、肌质钙结合蛋白(sarcoplasmic calcium-binding protein,SCP)、肌球蛋白轻链(myosin light chain,MLC)、磷酸丙糖异构酶蛋白(triosephosphate isomerase,TPI)、肌钙蛋白C(troponin C,TnC)和血蓝蛋白(hemocyanin,HC)等[5],见图1。
1.1 原肌球蛋白
TM 是人和动物肌肉收缩过程中重要的调节蛋白,在脊椎动物和无脊椎动物中均广泛存在;它在细肌丝中与肌动蛋白双螺旋并行存在,参与完成体内多种生命活动。 然而,甲壳类水产品肌肉组织中的TM 被认为是所有可食用甲壳类水产品中的主要无脊椎动物泛过敏原,可与72% ~98%的甲壳类食品过敏患者血清产生特异性IgE 结合[5]。 自1981年,TM 首次被鉴定为褐虾(Penaeus aztecus)的一种过敏原[6],随后TM 在斑节对虾(Penaeus monodon)[7]、克氏原螯虾(Procambarus clarkii)[8]、雪蟹(Chinopecetes opilio)[9]等水产品中被陆续发现。 TM 结构和理化性质也相继被鉴定,研究发现TM 是一类非常保守的高度稳定的同源二聚体蛋白,由284 个氨基酸组成,分子质量分布在32 ~38 kDa,等电点约为4.2[3,10]。 TM 是由两个相同的α-螺旋构型的多肽链相互缠绕而形成的超螺旋结构[图1(a)],这种形式的二级和三级结构赋予了TM 结构的稳定性,因此它能够耐受高温和高压加工条件,并保持其致敏性[11-12]。

图1 甲壳类水产品主要过敏原的三维结构Fig.1 Three-dimensional structure of mainly crustacean allergens
除此之外,已有研究报道TM 同时也是蟑螂、尘螨和软体贝类的主要过敏原,因此TM 具有一定的交叉反应性。 TM 高度保守的氨基酸序列是交叉反应的主要原因[5]。 甲壳类水产品的TM 在其物种之间表现出高度的保守性和氨基酸序列的一致性,序列相似性为88% ~100%。 由于近的起源关系,甲壳类水产品的TM 与蟑螂和尘螨有很高的序列一致性,分别为80% ~97%和78% ~98%。 在对尘螨或蟑螂过敏的人群中,证明了对虾过敏的IgE 反应性。值得注意的是,甲壳动物的TM 与软体动物的TM(55% ~65%)以及脊椎动物的TM(54% ~60%)有较低的序列一致性[5,10]。
1.2 精氨酸激酶
AK 是一种广泛存在于无脊椎动物体内的磷酸原激酶,是无脊椎动物能量代谢中的一种重要酶,参与调节细胞ATP 水平。 AK 被鉴定为甲壳类水产品中仅次于TM 的一种重要过敏原。 对AK 血清特应性结合研究发现,10% ~51%的虾过敏患者血清会出现特异性IgE 反应。 自Yu 等[13]首次从黑虎虾(Penaeus monodon)鉴定AK 为一种甲壳类过敏原,相继发现AK 也是北海褐虾(Crangon crangon)[14]、南美白对虾(Litopenaeus vannamei)[15]、勇士棕蟹(Callinectes bellicosus)[16-17]、拟穴青蟹(Scylla paramamosain)[18]和罗氏沼虾(Macrobrachium rosenbergii)[19]等多个甲壳类物种中的特异性致敏成分。 其中,南美白对虾(Litopenaeus vannamei)[20]、拟穴青蟹(Scylla paramamosain)[21]等甲壳类水产品中AK 的晶体结构也已经通过X-射线衍射及核磁的手段被解析。 研究发现,AK 由359 个氨基酸残基组成,分子质量为38 ~45 kDa,等电点为6.0,其蛋白三维结构包含一个N 端的α 螺旋结构域和一个C 端的αβ 结构域[图1(b)][13]。 AK 广泛存在于各种甲壳类水产品中,具有较强的交叉反应性。 与TM 一样,AK 也被认定为一种无脊椎动物的泛过敏原。 对软体动物章鱼、虾和蟹等甲壳类水产品中AK 一级序列的同源性比对发现,他们之间的序列同源性高达54%。 此外,结构预测发现他们的三级结构也高度相似。
1.3 肌质钙结合蛋白
SCP 属于EF hand 钙结合蛋白家族,含有特征的helix-loop-helix 的Ca2+结合域,其主要位无脊椎动物肌肉和神经组织中,在无脊椎动物体内调节肌肉收缩中发挥着重要的作用[图1(c)]。 同时,SCP也被鉴定为甲壳类水产品的另一种过敏原,其分子质量约为20 kDa,等电点约为4.6。 2008年,Shiomi等[22]首次通过阴离子交换色谱结合反相高效液相色谱法从斑节对虾(Penaeus monodon)中纯化出SCP蛋白,并通过虾过敏患者血清与斑节对虾SCP 免疫反应发现,8/16(50%)的虾过敏血清与SCP 有特异性IgE 反应。 随后,国内外研究者分别在北海褐虾(Crangon crangon)[14]、南美白对虾(Litopenaeus van-namei)[4]、拟穴青蟹(Scylla paramamosain)[23]中也分别检测到SCP。 值得注意的是,Ayuso 等[4]发现南美白对虾(Litopenaeus vannamei)SCP 对17/20 例(85%)虾过敏儿童血清具有特异性IgE 结合活性,证明SCP 可能是导致儿童出现虾过敏疾病的主要过敏原。
此外,研究发现SCP 在同一物种或相似的物种中具有显著的氨基酸序列同源性,且具有较强的交叉反应性,然而不同物种之间氨基酸序列差异性较为显著。 如在甲壳类水产品中的SCP 序列相似性为80% ~98%,然而甲壳类水产品和软体类水产品之间的氨基酸序列同源性则仅有15% ~21%[2]。 SCP 是热稳定的钙结合蛋白,且具有较强的酸碱稳定性(在pH 值1 ~11 稳定),包含4 个EF hand 结构域,其中2 个或3 个保留了只结合Ca2+或混合Ca2+和Mg2+的能力[2,5],其中Ca2+对SCP 构象和IgE 活性的维持扮演着重要作用。 SCP是一类有3 个亚基(SCP-Ⅰ、SCP-Ⅱ和SCP-Ⅲ)的过敏原,且所有这些异构体都显示出IgE 结合能力[2]。
1.4 肌球蛋白轻链
MLC 是肌球蛋白大分子复合物的一部分,构成功能型肌肉蛋白结构,MLC 在肌肉收缩中起着重要的作用,因为它的磷酸化会在收缩过程中影响肌动蛋白-肌球蛋白复合物[2,5]。 MLC 属于结合蛋白样蛋白家族,通过EF hand 结构域结合Ca2+,且具有较强的热和极端pH 值下的稳定性[图1(d)]。MLC 首先被Ayuso 等[24]确定为南美白对虾(Litopenaeus vannamei)的过敏原,并将其命名为Lit v 3,后来又在斑节虾(Penaeus monodon)[25]、美国螯龙虾(Homarus americanus)[26]、 北 海 褐 虾(Crangon crangon)[14]和拟穴青蟹(Scylla paramamosain)[27]中被再次确认。 到目前为止,一些MLC 已被确定为各种甲壳类水产品的过敏原,对MLC 呈现致敏性的甲壳类过敏患者从19% ~55%不等。 血清IgE 结合研究表明:与儿童相比,成人对MLC 的识别率更高,但目前关于MLC 在甲壳类水产品或其他物种之间的免疫学交叉反应的数据仍然缺乏。
1.5 磷酸丙糖异构酶
TPI 是一种广泛存在于甲壳类水产品中的酶蛋白,分子质量在26 ~29 kDa,耐热性差,但耐酸碱性强。 天然状态TPI 主要以二聚体的形式存在,其主要功能是参与葡萄糖能量代谢[5][图1(e)]。 到目前为止,TPI 已在斑节对虾(Penaeus monodon)[28]、北海褐虾(Crangon crangon)[29]和拟穴青蟹(Scylla paramamosain)[14]中被鉴定为过敏原。 TPI 被认为是一种次要的过敏原,虾过敏血清IgE 结合测试发现特异性结合率在15% ~23%。 此外,除甲壳类水产品外,TIM 也在某些软体、蟑螂和植物中被鉴定为过敏原,但尚未对这些物种之间由TIM 导致的交叉反应性进行详细研究[5]。
1.6 血蓝蛋白
HC 主要位于节肢动物和软体动物类的头胸部,在动物呼吸及多种生理活动中扮演关键作用。天然状态下,HC 是以6 个高度螺旋异源亚基构成的六聚体[图1(f)],且其亚基的数量具有物种特异性,亚基分子质量为72 kDa 或75 kDa,具有良好热稳定性和耐胰酶消化特性[2]。 在2011年,HC 首次被鉴定为罗氏沼虾(Macrobrachium rosenbergii)的过敏原[30]。 Piboonpocanun 等[30]经离子交换色谱从罗氏沼虾(Macrobrachium rosenbergii)中提取纯化获得两个高分子质量的蛋白亚基(72 kDa 和75 kDa),经LC-MS/MS 鉴定为HC,通过虾过敏血清IgE 测试试验发现其具有显著的特异性IgE 反应。 蛋白序列比对发现,72 kDa 和75 kDa 的两个蛋白亚基与其他甲壳类水产品的HC 序列同源性在62.5% ~100%。同时,此项研究也显示在未处理和煮处理后的HC提取物中均检测到了一定的IgE 结合活性,表明HC是又一类甲壳类热稳定的过敏原。 不同的是,Guillen 等[31]通过血清IgE 反应性发现只在未处理的虾提取物中发现了IgE 结合,煮处理的虾提取物IgE 活性完全丧失,可能这种蛋白质只是在某种程度上具有热稳定性,还需要进行更多的研究来证实这个问题。 此外,Guillen 等[31]报道了3 位在摄入南美白对虾(Litopenaeus vannamei)后出现过敏性休克的患者,血清IgE 测试发现均与血蓝蛋白有较强IgE反应,这也是第一例在南美白对虾中发现HC 为过敏原的报告。
1.7 其他过敏原成分
除了常见甲壳类过敏原以外,随着国内外学者对食物过敏研究的重视,越来越多过敏成分陆续被发现。 Lee 等[32]发现在未处理和蒸处理的南美白对虾(Litopenaeus vannamei)提取物中一个63 kDa 的蛋白条带可与4/7 名虾过敏患者的血清发生特异性结合反应,随后该蛋白通过蛋白质组学质谱法被鉴定为丙酮酸激酶。 Yang 等[29]发现克氏原螯虾(Pro-cambarus clarkii)肌肉提取物中90 kDa 蛋白具有高的IgE 结合活性,进一步采用硫酸铵分步沉淀及阴离子交换柱层析,提取纯化并鉴定其为新型过敏原细丝蛋白C(filamin C)。 此外,在甲壳类水产品中发现的肌球蛋白重链、α-肌动蛋白、平滑内质网Ca2+ATP 酶和甘油醛-3-磷酸脱氢酶也被鉴定为过敏原[2,5]。 然而,它们的分子结构特征和致敏潜力还需要进一步研究。 随着分子生物学和免疫学技术的不断发展,对甲壳类水产品过敏原成分的研究一定会更加深入。
由研究报道可知,甲壳类水产品主要过敏原见表1[4,7-8,13-19,22-30,33-43]。

表1 甲壳类水产品过敏原Tab.1 Allergens of crustacean aquatic products
2 甲壳类水产品过敏原致敏性消减技术
甲壳类过敏原主要是水溶性糖蛋白,分子质量为10 ~70 kDa,对常规加热和酸处理具有一定耐受性。 过敏原的免疫活性主要取决于其抗原表位的保留和IgG 或IgE 的识别。 研究表明:热加工和非热加工技术可能会导致蛋白的变性、聚集、交联、氧化和糖基化等从而掩盖或破坏过敏原抗原表位,进而改变食品过敏原致敏性[1-2]。 近年来,国内外研究者系统探究了不同的加工方法对甲壳水产品过敏原致敏性的影响,以期制备低敏或无敏甲壳类食品。根据原理的不同,可将这些手段分为物理加工消减技术、化学修饰消减技术和生物修饰消减技术。 表2 总结了目前常见加工技术类型及其对甲壳类水产品过敏原免疫反应性的影响[11-12,33,44-62]。
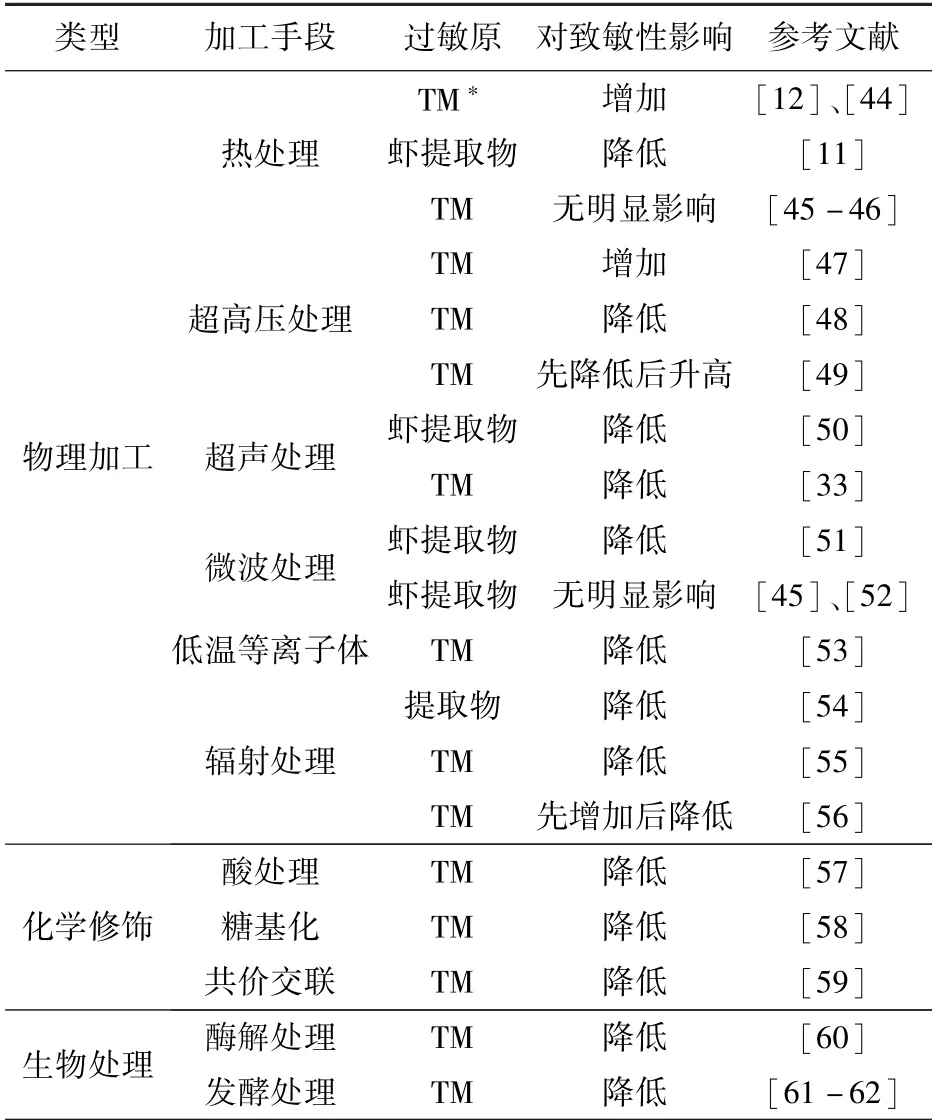
表2 不同甲壳类水产品过敏原致敏性消减技术Tab.2 Summary of different processing technologies for mitigating crustacean allergenicity
2.1 物理加工消减技术
物理加工是目前应用最广泛的食品加工方式,包括热处理、高压处理、超声处理、微波处理和低温等离子体处理等。
2.1.1 热处理消减
传统热处理是最常用的物理处理方式,且热处理的方式较多,如煮处理、蒸处理、高压蒸汽处理和微波处理等。 一般来说,食品的热处理过程伴随着不同的修饰反应,如蛋白变性、肽键的破坏、二硫键的重排以及与其他成分包括碳水化合物和脂类的相互作用[2,44]。 Kamath 等[44]发现煮处理的甲壳类(虾、龙虾和螃蟹)过敏原提取物中仅有两个主要过敏原组分,分别为TM 和SCP,且免疫印迹分析发现煮处理的TM 具有更高的IgG结合能力。 Zhao 等[11-12]也发现不同烹饪处理使南美白对虾(Litopenaeus vannamei)提取物的IgG 和IgE结合能力显著降低,但不能完全消除其IgG 和IgE反应性,其中,热处理后虾提取物中的TM 具有更高的IgG 和IgE 反应性。 然而,Lasekan 等[45]发现蒸处理、煮处理、炸处理、烤处理和微波处理的斑节对虾(Penaeus monodon)TM 致敏性无明显变化,但高压蒸汽处理(0.14 MPa、121 ℃、20 min)可显著降低虾TM 的IgE 结合能力。 相似地,Yu 等[46]分析比较热处理、超声结合热处理及高压蒸汽处理的拟穴青蟹(Scylla paramamosain)主要过敏原TM 致敏性和消化性的影响,结果发现,仅加热处理后的TM 致敏性和消化性无明显变化,然而加热结合微波处理与高温高压处理(0.14 MPa、121 ℃、20 min)的TM 表现出显著降低的IgE 结合能力和消化稳定性。 研究表明:热处理可在一定程度上可以降低甲壳类过敏原的整体致敏性,但难以完全消除过敏原致敏性,甚至虾主要过敏原组分TM 表现出更高的致敏潜力。热处理结合其他非热加工形式,如高压和微波处理,具有更好的致敏性消减潜力。 值得注意的是,热处理对甲壳类过敏原影响结果表现出不一致性,可能与处理样品、热处理的条件或过敏原组分的耐热性不同有关,未来仍需要进一步研究明确。
2.1.2 超高压消减
超高压处理主要通过破坏蛋白的一些非共价键,如氢键、离子键和疏水相互作用,从而实现对蛋白质结构的修饰,但一般不会涉及蛋白一级结构的改变[63]。 近年来,人们陆续探究了高压处理对食品致敏性的影响,其可能的机制包括蛋白质变性、构象改变、促进酶解等,达到致敏性消减的作用。 此外,高压处理通过提取或释放膜内的过敏原到外部环境中,从而使这些分子可以被水解酶去除而破坏,达到间接减轻或消除一些食品的致敏性,但不需要消除致敏蛋白本身[2]。 Long 等[48]对南美白对虾(Litopenaeus vannamei)提取物进行高压和/或热处理,并通过竞争ELISA 和BALB/c 小鼠过敏模型分析了TM的致敏性,与煮处理的TM 相比,当样品在55 ℃、500 MPa 下处理10 min,发现IgE 结合能力减少73.59%。 此外,在BALB/c 小鼠过敏模型中,高压结合55 ℃热处理的TM 喂养的小鼠,其特异性IgE水平明显降低,同时血清中的组胺水平也显著低于阳性对照组。 胡志和等[49]采用不同高压处理凡纳滨对虾(Litopenaeus vannamei)TM,结果发现随着处理压力的增加TM 致敏性出现先减弱后增强的趋势,在300 MPa 处理40 min 的TM 疏水性残基暴露程度最小,致敏性最低,然而700 MPa 处理条件的TM 疏水性残基暴露程度最高,且致敏性最高。Faisal 等[47]利用高压蒸汽处理(600 MPa、120 ℃、5 min)结合不同温度(40、80、120 ℃)热处理墨吉对虾(Penaeus merguiensis)提取物5 min,发现其致敏性先出现显著增加,后与未处理样品无明显差异;相同条件处理10 min,发现虾提取物其致敏性出现先显著增加,后显著降低,结果的不同可能归因于加工过程中IgE 结合表位的暴露与掩盖。 研究结果表明:在高温条件下,通常会获得普遍的致敏性降低的效果,不同的研究结果可能归因于样品和处理条件,如温度、压力、处理时间等的不同。 此外,当进行某些样品的处理时,应对处理参数进行优化,并需要进行更多的动物和人体试验来确认致敏性降低的可行性。
2.1.3 超声消减
高强度超声波是一种机械振荡频率高于20 kHz的声波,其作为一种新型的食品加工技术被广泛应用于食品加工过程中的干燥、均质、过滤、提取、酶灭活和肉类嫩化等。 同时,这种含有能量的超声波振动引起的与食品基质的相互作用,可产生一系列机械效应、热效应和空化效应,导致部分蛋白质的三维结构发生改变[63]。 研究表明:超声处理可导致过敏原结构改变,从而降低食物过敏原的致敏性。 Li等[64]利用超声处理南美白对虾(Penaeus vannamei)过敏原提取物,通过免疫印迹和ELISA 试验分析发现超声处理能够降低虾过敏原蛋白的IgE 结合能力,并推断这可能归因于超声波的空穴效应破坏了虾过敏原的IgE 结合表位。 Zhang 等[33]探究了高强度超声处理对秀丽白虾(Exopalaemon modestus)TM结构、体外消化性和致敏性的影响,发现超声处理导致TM α-螺旋含量显著减少,而β-折叠、β-转角和无规则卷曲含量增加。 通过免疫印迹和ELISA 分析发现这些结构的变化降低了TM 的致敏性,并有助于TM 消化性的改善。 Dong 等[50]探究了高浓度超声处理对南美白对虾(Litopenaeus vannamei)理化性质和致敏性的影响,超声处理(20 kHz、400 W)虾过敏原含量随着时间的延长而逐渐降低,在20 min 时具有最低的致敏性,TM 含量减少了76%,且体外消化性显著提高。 刘光明等[52]发现超声处理可显著降低拟穴青蟹(Scylla paramamosain)TM 的致敏性和消化稳定性,并发现结合蒸煮处理效果更好,其可能原因是超声处理使TM 蛋白结构发生一定改变,进一步结合蒸煮处理可导致TM 结构的进一步降解与结构变化,有利于后续蛋白酶的酶解。 相似的,Yu 等[65]发现单独蒸煮处理对拟穴青蟹(Scylla paramamosain)TM 致敏性和消化性无明显影响,但蒸煮结合超声处理可显著降低TM 致敏性和消化稳定性。 高强度超声作为一种新型的非热加工技术,在降低食品的致敏性方面表现出巨大的潜力。 与热加工技术相比,它消耗的能量更少,传质率更高,而不改变食品的基本特性,但超声处理也很难消除虾的过敏原致敏性,超声处理协同其他加工技术,如热处理、高压蒸汽处理等,将更具应用潜力。
2.1.4 低温等离子体消减
低温等离子体技术是一种新兴的食品非热加工技术,具有食品组分破坏性小、杀菌效率高、作用时间短等优点,并可以改善食品理化特性,已成功应用于肉制品保藏和果蔬杀菌保鲜等领域[63]。然而,目前关于低温等离子体处理对于甲壳类水产品过敏原致敏性消减的影响研究较少,关于冷等离子体降解过敏原的确切机制和详细路径仍有一些不确定性。 研究表明,低温等离子体处理可造成蛋白质肽键的断裂,氨基酸残基的氧化和蛋白质-蛋白质交联的形成,进一步诱发蛋白质结构的破坏引起过敏原线性和构象表位的变化,从而消减过敏原的IgE 结合能力[1]。 最近,Ekezie等[66]探究不同时间低温等离子体处理南美白对虾(Litopenaeus vannamei),发现低温等离子体处理后的虾提取物pH 值和蛋白质溶解度显著下降,且低温等离子处理对虾的理化和结构特征有相当大的影响。 在另一项研究中,Ekezie 等[53]利用低温等离子体处理南美白对虾(Litopenaeus vannamei)TM,发现虾TM 的二级结构发生显著变化,出现α-螺旋含量降低,β-折叠和无规则卷曲含量升高,最终使得TM 的IgE 和IgG 结合能力下降。 Shriver 等[67]发现,南美白对虾(Litopenaeus vannamei)经30 kV、60 Hz 的等离子体处理5 min,虾TM 致敏性降低76%。 可见,低温等离子体技术可以有效降低甲壳类水产品过敏原致敏性,但还需要更多的研究来证实其有效性,并优化等离子体处理参数。
2.1.5 辐照消减
辐照处理是另一种新型的非热加工技术,可促进生物大分子的降解、交联和分子构象的变化,破坏或改变抗体结合点,使过敏原的致敏性降低,甚至完全丧失[55-56]。 最近,Muanghorn 等[68]采用γ-辐射处理罗氏沼虾(Macrobrachium rosenbergii),在免疫印迹分析中发现,γ-辐照处理导致TM 免疫印迹条带强度显著降低,这可能归因于γ-辐照改变了TM结构,导致IgG 无法识别。 研究表明辐照结合热处理可以更好地达到降低过敏原致敏性的效果,且辐照剂量在过敏原的消减中扮演重要作用[54]。 然而,Liu 等[56]研究了辐照处理对冷冻刀额新对虾(Metapenaeus ensis)的影响,发现在辐照剂量为0 ~3 kGy时,IgE 结合能力出现明显增加,随着进一步辐照剂量的增加(3 ~10 kGy),TM IgE 结合能力出现降低,随着剂量增加到10 kGy,TM 的IgE 结合能力仅降低约20%。 这可能是由于辐照的能量无法穿透冷冻虾。 此研究与Costa 等[69]报道结果一致:高剂量和长时间的辐射可造成过敏原结构变化,降低TM 的IgE 结合能力,而小剂量的辐射则使其增加。应该指出的是,辐照处理似乎并非是控制甲壳水产品过敏原的理想技术。 因为低剂量的辐照剂量可能会增加其致敏性,虽然高剂量的辐照可使甲壳类水产品过敏原的致敏活性下降,但高剂量的辐照可能会引起剂量残留,从而对消费者产生不良影响。
2.2 化学修饰消减技术
2.2.1 酸处理消减
食物基质环境中酸碱性的变化是加工过程中的常见环节,也是目前工业化以“碱溶酸沉”为主要工艺生产分离蛋白的基本原理之一。 目前,关于酸处理后甲壳类水产品过敏原致敏性变化报道较少。Perez-Macalalag 等[70]发现,经煮处理并预先在醋中浸泡8 h 的虾提取物表现出更低的致敏性。 然而,Lasekan 等[57]发现在pH 值为1.0 ~3.5 的醋中腌制的虾可溶性肌纤维蛋白的可提取性明显降低,大量的TM 出现在不溶性沉淀中,且可溶性蛋白部分中的TM 表现出IgE 结合能力的显著降低。 然而,所有腌制虾的不溶性蛋白部分的TM 都显示出更强的IgE 结合能力。 酸处理对过敏原结构修饰进而消减其致敏性,主要是通过蛋白质内部氨基酸质子化实现的。 在低于蛋白等电点的条件下,溶液中多余的H+将使蛋白质分子中的自由氨基和羧基质子化,分子内部将发生相同电荷的相互排斥,从而导致蛋白质结构的解折叠,进而破坏其构象表位,导致致敏性显著降低。 然而,在存在大量线性表位的情况下,酸性条件可能无法降低其致敏性。
2.2.2 糖基化消减
糖基化是广泛存在于食品工业中蛋白质和糖之间的一种非酶褐变,是还原糖的羰基和氨基酸的游离氨基(通常是精氨酸和赖氨酸)在食品热加工或长期储存后发生的反应,又称美拉德反应。 研究发现,美拉德反应可引起蛋白功能特性、生物利用率、免疫反应性和致敏性的改变,其主要机理是通过氨基酸和糖相互作用导致蛋白质三级结构的改变,从而改变了它们的构象表位。 此外,形成的高分子质量和不溶性聚集体的形成有助于掩盖构象和线性表位,从而降低了糖化蛋白的潜在致敏性[58,71]。 国内外众多学者研究发现糖基化反应能够消减食物过敏原的致敏性,且消减程度主要取决于所用还原糖的种类。 Zhang 等[58]利用不同分子质量糖与秀丽白虾(Exopalaemon modestus)TM 进行糖基化,发现分子质量越小的糖分子越易与TM 发生糖基化反应,进而产生更多糖基化终产物(advanced glycation endproducts,AGEs)。 此外,动物实验发现,与未糖基化的TM 相比,糖基化的TM 能够显著降低小鼠脾脏和肠系膜淋巴结淋巴细胞内Th2 型细胞因子(IL-4和IL-13)和Th1 型细胞因子(IL-10 和TGF-β)的分泌,减弱对小鼠的过敏反应。 此外,Fu 等[72]利用核糖、低聚半乳糖和低聚壳聚糖与中国对虾(Penaeus chinensis)TM 过敏原进行美拉德反应,发现不同类型糖糖基化均可显著降低TM α-螺旋含量,造成TM结构和表位的显著变化,导致TM 致敏性均显著降低,致敏性最高可降低60%。 Han 等[71]利用核糖、阿拉伯糖、乳糖、葡萄糖和麦芽糖与拟穴青蟹(Scylla paramamosai)TM 和AK 进行美拉德反应,发现糖基化后的TM 和AK 致敏性均有不同程度的下降。 值得注意的是,糖基化和交联反应较难控制,生成的有害伴随产物(如AGEs)存在潜在安全风险等。
2.3 生物修饰消减技术
2.3.1 酶处理消减
酶解处理是温和的,可以破坏蛋白质的一级蛋白序列和原始功能特性,已被认为是降低致敏性的有效工具。 常用的水解酶,如胰蛋白酶和木瓜蛋白酶;而其他酶包括酪氨酸酶、多酚氧化酶和漆酶,主要用于蛋白质的交联[10]。 相应的机制主要分为两种方式。 1)TM 可以被蛋白酶水解为多肽、氨基酸或其他小分子,从而改变空间构象[2];2)由酶引起的分子间或分子内交联导致了蛋白质构象的破坏[59]。 Huang 等[73]分别用胃蛋白酶和胰蛋白酶研究了锯缘青蟹(Scylla serrata)TM 在模拟胃液(SGF)和模拟肠液(SIF)中的消化稳定性,结果显示,在SGF 中,肌动蛋白和肌球蛋白重链被胃蛋白酶迅速降解,而TM 对胃蛋白酶有一定的抵抗力。 然而,在SIF 系统中,肌球蛋白重链被迅速降解,而肌动蛋白表现出与TM 同样的抗胰蛋白酶消化性。 在另一项研究中, Mejrhit 等[74]发现虾TM 经胃蛋白酶(30 μg/mL)在条件下pH 2 处理2 h,结果显示酶解后的TM 与20 种人血清IgE 的识别度下降89.4%,而与兔IgG 的识别度下降90.5%。 当结合加热(90 ℃) 时, IgG 结合能力的最大下降幅度为85.1%。
2.3.2 发酵处理消减
利用双歧杆菌、乳酸杆菌等益生菌发酵,是当前应用较多的一种食品加工工艺。 利用益生菌对食物进行发酵处理,可以使难溶解的大分子物质在益生菌分泌物的作用下分解为易溶的小分子物质,不仅能够改善质地、风味、营养价值,增加稳定性,而且还能够降低过敏原的致敏性。 目前,关于发酵大豆制品、发酵牛乳制品和发酵小麦制品相关研究已有较多报道,发现发酵制品致敏性明显低于其非发酵制品[75]。 食物中的过敏原主要为蛋白质,通过发酵处理可以大分子蛋白分解或变性,破坏其构象表位和线性表位,以达到消除过敏原或降低致敏性的目的。Park 等[62]发现采用传统韩国泡菜发酵工艺处理的日本毛虾(Acetes japonicus)致敏性显著降低。 李鸿雁等[61]报道了乳酸菌发酵可显著降低海虾过敏原致敏性,在采用乳酸菌发酵温度为37 ~42 ℃,发酵时间48 ~60 h 的虾肉中已无IgE 结合能力。
3 结论与展望
当前,食物过敏的发病率逐年攀升,这给社会、家庭及个人带来了严重的经济及健康负担。虽然,目前对甲壳类过敏原鉴定、理化性质表征、抗原表位的确认及过敏原消减技术的研究已经取得了一定进展,但仍有很多方面值得深入研究。首先,虽然一些甲壳类过敏原已经被鉴定,甚至三维结构晶体已被表征,但抗原表位尚未完全阐明,且仍需采过敏患者血清进一步挖掘新的甲壳类过敏原,以实现更好的过敏诊断和预防。 其次,目前过敏原消减技术机制研究大多集中在整个过敏原,而不是特定的过敏原表位区域。 表位是位于蛋白质特定区域的氨基酸序列,通常被受体细胞识别,可以激活淋巴细胞引发免疫反应,是过敏原致敏性的分子基础。 因此,在随后的研究中,可以应用跨学科的技术和生物学方法,如重叠合成肽、噬菌体展示、表面等离子体共振、蛋白质芯片和生物信息学方法等来识别这些特定的表位区域,更好阐明不同加工技术对过敏原结构和表位修饰的影响机制,以开发适合过敏性患者食用的低致敏甲壳类食品。 此外,多种过敏原消减技术被证实可以降低甲壳类水产品过敏原致敏性,但目前仅处于研究阶段,离实际应用还有一定距离。 并且单一加工技术手段的应用难以彻底消除多种过敏原致敏性,结合不同新型加工技术的优势可能为过敏原致敏性完全消除提供一个可靠解决方案,同时保持甲壳类水产品的感官和质量特性,这些可以成为未来研究的主题。 最后,国内外研究者还需要进行体内外毒理学分析,由于个体差异过敏症患者可能对加工的甲壳类产品有完全不同的反应。 需要更多的动物和人体试验来确认这些创新的非热能技术的可行性,同时也应认真考虑人体试验的伦理问题。 总之,未来研究者有必要继续深入系统地研究甲壳类水产品过敏原及其消减技术,为推进过敏原消减技术的实际应用,开发低致敏性甲壳类食品提供依据。

