川青牛胆离体繁殖技术优化研究
胡莹莹 唐 莉 罗 新 刘 帆 黄雪丽* 吴建国 朱福勇
(1雅安三九中药材科技产业化有限公司,四川雅安 625099;2四川农业大学农学院,四川成都 611130)
青牛胆(Tinospora sagittata (Oliv.) Gagnep.)为防己科青牛胆属多年生草质藤本,又称金果榄[1],含金果榄苷、非洲防己碱、古伦宾等多种有效成分,以干燥块根入药[2-3],具有治疗咽喉肿痛、泄泻痢疾、抗炎镇痛[4-5]等功效,主产地为四川、湖南和广西等[6]。全球范围内已发现的青牛胆属植物有30多种,我国境内发现的有11种,其中6种具有药用价值[7]。随着医药业的发展,我国对青牛胆的需求迅速增加,导致人们滥采滥挖。20世纪末青牛胆曾一度濒临灭绝[8]。野生青牛胆主要生长在阴暗潮湿处[9],且雌雄异株,自然环境下雄株数量远大于雌株,自然结实率低,加速了野生资源的减少。人工栽培是缓解青牛胆供需矛盾、拯救青牛胆野生自然资源的有效措施,而种苗则是人工栽培所面临的首要问题,目前对青牛胆的研究主要集中于化学成分、药理以及资源调查等方面,种苗繁育方面鲜有报道。
青牛胆组织培养可实现周年化生产,具有增殖系数较高、占用空间少、管理方便、培养条件可控性强、有效保存优良性状等优点。当前,仅有广西青牛胆的离体快繁技术[10-12]有一定研究,四川青牛胆离体快繁未见报道。本研究利用四川地方优质青牛胆幼嫩枝条为外植体,优化了快速繁殖培养基配方,对青牛胆离体繁殖技术体系进行补充和优化,可为青牛胆人工栽培提供大量优质种苗,以期为实现规模化生产提供技术支撑,为建立优质、高效种苗规范化生产和新品系选育提供技术参考。
1 材料与方法
1.1 试验材料
四川雅安三九药业有限公司提供的优质青牛胆幼嫩茎段。
1.2 试验设计
试验采用3因素3水平正交试验设计,A是6-BA(6 苄基腺嘌呤)浓度,设置梯度为 1、2、4 mg/L;B 是NAA(萘乙酸)浓度,设置梯度为 0.1、0.2、0.4 mg/L;C 是 2,4-D(2,4-二氯苯酚)浓度,设置梯度为 0、0.1、0.2 mg/L(表1)。
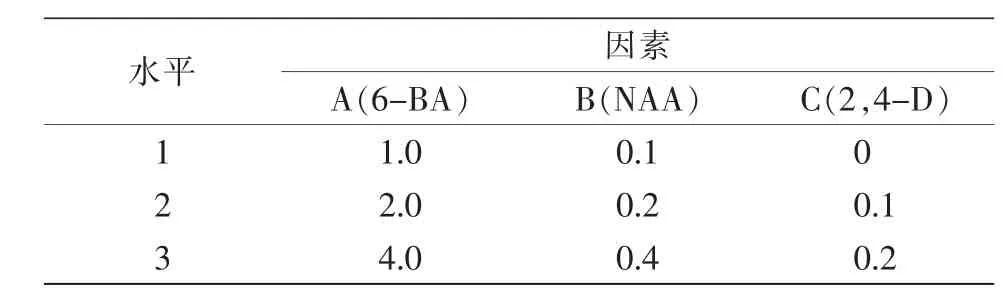
表1 幼嫩茎段诱导因素水平 单位:(mg·L-1)
1.3 试验方法
1.3.1 试验材料处理。选取新鲜健康的青牛胆幼嫩茎段,剪切为3~4 cm茎段,自来水冲洗30 min,在无菌条件下用75%乙醇浸泡20~30 s,再用0.1%氯化汞处理10 min,无菌水冲洗4次,备用。
1.3.2 启动培养。向MS基础培养基中附加不同浓度配比的植物生长调节剂(表1),附加30 g/L蔗糖和5.5 g/L琼脂。将幼嫩茎段(1.5~2.0 cm)接种至诱导培养基中,每瓶接种6个外植体,每个处理接种5瓶,3次重复。接种后黑暗培养14 d,再移至光照强度2 000 lx、光照时数 12 h/d、温度(23±2)℃条件下进行培养。40 d后记录不同培养基配方下幼嫩茎段诱导率及不定芽生长情况,并筛选出最佳幼嫩茎段诱导培养基。
1.3.3 增殖培养。将启动培养基中诱导出的不定芽剪切成1~2 cm茎段,转接至表2增殖培养基中,在培养基中附加30 g/L蔗糖和5.5 g/L琼脂,每瓶6个外植体,每个处理接种5瓶,3次重复。在光照强度2 000 lx、光照时数 12 h/d、温度(23±2)℃条件下培养,40 d后统计增殖系数及其长势。
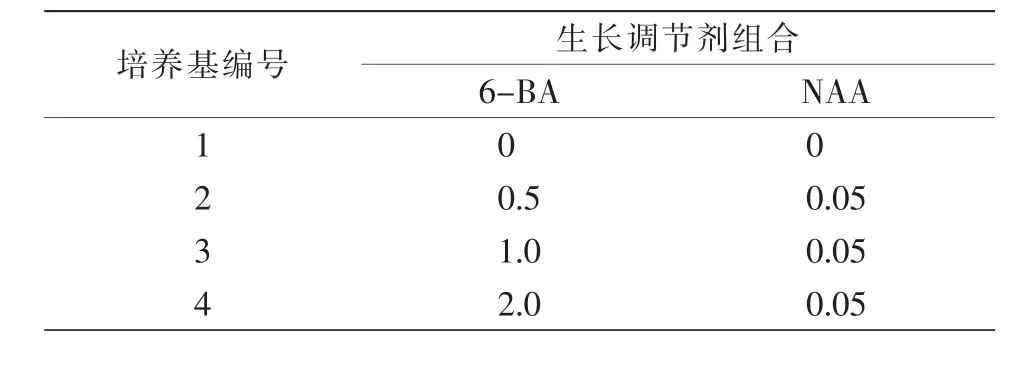
表2 增殖培养植物生长调节剂配比单位:(mg·L-1)
1.3.4 生根培养。采用单因素设计,在MS基础培养基中,添加不同浓度的NAA和IBA(表3)。将组培苗剪切至1~2 cm,转入生根培养基,每瓶接6株,每个处理5瓶,3次重复。接种后在光照强度2000lx、光照时数 12 h/d、温度(23±2)℃条件下培养。 40 d后记录生根率和新生根生长情况,筛选出最佳生根培养基。
1.3.5 炼苗移栽。生根苗炼苗后移栽,移栽15 d后统计成活率。
2 结果与分析
2.1 不同植物生长调节剂配比对不定芽诱导的影响
由表4可知,除9号处理外,其他8个处理均可成功诱导出不定芽。从诱导率看,1号处理腋不定芽诱导率最高,达90.0%;其次为4号、2号和3号培养基,诱导率分别为86.7%、83.3%和80.0%。从分株数量分析,1号处理和4号处理分株数量最高,分别为4.1株和3.6株,远高于其他处理组合。从不定芽生长状况分析,1号、2号、3号、4号处理,经过15 d培养,基部叶子变黄,基部膨胀变大,随着培养时间的延长,诱导不定芽的叶色绿,芽健壮,顶端有绿色叶子萌动迹象。但是,生长速率有所差异,其中,1号和4号处理生长速率均较快,芽的长度最长。5号和6号培养基诱导率分别为76.7%和43.3%,诱导芽较纤细,叶片均未舒展。7号、8号、9号培养基诱导效果最差,诱导愈伤组织,且愈伤组织疏松,呈浅黄色,仅有少量的芽点,随着培养时间的延长,基部变黑变大,基部附近培养基出现褐化现象,原有的顶芽黄化,茎部萎缩,生长迹象逐渐消失,逐渐褐变死亡。综上所述,最佳不定芽诱导培养基为1号培养基,即MS+1.0 mg/L 6-BA+0.1 mg/L NAA。
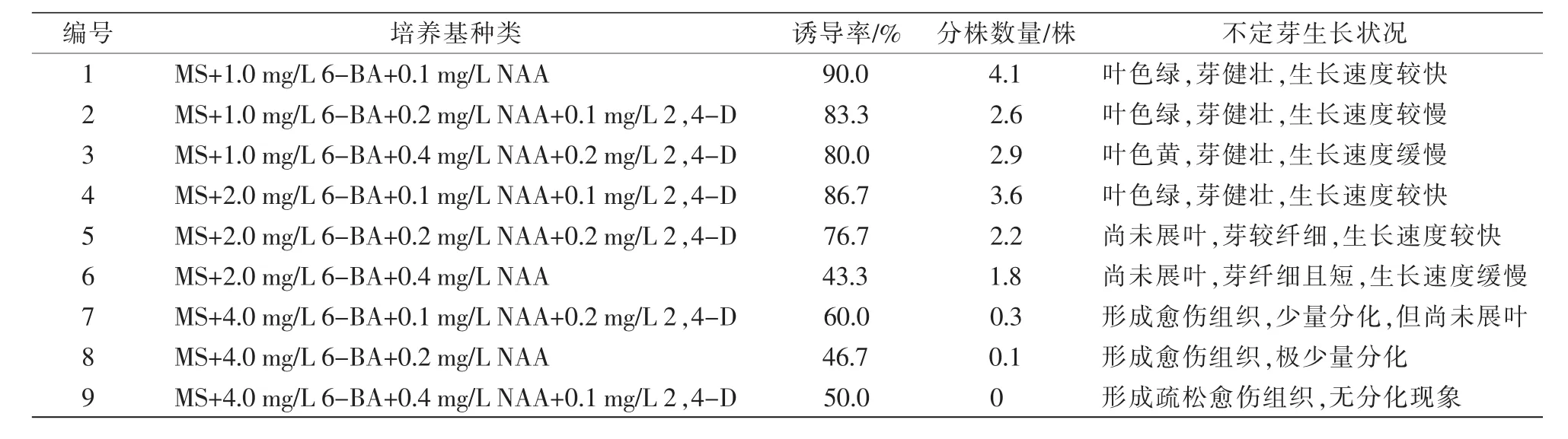
表4 不同植物生长调节剂配比对茎段的诱导情况
2.2 不同植物生长调节剂配比对不定芽增殖的影响
将启动培养获得的健康幼苗转接至表2培养基中,结果表明,1号增殖培养基的幼苗长势缓慢,未形成丛生芽,2号、3号、4号增殖培养基均可产生丛生芽,分别为4.5、4.2、4.8株,但从丛生芽生长状态来看,2号增殖培养基培养丛生芽茎部相对较粗,植株长势良好,生命力旺盛,叶色浓绿,且生长较快,13 d左右即可长出新芽。4号增殖培养基诱导丛生芽较纤细,培养后期逐渐变黄,不利于后期生根。由此可见,在本试验范围内,0.5 mg/L 6-BA与0.05 mg/L NAA的组合对青牛胆丛生芽生长、增殖效果最佳,诱导出的丛生芽生长最快。因此,最佳增殖培养基为MS+0.5 mg/L 6-BA+0.05 mg/L NAA。
2.3 不同植物生长调节剂配比对青牛胆生根的影响
由表5可知,5种培养基均成功诱导出不定根,其中3号、4号、5号培养基生根诱导率相当,均在95%以上,以5号培养基生根率最高,达97.5%,且根系萌动时间最早,第5天开始露白,植株叶色浓绿,健壮。2号培养基根系12 d后开始萌动,根系生长缓慢。1号空白培养基诱导率最低,仅为49.5%,且根系萌动时间最长,培养15 d后根系开始有萌动迹象。由此表明,NAA和IBA不同配比均能诱导根的生长,最佳生根培养基为MS+0.5 mg/L IBA。
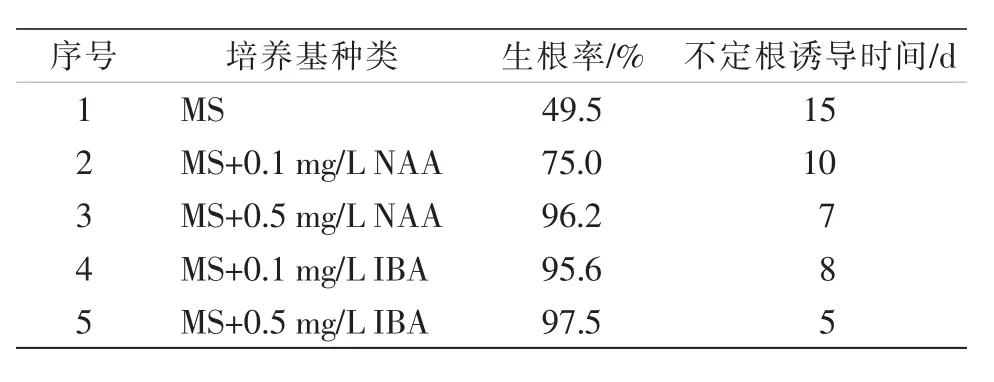
表5 不同浓度生根剂对不定根诱导情况的影响
2.4 炼苗移栽情况
生根培养30 d后,当80%组培苗根长至7~8 cm时,拧松瓶盖,2 d后将瓶盖全部打开,3 d后放置于全天自然光照、温度25℃的通风条件下炼苗。7 d后将苗取出,洗净附着在根上的培养基,并移栽到营养土∶珍珠岩=3∶1(体积比)的苗床上。移栽后的前5 d用透明塑料棚保温保湿,保持空气湿度在85%以上,每天喷灌1次,5 d后慢慢通风,接受自然光照,移栽15 d后成活率高达100%。
3 结论与讨论
植物细胞在理论上都存在全能性,任何植物的器官或组织都能作为组织培养的外植体[13]。本试验采用青牛胆幼嫩茎节诱导繁殖,能快速繁殖并获得大量植株,是一种非常有效的繁殖途径。本试验在潘丽梅等[10]的基础上降低了2,4-D浓度,并将KT换成NAA,诱导得到的不定芽并无玻璃化问题,且长势好,速度快。茎段可以为再生苗提供营养,促进壮苗,每丛不定芽能够再分化出丛生苗,大大降低了青牛胆育苗成本,更符合离体微繁的目的。在生根培养时,IBA和NAA可诱导生根,相对而言,IBA诱导效果优于NAA,这一结论与李小泉等[12]的研究结果相似。综上,本试验青牛胆最佳启动诱导培养基为MS+1.0 mg/L 6-BA+0.1 mg/L NAA,最佳增殖培养基为MS+0.5 mg/L 6-BA+0.05 mg/L NAA,最佳生根培养基为MS+0.5 mg/L IBA,炼苗移栽后成活率高达100%,该试验体系为青牛胆规模化生产实践提供了一定的技术参考。

