外源性IL-4通过抑制NF-κB信号通路减轻急性脓毒症肺损伤的研究
陈梦飞,王 颖,白 雪,杨丽婷,张 玲
随着肺部感染等疾病不断增加,脓毒症在急诊救助过程中发生率逐年升高[1]。由于机体全身严重感染、创伤等多种原因所导致全身的炎性反应,其炎症状态与预后存在明显的关联性,转录调节因子NF-κB在调节多种免疫调节介质的表达中发挥关键作用,参与脓毒症诱导的急性肺损伤的发生发展[2],因此,开发专门针对NF-κB通路的新疗法对改善严重脓毒症患者的高死亡率至关重要。白细胞介素-4(IL-4)是抑制炎症的细胞因子,脓毒症中IL-4的分泌可能会限制并最终终止炎症反应,可调节过量的促炎细胞因子和趋化因子的免疫宿主反应,是抑制炎症发展的重要炎症介质[3]。本研究通过构建脓毒症肺损伤模型,探讨外源性IL-4对新生小鼠脓毒症肺损伤的潜在保护作用,并试图阐明其可能的机制。
1 资料与方法
1.1 一般资料:雄性C57BL/6小鼠30只,8~10周龄,体重18~22 g,来自国家实验动物中心(北京,中国),以正常食物和自来水喂养,并在24 ℃、12 h光照和12 h暗循环条件下培养。本实验经宁夏回族自治区人民医院实验伦理委员会批准。
1.2 方法
1.2.1 体外模型构建: MH-S细胞培养于含10%胎牛血清的RPMI1640培养基中,置于37 ℃、5% CO2恒温培养箱中培养。待细胞生长至对数生长期后,进行后续实验。
1.2.1.1 CCK-8法测定细胞活力: 将细胞接种于96孔板中,每孔约1×104个细胞,24 h后加入终浓度为10、20 ng/mL的外源性IL-4,培养24 h后每孔加入CCK-8溶液10 μl继续培养2 h,于450 nm处测定各孔吸光度值。
1.2.1.2 Western blot法检测蛋白表达水平: 将细胞接种于6孔板中,每孔约1×105个细胞,接种24 h后,将细胞分为4组,即空白对照组、模型组(只加LPS溶液)、实验组1(LPS+10 ng/mL的IL-4)、实验组2(LPS+20 ng/mL的IL-4)。除空白对照组外,每组加入终浓度为1.0 μg/mL的LPS溶液,培养2 h后实验组加入外源性IL-4,继续培养24 h;细胞用预冷的PBS洗涤2次,然后每组加入细胞裂解液80~150 μl,裂解后离心取上清液,BCA法测定蛋白浓度,调整蛋白浓度后进行SDS-PAGE电泳、转膜。使用10%脱脂牛奶室温封闭2 h,PBST清洗(5次,5 min/次),一抗4 ℃孵育过夜;PBST清洗,加入二抗孵育1 h,PBS清洗后进行曝光。采用Image J软件分析电泳条带灰度值。
1.2.1.3 酶联免疫吸附试验(ELISA):将细胞接种于6孔板中,每孔约1×105个细胞。接种24 h后将细胞分为3组,即空白对照组(A组)、模型组(B组,只加LPS溶液)、实验组(C组,LPS+20 ng/mL的IL-4)。除空白对照组外,每组加入终浓度为1.0 μg/mL的LPS溶液,待培养2 h后,实验组加入外源性IL-4,继续培养24 h后取上清液。按照Elish相关试剂盒说明书进行实验操作,分别计算TNF-α、IL- 6、IL-1β的含量。
1.2.1.4 活性氧水平检测:按照1.2.2中方法进行细胞的接种及给药。给药24 h后加入DCFH-DA探针,继续培养40 min后使用倒置荧光显微镜检测荧光信号。
1.2.2 体内模型构建:采用LPS构建脓毒症肺损伤模型。小鼠采用浓度为0.5%的戊巴比妥钠溶液220 μl进行腹腔麻醉,麻醉充分后取仰卧位,固定小鼠头部与四肢。剪净颈部毛发,使用75%酒精消毒皮肤2次后,在颈部正中切开3~4 mm,钝性分离颈部腺体、肌肉等组织,暴露气管。A、B组小鼠使用1 mL注射器以45°角经气管软骨环注射50 μl的LPS溶液(根据小鼠体重,浓度为15 mg/kg)入气管,C组小鼠注射同等剂量磷酸盐缓冲液(PBS溶液)。注射后使小鼠头部向上与桌面成90°,旋转小鼠,使LPS溶液均匀分布于两肺;再次给颈部消毒,缝合关闭切口,然后放回清洁实验室继续正常饲养。30 min后B组给予50 μl的IL-4(10 ng/μl)溶液气管滴注,A、C组接受等剂量的PBS溶液气管滴注。12 h后3组小鼠经异氟醚诱导后处死收集血清和组织样本,置于-80 ℃保存,以备后续分析。
1.2.2.1 肺组织干湿比:在预冷的 PBS 溶液中反复漂洗干净并用吸水纸将肺组织表面的液体充分吸干,用电子天平进行肺组织称重,此为湿重(W);随后将肺组织置于烘干箱内充分烘干,再次称重,即为干重(D)。
1.2.2.2 苏木精-伊红染色及病理评分:小鼠处死后,解剖取出各组小鼠肺组织标本,用PBS冲洗。以组织样本醇2×1.5 h、100%酒精2×1 h、二甲苯乙醇混合液25 min、二甲苯25 min处理,随后将样品上蜡,用石蜡-Ⅰ和石蜡-Ⅱ包埋2 h后,将样本切片,苏木精-伊红染色,按照常规方法进行光镜观察,采用Smith法[4]进行病理评分。
1.2.2.3 酶联免疫吸附试验(ELISA):取小鼠血样1.5~2 mL,1 500 g离心15 min后,血清标本-80 ℃保存。使用ELISA法测定TNF-α、MCP-1、IL-4、IL-10的表达水平。
1.2.2.4 外周血巨噬细胞的流式细胞术和体外分析:从腹部动脉采集血液样本,血液样本在30 min内用1%肝素预处理抗凝,进行外周血单个核细胞分离,收集细胞,用3% BSA在PBS中封闭30 min,加入FITC-抗-F4/80抗体和PE-抗-iNOS+抗体/PE-抗-CD206抗体,避光培养。使用ExpressPlus程序对细胞进行流式细胞术检测。同时,为了排除非特异性结合,使用荧光抗体将细胞与FITC同型和PE同型混合。M1巨噬细胞标记为F4/80+和iNOS+,而M2巨噬细胞标记为F4/80+和CD206+。
1.2.2.5 实时荧光定量PCR (qRT-PCR)分析:使用TRIzol试剂(Invitrogen,Carlsbad,California,USA)从细胞中提取总RNA,然后采用PrimeScript RT Reagent试剂盒(Takara,Japan)进行反转录检测。采用不同的试剂盒(SYBR Premix Ex Taq II,Takara,Japan)在7900HT实时PCR系统中对mRNA进行qRT-PCR检测。甘油醛-3-磷酸脱氢酶(GAPDH)作为内参。2-ΔΔCt计算iNOS、IL-1β、IL-6、TNF-α、IL-10和TGF-β的相对表达量。

2 结果
2.1 外源性IL-4对MH-S细胞活力的影响:外源性IL-4作用24 h后,对细胞的生长活力没有影响,见图1(目录后)。
2.2 外源性IL-4对LPS刺激MH-S细胞炎症因子的影响:1.0 μg/mL的LPS诱导MH-S细胞24 h后,细胞上清液中炎症因子TNF-α、IL-6、IL-1β的含量明显升高(P<0.05);给予20 ng/mL的外源性IL-4后,炎症因子TNF-α、IL-6、IL-1β的水平有不同程度的下降(P<0.05),见图2(目录后)。
2.3 外源性IL-4对LPS刺激MH-S细胞中NF-κB p65的影响:1.0 μg/mL的LPS作用MH-S细胞24 h后,细胞NF-κB p65 蛋白表达量升高;给予不同浓度的外源性IL-4刺激后,MH-S 细胞 NF-κB p65蛋白表达量下调,见图3(目录后)。
2.4 外源性IL-4对LPS刺激MH-S细胞ROS水平的影响:空白对照组基本无荧光,见图4A(目录后);1.0 μg/mL的LPS作用MH-S细胞24 h后,ROS表达量明显升高,见图4B(目录后)。给予不同浓度的外源性IL-4刺激后,MH-S 细胞ROS表达量显著下调,见图4C、图4D(目录后)。
2.5 外源性IL-4降低肺组织损伤病理评分及W/D:造模后12 h,A组小鼠可见弥漫性肺组织病理损伤与改变,其病理评分显著高于B组和C组,且差异有统计学意义(P<0.05);B组小鼠病理评分高于C组,差异有统计学意义(P<0.05)。A组小鼠W/D比值最高,反映肺组织炎性渗出与水肿严重;B组W/D比值显著低于A组,但高于C组(P<0.05),见表1。
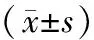
表1 3组小鼠肺组织损伤病理评分及W/D比较
2.6 外源性IL-4调节M1/M2样巨噬细胞表达以及炎症因子的表达:采用流式细胞术检测M1和M2巨噬细胞的极化,结果表明与对照组相比,LPS显著诱导F4/80+CD206+M2样巨噬细胞和F4/80+iNOS+M1样巨噬细胞的百分比增加(P<0.05);与A组相比,IL-4治疗抑制了F4/80+iNOS+的增加,而上调了F4/80+CD206+的表达。采用qRT-PCR和Western blot检测iNOS、IL-1β、IL-6、TNF-α、IL-10、TGF-β的含量,结果显示,与对照组相比,LPS诱导后M1表型中iNOS、IL-1β、IL-6和TNF-α mRNA的相对表达量均上调,而增加IL-4会抑制这些炎症因子表达(P<0.05)。虽然LPS组M2表型的IL-10和TGF-β mRNA表达水平也较对照组升高(P<0.05),随着IL-4的加入,IL-4促进了这些基因mRNA的表达。为阐明LPS小鼠的炎症反应,采用ELISA法检测炎症因子TNF-α、MCP-1、IL-10的相对表达,结果表明,相较于C组,A组和B组TNF-α、MCP-1、IL-10的蛋白表达水平均升高;与LPS组比较,IL-4治疗后TNF-α和MCP-1水平显著下调,IL-10水平显著上调(P<0.05),见表2。
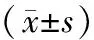
表2 3组小鼠巨噬细胞表达及炎症因子变化
2.7 IL-4通过抑制NF-κB/p65信号通路发挥作用:为明确IL-4在脓毒症肺损伤小鼠体内的作用机制,采用免疫组化(IHE)和Western blot方法检测NF-κB/p65信号通路相关基因的相对蛋白表达水平。IHE检测显示,LPS诱导后p65阳性细胞百分比明显增加,IL-4抑制LPS诱导后p65阳性细胞百分比增加,IL-4处理组小鼠p65细胞百分比显著低于LPS组(P<0.05)。此外,与对照组相比,LPS小鼠p65蛋白表达上调,这也受到IL-4浓度增加的抑制;LPS对p65磷酸化的促进作用被IL-4显著抑制(P<0.05),见表3。
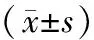
表3 3组小鼠IL-4对NF-κB/p65信号通路作用的比较
3 讨论
本研究通过建立LPS诱导的脓毒症肺损伤体内及体外模型,评估外源性IL-4对脓毒症的治疗作用,以期为脓毒症提供一种新的治疗方法。结果表明,外源性IL-4减少LPS诱导的MH-S细胞促炎因子 TNF-α、IL- 6、IL-1β的释放,降低了ROS的表达及P65的蛋白表达。此外,外源性IL-4增加F4/80+CD206+M2样巨噬细胞,抑制了F4/80+iNOS+M1样巨噬细胞的分布,抑制脓毒症肺损伤小鼠iNOS、TNF-α、MCP-1的表达,上调IL-10和TGF-β的表达,抑制LPS引起的p65磷酸化,从而对LPS诱导的脓毒症肺损伤产生治疗作用。
IL-4主要由Th2细胞产生,其主要作用是促进Th0细胞向Th2细胞的转化,减少Th1细胞的形成。IL-4 是一种具有多种生物学功能的细胞因子,在调节T淋巴细胞、B淋巴细胞、单核-巨噬细胞等多种细胞的增殖、分化、凋亡中发挥重要作用;在炎症反应中IL-4是一种重要的抗炎细胞因子,同时它还能广泛抑制其他促炎因子及炎症介质的表达。IL-4 能够下调单核巨噬细胞产生的TNF-α、IL-1β、IL-6和IL-8等炎症因子以及超氧化合物,还可以诱导IL-1受体拮抗剂基因的表达,从而间接抑制IL-1的作用[5-6]。有研究发现,IL-4还能促进抗炎因子IL-10的分泌[7]。另外,IL-4可以通过激活JAK/STAT6信号通路诱导巨噬细胞向M2型极化[8]。研究表明,IL-4能明显抑制脂多糖(LPS)诱导巨噬细胞的IL-1、IL-6和TNF-α的产生[9]。此外,IL-4可通过抑制IKK激酶的活性,进一步抑制 NF-κB信号通路活化,从而影响上游和下游炎症因子水平[10]。
巨噬细胞与炎症和宿主对各种病原体的防御密切相关。激活的巨噬细胞分为经典激活型或M1型,交替激活型或M2型。典型的M1巨噬细胞受到“促炎”细胞因子谱的刺激,而替代的M2巨噬细胞似乎参与免疫抑制和组织修复,其促炎细胞因子分泌水平降低或为零[11]。巨噬细胞的各种功能与受体相互作用的形式和细胞因子的出现有关,巨噬细胞极化是脓毒症发病机制中的重要过程,本研究发现与LPS组相比,IL-4处理抑制了F4/80+iNOS+的增加,且促进了F4/80+CD206+的上调。IL-4可以调节M1表型和M2表型相关基因的含量,从而可诱导M1/M2巨噬细胞极化,减轻肺损伤和免疫缺陷。
活性氧 (ROS) 是氧化应激的重要的组成部分,参与机体的氧化平衡。ROS的功能包括对细菌和寄生虫的直接抗菌活性、免疫信号的氧化还原调节和炎症小体活化的诱导,超过细胞抗氧化防御系统能力的ROS水平会诱发氧化应激,过度的氧化应激会对蛋白质、DNA和脂质等细胞成分造成损害,并导致脓毒症的加重[12]。本研究发现与LPS组相比,IL-4处理抑制了ROS的生成,以减轻脓毒症相关损伤。
NF-κB是一种转录因子,与缺血和其他神经炎症性疾病后的炎症反应有关。NF-κB激活后上调或诱导的各种类型的靶基因,这些靶基因包含种类繁多的细胞因子和趋化因子,其中大部分以促炎方式起作用,它们通常导致NF-κB 激活,从而构成正反馈回路[13]。Ge等人发现,非脓毒症患者NF-κB蛋白的相对表达水平较脓毒症者低,且在脓毒症患者静脉血中IL-6、IL-18和TNF-α的表达水平与NF-κB百分比呈正相关性[14]。p65(RelA)是NF-κB家族的成员之一,它以同源或异源二聚体结合抑制κB(IκB)家族蛋白的形式分布于未受刺激的细胞中。有研究表明,通过抑制典型的NF-κB通路,可以阻止促炎细胞因子的产生,而NF-κB的转录活性受p65在多个丝氨酸残基的磷酸化控制[15]。本研究结果显示,LPS引起的p65磷酸化被外源性IL-4抑制,提示外源性IL-4可以抑制NF-κB/p65信号通路的激活,但外源性IL-4与其他信号通路的相关性还有待进一步探讨。
综上所述,采用LPS建立脓毒症肺损伤细胞及小鼠模型,结果显示外源性IL-4能够抑制促炎细胞因子的表达、减少ROS生成、降低肺组织病理评分和W/D值,对改善肺损伤有积极作用。此外,外源性IL-4可促进M2巨噬细胞极化,并抑制NF-κB/p65信号通路激活。

