淀粉样融合蔗糖异构酶活性包涵体的异源表达及酶学性质表征
高 向 红, 王 从 纲, 庞 焦, 李 宪 臻
(大连工业大学 生物工程学院, 辽宁 大连 116034)
0 引 言
异麦芽酮糖(α-D-吡喃葡糖基-1,6-D-果糖)是一种具有保健作用的新型功能糖,作为添加剂广泛应用于保健品、糖尿病人食品和运动饮料中,越发受到消费者的欢迎[1-3]。天然异麦芽酮糖主要存在于蜂蜜、甘蔗汁中,含量较低,且难以用化学方法合成。目前主要采用蔗糖异构酶转化蔗糖,再经过浓缩和结晶等步骤获得异麦芽酮糖[3-5]。
现有蔗糖异构酶生产菌普遍产酶水平低,因此研究人员主要将蔗糖异构酶固载于水不溶性载体上,如以硅藻土为介质进行吸附固载[6],利用海藻酸钠-羧甲基纤维素钠进行混合包埋,利用壳聚糖-戊二醛吸附交联、制备交联酶聚集体等手段将蔗糖异构酶制备成固定化酶[7],以从反应体系中分离回收和再利用,从而降低异麦芽酮糖的生产成本。然而,制备固定化酶需要利用色谱法分离纯化大量可溶酶,并且需要载体材料和固定化反应相关的化学试剂,这些过程增加了生产成本,阻碍了固定化蔗糖异构酶的规模化生产和应用。近年研究发现,将一些具有聚集特性的短肽或蛋白与可溶酶融合表达,可以诱导其在表达宿主细胞中形成具有催化活性的包涵体(CatIBs,简称活性包涵体)[8-11]。目前,β-半乳糖苷酶、内切葡聚糖酶、丙酮酸氧化酶、脂肪酶等被成功表达为活性包涵体[8]。相比传统的酶固定化方法,将酶蛋白制备成活性包涵体具有诸多优势,如表达和固定化同时进行、不需要额外的载体材料和固定化反应、表达量大、容易分离纯化、生产过程中不容易被降解等。因此,活性包涵体作为一种新型酶异源表达和固定化策略,具有良好的工业应用前景[8-9]。
源于酿酒酵母的氮代谢调控蛋白Ure2是目前常用于蛋白质聚集机制研究的安全模式蛋白,导致其发生聚集的关键片段是其N端1~90位氨基酸序列,富含Asn和Gln[12-14]。本实验将Ure2蛋白N端聚集序列作为标签,与蔗糖异构酶融合表达,制备淀粉样融合蔗糖异构酶活性包涵体,并进行酶学性质表征,以期为工业化应用固定化蔗糖异构酶提供一种高效低成本的新策略。
1 材料与方法
1.1 材料与仪器
蔗糖异构酶SIase(NCBI序列号:AAK82938)源于Klebsiellasp.LX3,携带其基因的质粒pET 28a-SIase为大连工业大学微生物资源与生物催化实验室保藏;大肠杆菌EscherichiacoliBL21(DE3),获赠于中科院大连化学物理研究所赵宗保研究员课题组;pET 28a-Ure2N-linker,生工生物工程(上海)股份有限公司;Protein Marker(High)、250 bp DNA Marker、限制性核酸内切酶BamH I和XhoI、T4 DNA连接酶;DNA胶回收试剂盒、IPTG、卡那霉素、胰蛋白胨、酵母粉,生工生物工程(上海)股份有限公司;3,5-二硝基水杨酸,国药集团化学试剂有限公司;蔗糖,科密欧化学试剂有限公司。
LB液体培养基:胰蛋白胨10.0 g/L,酵母粉5.0 g/L,氯化钠10.0 g/L;LB固体培养基:琼脂粉15.0 g/L,其余同LB液体培养基。
JY92-IIN超声破碎仪,宁波新芝生物技术有限公司;UV5200紫外分光光度计,上海元析仪器有限公司;MD spectramax paradigm酶标仪,美谷分子仪器(上海)有限公司;5804R型离心机,美国Eppendorf公司;高效液相色谱分析仪,美国安捷伦科技公司。
1.2 方 法
1.2.1 pET 28a-Ure2N-linker-SIase表达载体的构建
将pET 28a-Ure2N-linker和pET 28a-SIase分别用BamH I和XhoI进行双酶切,产物经1%琼脂糖凝胶电泳分离后,采用DNA胶回收试剂盒回收线性化载体质粒和目的基因片段,继续用T4 DNA连接酶进行连接,之后转化至E.coliDH5α感受态细胞,涂布于终质量浓度50 μg/mL卡那霉素的LB固体平板上。挑取单菌落进行菌落PCR验证,将阳性转化子进一步培养提取质粒经酶切验证后,送吉林库美生物科技有限公司测序。
1.2.2 Ure2N-linker-SIase和SIase的异源表达
将重组质粒pET 28a-Ure2N-linker-SIase和pET 28a-SIase分别转化E.coliBL21(DE3),挑取阳性克隆于5 mL LB液体培养基中,卡那霉素终质量浓度为50 μg/mL,37 ℃、200 r/min培养14 h得到种子液。将种子液按体积比1∶50转入含50 μg/mL卡那霉素的LB液体培养基中,37 ℃、200 r/min培养至OD600为0.6~0.8时,加入终浓度0.5 mmol/L的IPTG,继续在16 ℃、200 r/min下培养20 h进行诱导表达。8 000 r/min、4 ℃离心收集菌体细胞,用含终体积分数5%甘油、pH 8.0的50 mmol/L NaH2PO4-Na2HPO4缓冲液重悬后超声破碎,10 000 r/min、4 ℃离心分别得到上清和沉淀。
1.2.3 活性包涵体酶液的制备
转化菌体经超声破碎离心收集的沉淀依次用含有终体积分数5%甘油、0.5% Triton X-100重悬、pH 8.0的50 mmol/L NaH2PO4-Na2HPO4缓冲液和含有终体积分数5%甘油、pH 8.0的50 mmol/L NaH2PO4-Na2HPO4缓冲液重悬清洗2次和3次,4 ℃、10 000 r/min离心15 min,弃上清液收集包涵体沉淀。将清洗后的包涵体用pH 8.0的50 mmol/L NaH2PO4-Na2HPO4缓冲液重悬获得包涵体酶液。取少量包涵体酶液加入等体积10% SDS溶液处理5 min溶解包涵体,之后利用BCA法测定蛋白浓度。将上清液和清洗后的包涵体样品利用SDS-PAGE进行检测。
1.2.4 TLC法分析活性包涵体转化产物
TLC展开剂:正丁醇100 mL、乙醇60 mL、水40 mL混匀。显色剂:取二苯胺0.2 g溶于10 mL 丙酮,再加入苯胺200 μL和85%磷酸1 mL。将果糖、葡萄糖、蔗糖、异麦芽酮糖标准品,以及活性包涵体转化蔗糖反应产物和对照组分别取2 μL点样,85 ℃烘板后进行分析。
1.2.5 HPLC法检测活性包涵体转化产物
将转化后的样品煮沸15 min进行灭酶处理,在10 000 r/min离心10 min,取上清经0.22 μm滤膜过滤后进行HPLC检测。HPLC色谱条件:色谱分离柱,Hypersil APS-2,4.6 mm×250 mm;示差检测器,5 μm氨基柱;流动相,体积比 80∶20 的乙腈-水溶液;进样量,10 μL;体积流量,1.0 mL/min;柱温,35 ℃。
1.2.6 活性包涵体的酶活测定
反应体系:取100 μL 4 mg/mL的活性包涵体酶液与400 μL含4%蔗糖的磷酸氢二钠-柠檬酸溶液混匀,45 ℃、200 r/min反应2 h,使用DNS法测定还原糖并计算酶活力。酶活力单位定义:以蔗糖为底物,每分钟释放1 μmol还原糖所需的酶量为1个酶活力单位(U)。相对酶活定义:以同组测定的最高酶活力为100%,计算所得比值为相对酶活。
1.2.7 活性包涵体的酶学性质测定
1.2.7.1 最适反应温度
将活性包涵体酶液于pH 6.0的磷酸氢二钠-柠檬酸缓冲液中,分别在25、30、35、40、45、50、55、60 ℃条件下测定酶活力,确定最适反应温度。
1.2.7.2 最适反应pH
将活性包涵体分别溶解在pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0和4%蔗糖的磷酸氢二钠-柠檬酸溶液中,于45 ℃下测定酶活力,确定最适反应pH。
1.2.7.3 酶动力学常数
分别以10、20、50、100、200、250、500 mmol/L的蔗糖为底物,在45 ℃、pH 6.0条件下测定活性包涵体的酶活力。活性包涵体质量浓度4 mg/mL,反应时间为15 min。利用GraphPad Prism 5.0基于Michaelis-Menten方程进行非线性拟合,得到动力学常数Km和Vmax,计算得到kcat/Km。
2 结果与讨论
2.1 表达载体的构建和验证
将经过BamH I和XhoI双酶切的表达载体pET 28a-Ure2N-linker与目的基因SIase进行连接和转化至E.coliDH5α中,利用含有卡那霉素的平板进行筛选,挑取单菌落作为模板,利用针对pET 28a载体的T7通用引物进行菌落PCR鉴定,结果如图1所示,PCR产物在2 250~3 000 bp处存在单一条带,与预期条带2 339 bp位置相符,表明其为阳性克隆。
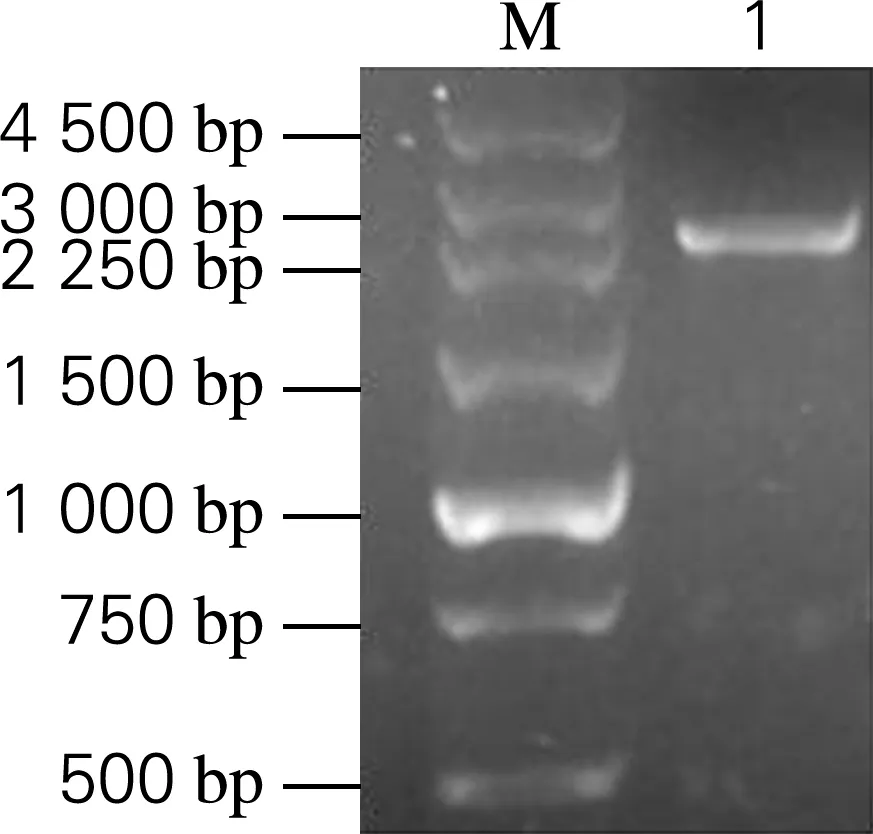
M,DNA Marker;1,重组质粒构建菌落PCR鉴定结果
将鉴定正确的菌落进行液体培养和提取质粒,用BamH I和XhoI进行双酶切验证,结果如图2所示,质粒经双酶切后在1 500~2 250 bp和大于4 500 bp处产生两条特异性条带,与预期结果1 797和5 593 bp相符。将验证正确的重组质粒进行测序验证,结果表明重组质粒pET 28a-Ure2N-linker-SIase构建成功。

M,DNA Marker;1,酶切条带
2.2 重组蛋白的异源表达
分别将重组质粒pET 28a-SIase和pET 28a-Ure2N-linker-SIase转化至E.coliBL21(DE3)中,再利用IPTG进行诱导表达,菌体细胞超声破碎后通过离心分离上清液和不溶性沉淀,利用SDS-PAGE进行检测,结果如图3和图4所示。SIase和Ure2N-linker-SIase在理论分子质量大小处存在目的条带,其中SIase主要以可溶性形式表达,而融合蛋白Ure2N-linker-SIase主要以包涵体形式存在于沉淀中,表明融合淀粉样蛋白Ure2N诱导SIase形成了包涵体。
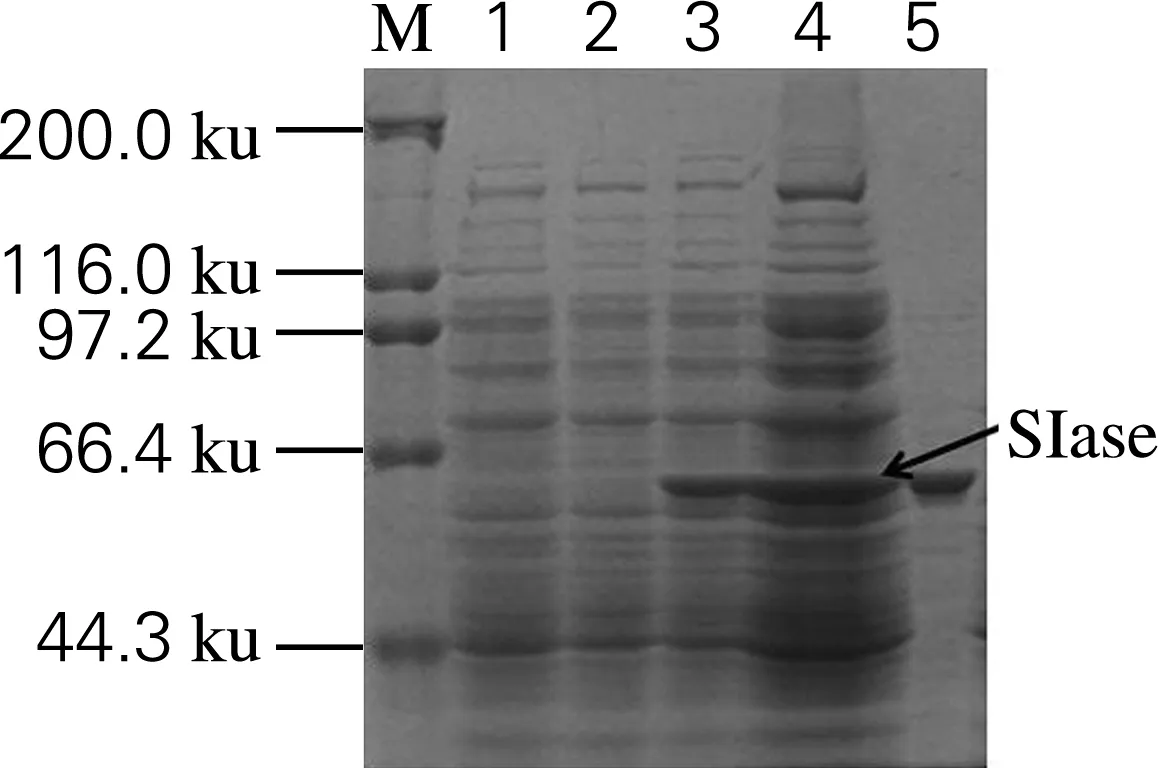
M,蛋白Marker;1,转化空载体诱导后样品(对照);2~5,转化pET 28a-SIase诱导前、诱导后、上清液、沉淀样品

M,蛋白Marker;1~4,转化pET 28a-Ure2N-linker-SIase诱导前、诱导后、上清液、沉淀样品
将Ure2N-linker-SIase包涵体经过缓冲液清洗后重悬于pH 8.0的50 mmol/L NaH2PO4-Na2HPO4缓冲液制备成包涵体酶液并与底物蔗糖溶液混合进行转化,反应产物采用TLC和HPLC进行检测。结果如图5和图6所示。从图5可以看出,包涵体酶液可以催化蔗糖转化为异麦芽酮糖。从图6可以看出,包涵体酶液转化底物蔗糖的反应产物以异麦芽酮糖为主,伴有海藻酮糖、果糖和葡萄糖,与已报道不同来源蔗糖异构酶转化蔗糖的反应产物组成类型相同[4],表明Ure2N-linker-SIase在大肠杆菌中以活性包涵体形式表达,证明了利用淀粉样蛋白Ure2N作为融合标签诱导蔗糖异构酶形成活性包涵体的可行性。
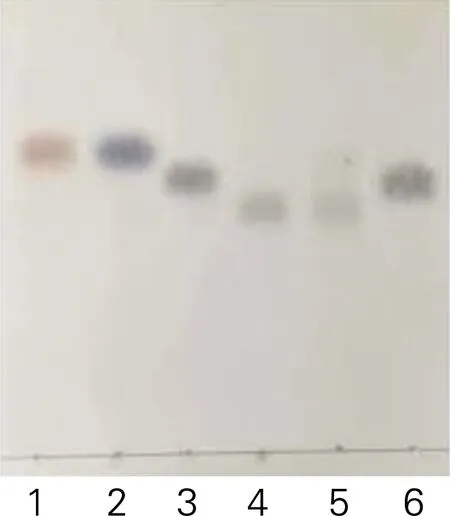
1~4,分别为果糖、葡萄糖、蔗糖、异麦芽酮糖标准品;5,Ure2N-linker-SIase活性包涵体转化产物;6,对照组产物
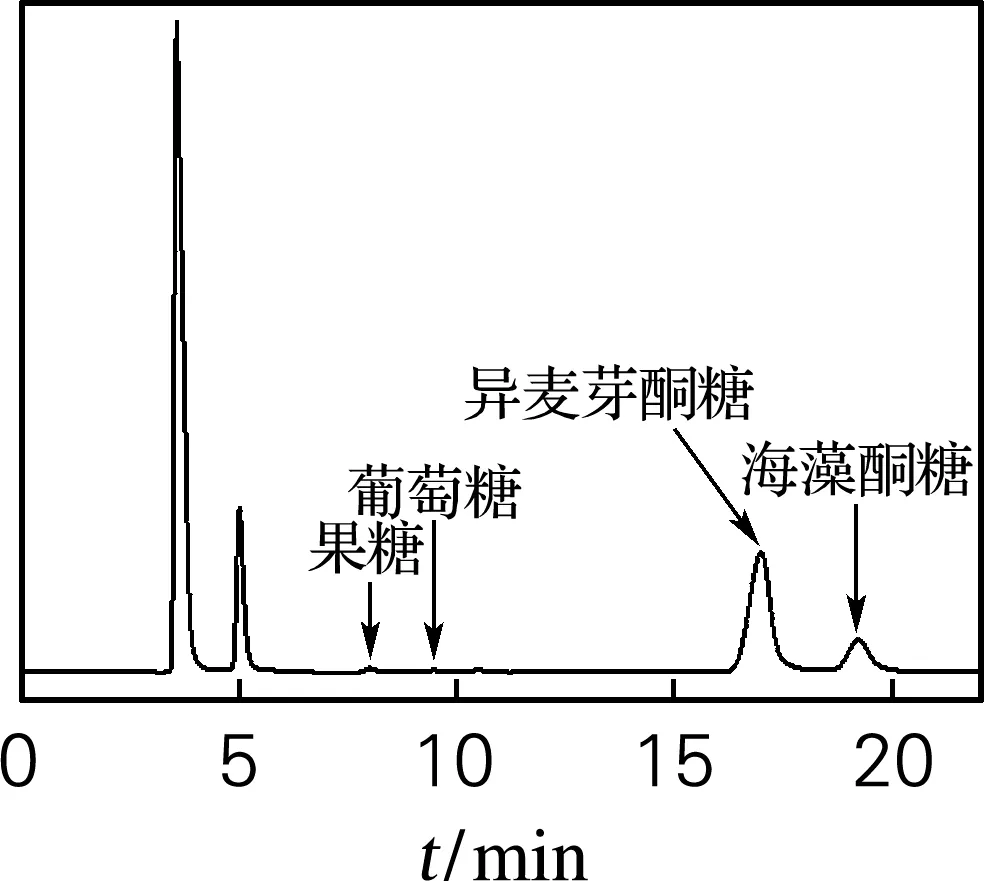
(a)灭活前
通过酶固定化能够将蔗糖异构酶从反应体系中回收,提高利用率。目前主要采用吸附法和交联法等传统方法制备蔗糖异构酶固定化酶[6-7],需要载体材料和固定化反应所需化学试剂。本研究成功制备出蔗糖异构酶活性包涵体,实现其表达和固定化同步进行,不需要额外的载体材料和固定化反应,不仅简化了分离步骤,而且降低了固定化酶的制备成本,具有潜在的应用价值。
2.3 活性包涵体的酶学性质表征
进一步对Ure2N-linker-SIase活性包涵体的温度和pH适应范围进行了检测,结果如图7和图8所示。从图7可以看出,活性包涵体在35~45 ℃范围内具有最高酶活力。当温度超过55 ℃时,酶活力开始迅速下降。从图8可以看出,活性包涵体在pH 5.0~6.5的相对酶活力超过82%,在pH 6.0时酶活力最高。而课题组前期工作显示[15],可溶表达的蔗糖异构酶最适温度为35 ℃,最适pH为6.0,因此蔗糖异构酶以活性包涵体形式表达并未显著改变其最适温度和最适pH。
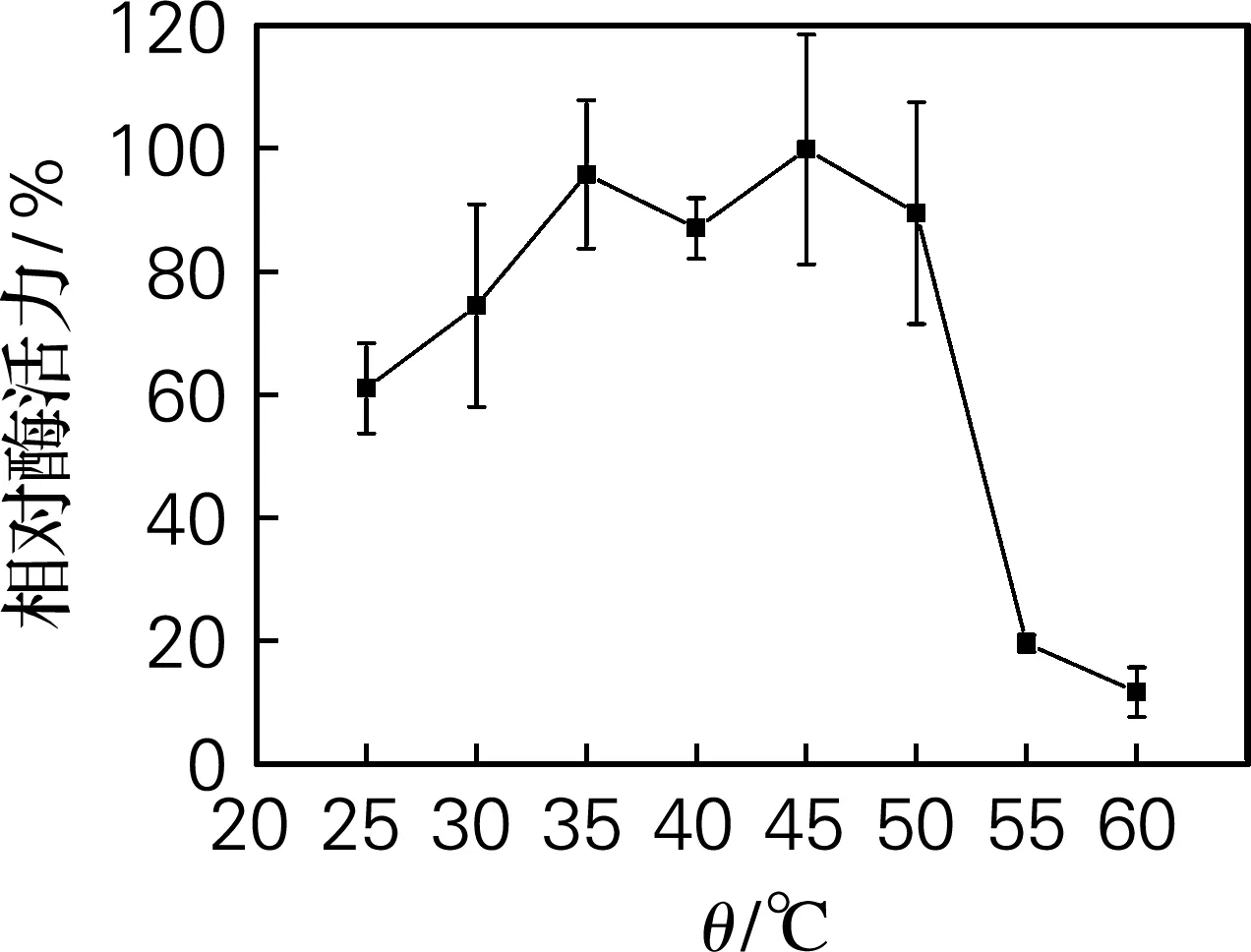
图7 温度对Ure2N-linker-SIase酶活力的影响
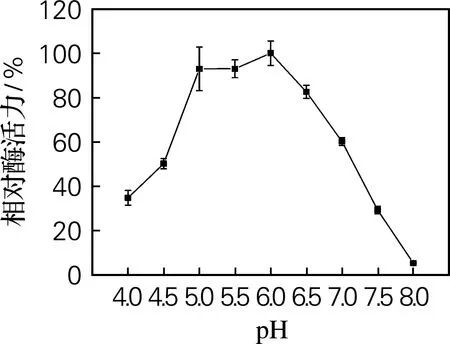
图8 pH对Ure2N-linker-SIase酶活力的影响
在最适条件下测定了活性包涵体的动力学常数,其对蔗糖底物的Km为(105.4±23.4)mmol/L,kcat/Km为(3.1±0.4)L/(mmol·min),而课题组前期工作检测到可溶表达的蔗糖异构酶对蔗糖底物的Km为(54.6±1.7)mmol/L,kcat/Km为(0.27±0.02)L/(mmol·min),表明蔗糖异构酶以活性包涵体表达降低其对底物蔗糖的亲和力,但催化效率明显提高[15]。
2.4 活性包涵体的转化产物组成分析
采用HPLC检测了不同温度下活性包涵体转化蔗糖的反应产物中不同糖组分的含量,计算产物中各组分质量分数,结果如表1所示。在30~40 ℃,随着温度升高,异麦芽酮糖质量分数提高,海藻酮糖质量分数降低,同时单糖(果糖和葡萄糖)的质量分数提高。结果表明,蔗糖异构酶活性包涵体与文献[15-16]报道的来源于Klebsiellasp.LX3、KlebsiellapneumoniaeNK33-98-8等蔗糖异构酶转化反应的特征类似,即在30~40 ℃,提高反应温度有利于异麦芽酮糖生成,减少海藻酮糖的生成,同时增加单糖的形成。尽管提高温度有利于异麦芽酮糖的生成,但反应产物中同时增加的单糖需采用糖分离技术除去,会导致生产成本的提高,而对蔗糖异构酶进行分子改造以获得不形成非异麦芽酮糖产物的新型蔗糖异构酶是当前研究工作的重点,研究已发现蔗糖异构酶中存在通过协同作用影响其产物特异性的多个调控区域[4]。由于目前对活性包涵体的结构和形成机制研究刚刚起步,未来的研究工作需要开发先进技术手段解析活性包涵体形成和催化反应的分子基础,进一步指导分子设计和改性以制备高纯异麦芽酮糖。
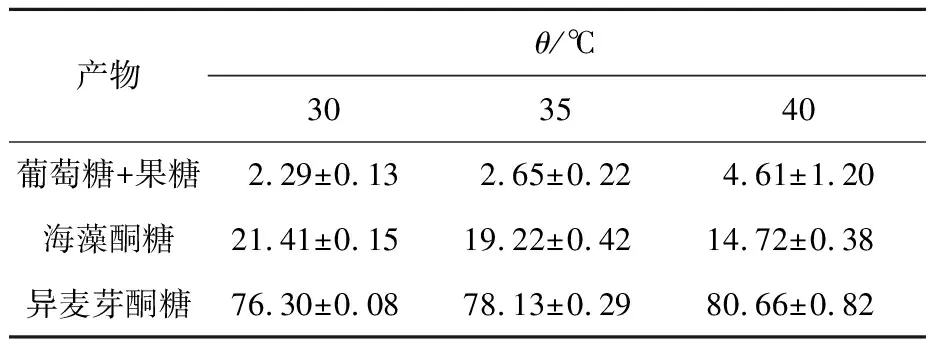
表1 活性包涵体催化反应的产物组成分析
3 结 论
以Ure2N为融合标签,构建表达载体pET 28a-Ure2N-linker-SIase,在大肠杆菌BL21(DE3)中成功表达了蔗糖异构酶的活性包涵体形式,并采用TLC和HPLC对其酶学性质和产物组成进行了检测分析,Ure2N-linker-SIase活性包涵体在35~45 ℃、pH 5.0~6.5具有较高的相对酶活力,最适反应温度pH分别为35 ℃和pH 6.0,动力学常数Km为(105.4±23.4)mmol/L,kcat/Km为(3.1±0.4)L/(mmol·min)。
本研究是在分子水平对蔗糖异构酶进行改造以提高其分离性能和利用率的新尝试,同时活性包涵体作为一种新型固定化酶,不需要传统酶固定化所需的载体材料和固定化反应所需化学试剂,具有潜在的工业应用价值。由于不同融合标签和N/C端融合位置影响活性包涵体的表达量和酶活力[11],因此本研究为制备高表达水平、高活性蔗糖异构酶活性包涵体的进一步分子设计和优化奠定了基础。

