术前控制营养状况评分对老年髋部骨折患者术后1年死亡的预测价值研究
孟衍蓉,刘利民
据预计,2050年世界髋部骨折患者将超过626万,其中约50%发生在亚洲[1]。由于人口老龄化,中国的髋部骨折绝对数量和相关住院医疗费用在迅速增加。有资料显示,2012—2016年55岁及以上年龄段髋部骨折的绝对总数增加了约4倍[2]。亦有研究表明高龄髋部骨折患者的基础疾病多,预后差,其术后1年病死率可高达15% ~25%,此类患者的致残率也高,导致生活质量降低或丧失独立生活能力[3]。老年患者热量及蛋白质摄入不足,入院后多患有低蛋白血症、贫血等,手术后更容易发生营养不良,影响身体各个器官的功能及长期预后结局[4]。因此,寻找一种合适的营养指标预测模型来准确识别具有高危因素的髋部骨折患者,术前、术后给予相应地积极处理,对改善髋部骨折术后结局具有重要意义。
术前控制营养状况(CONUT)评分是国外家庭医生常用的营养评估工具,常用于急、慢性疾病或消耗性疾病预后结局的预测,其预测效能良好,数值客观、使用方便。如果对老年髋部骨折患者术后1年死亡有较好的预测效能,则能够对临床有实际指导意义。本研究旨在探讨影响老年髋部骨折患者术后1年死亡的因素,并探讨术前CONUT评分预测老年髋部骨折患者术后1年死亡的价值,为临床使用、推广提供依据。
1 对象与方法
1.1 研究对象 选取2013年1月至2016年3月于首都医科大学宣武医院住院治疗的一侧髋部(包括股骨颈及股骨粗隆间)骨折患者399例为研究对象。纳入标准:(1)年龄≥60岁者;(2)行内固定或人工股骨头置换术者;(3)骨折前有一定的活动能力,认知功能正常者;(4)致伤原因为生活伤者。排除标准:(1)车祸、高空坠落等高能量伤或多发伤者;(2)病理性骨折者;(3)既往有骨折手术史者;(4)失访者。
本研究已通过中国人民解放军总医院第七医学中心伦理委员会审查(编号:2015-081)。患者均已签署知情同意书。
1.2 观察指标 记录患者一般资料,包括性别、年龄、骨折部位、合并内科疾病(包括原发性高血压病、2型糖尿病、陈旧性脑梗死)。抽取患者空腹状态下血液2 ml,采用H7600-1仪器,利用双缩脲/免疫比浊等方法,检测血红蛋白、白蛋白、肌酐、前白蛋白、D-二聚体、中性粒细胞计数、淋巴细胞计数、总胆固醇,所有数据质检合格。并计算术前CONUT评分、老年营养风险指数(GNRI)、中性粒细胞/淋巴细胞比值(NLR)。
CONUT评 分 首 先 由 IGNACIO DE ULÍBARRI等[5]提出,通过计算3个实验室参数(血清白蛋白、淋巴细胞计数和总胆固醇)进行营养状态初筛。血清白蛋白水平≥3.50、3.00 ~3.49、2.50 ~2.99、<2.50 g/dl分别计0、2、4、6分;淋巴细胞计数≥1 600、1 200 ~1 599、800 ~1 199、<800/mm3分别计0、1、2、3分;总胆固醇≥180、140 ~179、100 ~139、<100 mg/dl分别计0、1、2、3分,3项评分相加即为总分,总分越高说明营养状况越差。
GNRI也是预测住院患者并发症发生率和死亡率常用的营养状况评估指标。GNRI=14.89×血清白蛋白(g/dl)+41.7×当前体质量/理想体质量。理想体质量=身高(m)2×22。
1.3 手术方式 术前常规行下肢静脉超声、心脏彩超、心电图及胸片检查等。内固定治疗患者由首都医科大学宣武医院骨科同一创伤组医生主刀,人工股骨头置换术治疗患者由首都医科大学宣武医院骨科同一关节组医生主刀,避免不同手术医生技术水平带来的偏倚。
1.4 随访 术后通过电话及门诊复诊方式随访患者,规定1年中有4个固定的随访时间:于术后第3、6、9、12个月的第1周内完成随访。对于规律复诊的患者进行门诊随访,行动不便的患者进行电话随访,随访终点为术后1年。根据患者术后1年是否死亡,将其分为死亡组和存活组。
1.5 统计学方法 应用EpiData软件进行数据录入和管理。采用SPSS 25.0统计学软件收集和分析数据,计量资料使用Shpiro Wilk法进行正态性检验,符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-Whitney U检验;计数资料的分析采用χ2检验。先将患者一般资料进行单因素分析,再将P<0.1的因素纳入多因素Logistic回归分析模型,分析老年髋部骨折患者术后1年死亡的影响因素。绘制受试者工作特征(ROC)曲线,并计算ROC曲线下面积(AUC),AUC值越大代表模型构建程度越好。以P<0.05为差异有统计学意义。
2 结果
2.1 死亡组和存活组一般资料比较 399例患者中,男135例,女264例;年龄60 ~99岁,平均年龄(77.9±6.5)岁;受伤至手术时间为2 ~34 d,平均(14.2±2.6)d;左侧205例,右侧194例;股骨颈骨折169例,转子间骨折230例;死亡组47例,存活组352例。
死亡组和存活组性别、骨折部位、原发性高血压病所占比例、2型糖尿病所占比例、陈旧性脑梗死所占比例、D-二聚体比较,差异均无统计学意义(P>0.05);死亡组年龄、术前CONUT评分、NLR高于存活组,血红蛋白、白蛋白、肌酐、前白蛋白、GNRI低于存活组,差异均有统计学意义(P<0.05),见表1。
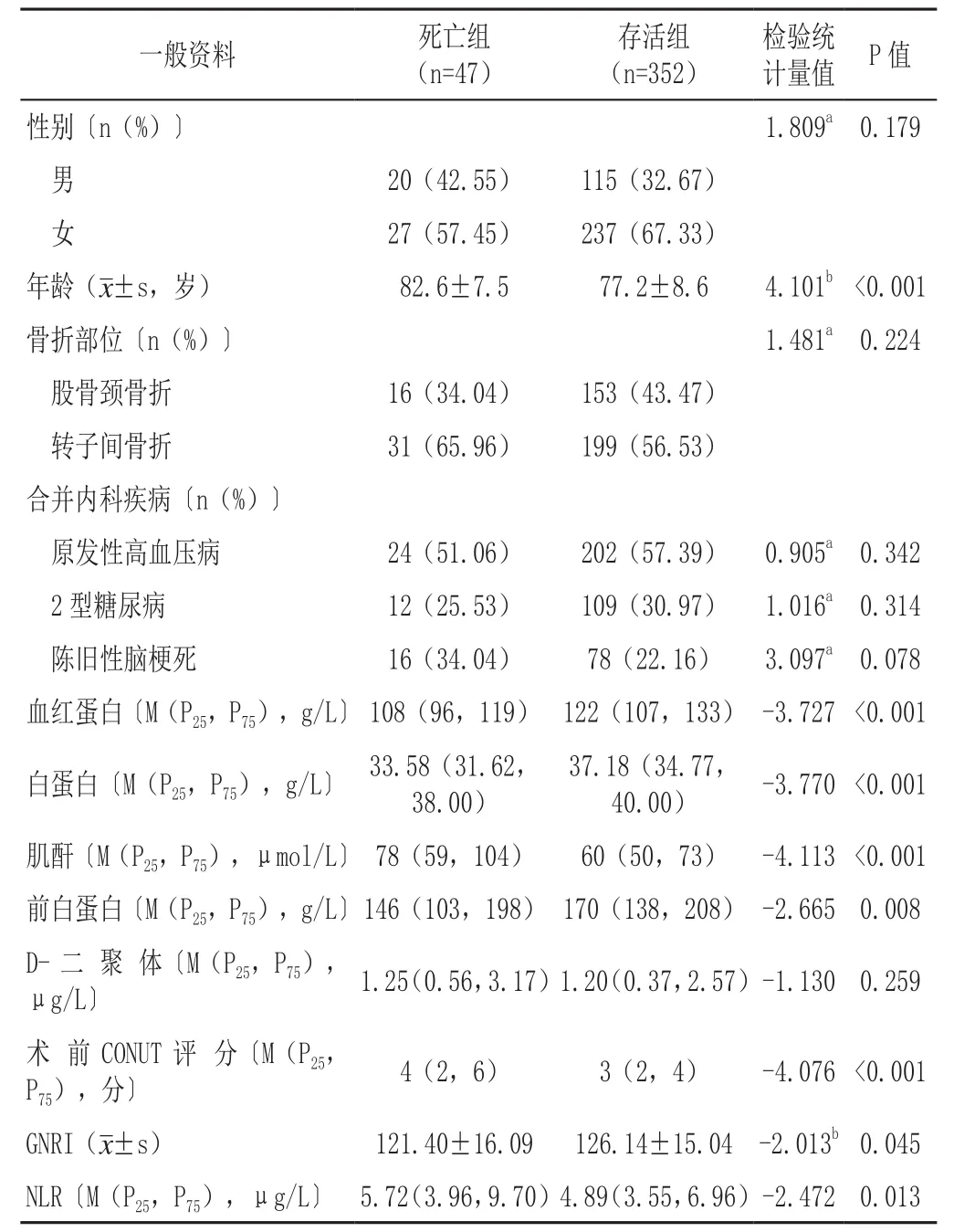
表1 死亡组与存活组一般资料比较Table 1 Comparison of general data between the deceased and survived elderly patients with hip fracture
2.2 多因素Logistic回归分析 以术后1年是否死亡为因变量(赋值:否=0,是=1),以年龄、陈旧性脑梗死史(赋值:否=0,是=1)、血红蛋白、白蛋白、肌酐、前白蛋白、术前CONUT评分、GNRI、NLR为自变量(其余变量赋值为实测值)进行多因素Logistic回归分析,结果显示,年龄、陈旧性脑梗死、肌酐、术前CONUT评分、NLR是老年髋部骨折患者术后1年死亡的影响因素(P<0.05),见表2。

表2 老年髋部骨折患者术后1年死亡的多因素Logistic回归分析Table 2 Multivariate Logistic regression analysis of the influencing factors of 1-year postoperative mortality in elderly patients with hip fracture
2.3 术前CONUT评分、NLR预测老年髋部骨折患者术后1年死亡的ROC曲线 绘制术前CONUT评分、NLR预测老年髋部骨折患者术后1年死亡的ROC曲线,结果显示,术前CONUT评分预测老年髋部骨折患者术后1年死亡的AUC为0.681〔95%CI(0.590,0.771)〕,临界值为4.5分,灵敏度为48.9%,特异度为83.5%;NLR预测老年髋部骨折患者术后1年死亡的AUC为0.611〔95%CI(0.523,0.699)〕,临界值为7.055 μg/L,灵敏度为47.8%,特异度为75.9%,见图1。
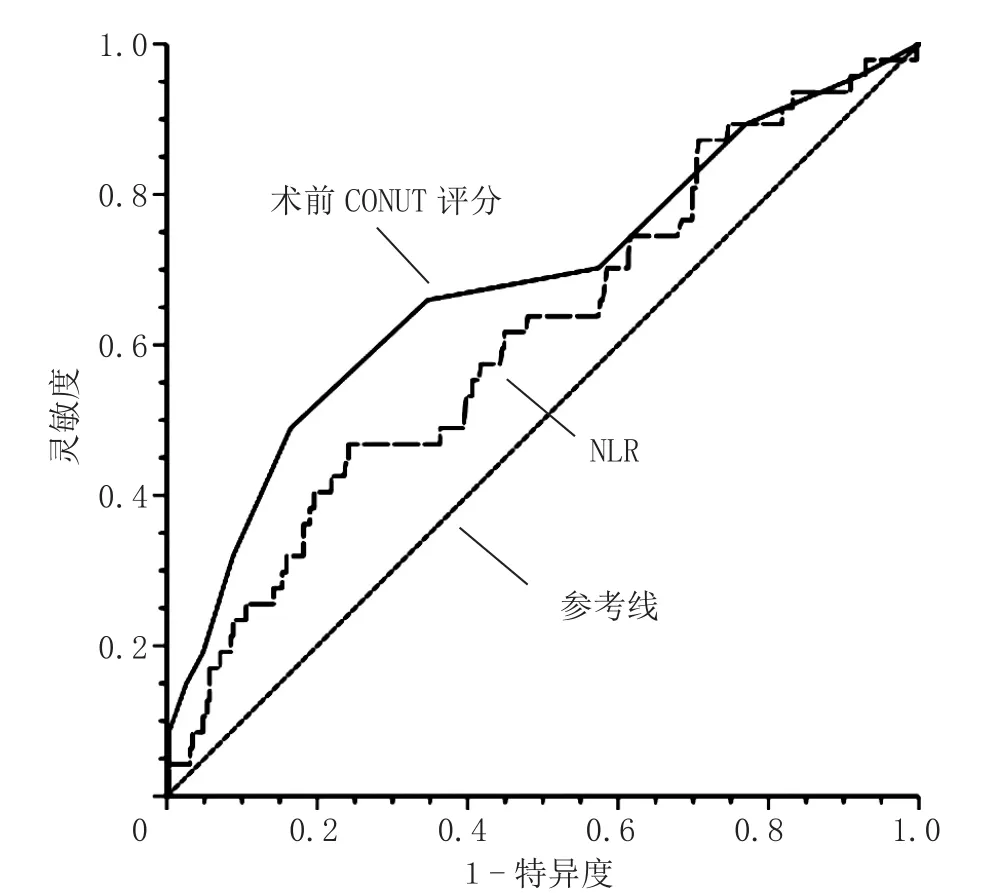
图1 术前CONUT评分、NLR预测老年髋部骨折患者术后1年死亡的ROC曲线Figure 1 ROC curves of the preoperative CONUT score and neutrophilto-lymphocyte ratio predicting 1-year postoperative mortality in elderly patients with hip fracture
3 讨论
患者自身的营养不良不仅可导致骨骼愈合延迟,还会影响患者肢体功能恢复到骨折前的水平,严重影响患者的生活质量[6]。因此评估髋关节骨折患者的营养状况变得越来越重要,但目前尚缺乏有效、客观地评估这类患者的营养状况的工具。本研究结果显示,年龄、陈旧性脑梗死、肌酐、术前CONUT评分、NLR是老年髋部骨折患者术后1年死亡的影响因素。本研究结果对利用术前CONUT评分预测髋部骨折患者术后1年死亡具有一定价值。
3.1 CONUT评分 CONUT评分不仅常用于外科手术前对患者营养状况的评估,也常用于对人群进行定期地健康评估。研究发现CONUT评分是评估根治性胃癌切除术患者预后的潜在指标[7],并且CONUT评分与患者机体热量消耗[8]和恶性实体肿瘤的进展程度有关。另外,CONUT评分对老年急性心肌梗死经皮冠状动脉介入治疗(PCI)术后的不良心血管事件[9]和老年心力衰竭也具有较好的临床预测价值[10]。目前CONUT评分用于评估髋部患者营养状况和预测术后死亡的研究还相对较少,YAGI等[11]发现术前CONUT评分与髋部骨折术后并发症发生率独立相关,可用于髋部骨折患者的风险评估,以预测术后短期并发症发生率。KOTERA[12]发现CONUT评分可预测髋部骨折患者术后180 d的死亡率。但术前CONUT评分用于预测髋部骨折患者术后1年死亡的文献较少。本研究发现术前CONUT评分预测老年髋部骨折患者术后1年死亡的AUC为0.681,略高于CONUT评分预测结直肠癌患者5年生存率的AUC(0.64)[13]及NLR预测术后1年死亡的AUC(0.611)。
本研究认为CONUT评分不仅适用于慢性恶性疾病或消耗性疾病,还适用于髋关节骨折等急性疾病,CONUT评分不仅有利于预测髋部骨折术后短期并发症发生、术后短期(180 d)死亡率,而且也有利于评估患者术后1年死亡情况。由于本研究纳入的是白蛋白、淋巴细胞计数、总胆固醇这些客观指标,分别反映了蛋白质储备、免疫防御能力和热量消耗能力,即总体反映了老年髋部骨折患者营养、免疫状态[10]或创伤耐受能力,但其具体机制尚未明确,猜测具体原因有以下几种可能:(1)白蛋白水平不仅是机体营养状态的指标,也是肝功能及免疫反应水平的重要指标,白蛋白水平低的患者,其营养状态、肝功能及免疫功能可能存在问题,术前血清白蛋白水平与老年髋部骨折患者不良预后密切相关[14];(2)淋巴细胞计数低下的髋部骨折患者会因免疫力低下而导致术后恢复不良[15],由于老年人的生理状态较青年人下降,可能存在免疫系统功能下降、呼吸功能受损、创面愈合不良等因素;(3)目前关于髋部骨折患者血脂与死亡率关系的研究还相对较少,二者关系的具体机制尚不明确。有研究团队认为骨髓中脂肪占比越高,骨小梁的密度越低[16],在某种脂肪细胞和成骨细胞分化的共同调控因子作用下,紊乱的脂代谢与骨微循环障碍和骨质疏松可能存在相互作用,成为研究脂质-骨代谢相关疾病的新方向。但此观点尚未被证实,仍然有争议。
髋部骨折术后因疼痛、行动困难、机体高分解代谢等原因存在营养摄入或吸收障碍,既往研究发现营养干预可降低术后短期和长期死亡率[17],这可能是因为术前营养干预可以增加总能量、蛋白质和脂质的摄入[18],使谵妄的发病率降低、减少了氧化应激产物的产生,进一步降低血管溃疡的发生率[19]。因此当术前CONUT评分≥5分时,建议尽早进行营养干预,制定标准化、个体化的干预措施改善营养状况,进而改善该人群的临床预后和生存质量。
3.2 NLR NLR可以仅使用客观实验室检查指标进行计算。NLR不仅是反映机体免疫状态的重要指标,同时对机体营养状况评估也有重要作用。KUMAR等[20]和BINGOL等[21]研究发现,入院时NLR可预测老年髋部骨折患者30 d和1年的死亡率。但在一项包含40例患者的小规模研究中发现,入院时NLR与患者高死亡率无关[22]。对于NLR是否与老年髋部骨折患者的高死亡率相关,尚存在争议。
本研究结果显示,NLR预测老年髋部骨折患者术后1年死亡的AUC为0.611,因此NLR对预测患者术后1年预后具有一定临床价值。黄松涛等[23]研究发现NLR预测患者术后1年死亡的AUC为0.866,本研究仅对患者术前NLR进行研究,没有对术后NLR进行分析,患者入院时间、基础疾病存在差异,是否服用阿司匹林、他汀类药物也会对数据造成干扰,这可能是本研究AUC略低于前人研究结果的原因。既往研究显示,NLR是全身炎症免疫标志物,也是危重症、老年急诊腹部手术、冠状动脉粥样硬化性心脏病、高血压、缺血性脑卒中、慢性肾病、糖尿病、慢性心力衰竭、外周动脉疾病等慢性疾病预后不良的独立预测因子[5]。这可能是因为持续的急性炎性反应和持续的应激状态对老年患者的累积效应,此种累积效应导致并发症发生率增加。骨折患者NLR升高与骨折本身的反应过程、骨折前多种伴随疾病的共病状态和可能并发的亚临床感染等相关性需更多的研究进一步探讨[24]。
3.3 高龄 本研究结果表明,老年髋部骨折患者术后1年死亡47例,死亡率为11.78%(47/399),死亡组的平均年龄为(82.6±7.5)岁,80岁以上患者髋部骨折的发生率正在逐年增加,SAVINO等[25]发现高龄髋部骨折患者基础疾病多,预后差,15% ~25%的髋部骨折的老年人1年内死亡,而超过30%的幸存者失去了活动功能和独立生活的能力。因为跌倒是老年人常见的事故类型。老年人为重度骨质疏松高发人群,身体活动及协调能力较差,若不慎跌倒容易造成髋部骨折,高龄患者术后1年死亡率高的原因常是慢性合并症多、术后并发症多、活动能力差,且较多老年人独居,无亲属照顾[26-27],年龄虽是髋部骨折患者术后1年死亡的显著危险因素,但高龄伴随的混杂变量可能较多,本研究的设计不能排除其混杂,所以未考虑将年龄设置为预测指标,下一步本研究团队将排除混杂,研究年龄的独立预测作用。
3.4 陈旧性脑梗死 BLIEMEL等[28]研究发现陈旧性脑梗死病史与老年髋部骨折患者术后死亡率增加有关,张新玉等[29]通过随访244例老年髋部骨折患者术后2年的情况,发现术前合并脑梗死是老年髋部骨折患者日常生活能力差的独立危险因素。有研究指出这可能是因为脑梗死患者常遗留偏瘫或活动障碍,相关肌肉、关节韧带发生失用性萎缩,一方面使骨质疏松进一步加重,另一方面对跌倒时的缓冲降低,造成更大损伤[30]。一部分脑梗死患者存在认知障碍,术后相应并发症增多。结合本试验寻找客观指标建立预测模型的目的,受限于本试验数据,患者陈旧性脑梗死发病具体时间难以统计,患病时间及梗死部位及后遗症的差异可造成一定偏倚,可能使得自变量对因变量的结果影响不稳定,使预测结果不准确,因此,本研究也未使用陈旧性脑梗死构建预测模型。
3.5 肌酐 本研究发现入院时肌酐水平是老年髋部骨折患者术后1年死亡的影响因素。SEYEDI等[31]对204例老年髋部骨折患者进行回顾性分析发现,入院时肌酐>1.3 mg/L的患者骨折后3个月死亡风险是肌酐正常患者的2.5倍。根据LAULUND等[32]学者的研究,入院时肌酐水平高的老年髋部骨折患者3个月死亡风险是肌酐水平正常患者的3倍,预测准确率为69%,本研究得出结论与既往研究结果类似。虽然肌酐对髋部骨折预后作用的机制尚不清楚,笔者认为肌酐是糖尿病、高血压的危险因素,从而可能导致患者心排血量降低、肾血流量减少,舒张期左心室功能不全[33]。另外,肌酐与肿瘤坏死因子α、C反应蛋白、纤维蛋白原的水平以及血脂异常和其他生物标志物之间也存在关联[34-35]。因此较高水平的肌酐可能会对潜在的临床病理、生理机制产生影响。本研究未采用肌酐建立预测模型,虽然肌酐的P值有统计学差异,但根据OR值数据,说明自变量和因变量的关系可能不明显或Logistic回归的最大似然估计可能有一些风险,应进一步增加样本量进行验证。
3.6 GNRI GNRI可 被 分 类 为 重 度(<82)、 中 度(82 ~<92)、轻度(92 ~<99)和正常(≥ 99)[36]。国内学者发现GNRI是老年食管癌、肝癌患者术后死亡的独立危险因素[37-38],GNRI越高提示患者预后较好,其水平越低患者术后严重并发症发生率越大,但其计算公式较为繁琐,目前临床应用并不广泛。
KOTERA[12]发现GNRI是预测老年髋部骨折患者术后短期预后的有效指标,生存组GNRI明显高于死亡组。本研究未发现GNRI是老年髋部骨折患者术后1年死亡的危险因素。结合GNRI计算公式不难看出:其不完全是客观的实验室检查指标,受体质量变化的影响比较大,即个体间差异较大,一般认为国人的平均身高、体质量较欧美人群较低,所以GNRI对髋部骨折术后1年死亡的预测作用不明显。
本研究存在的局限性:(1)样本量相对较小,而且为单中心的临床结果,可能会对肌酐等OR值造成影响,不能完全避免选择偏倚,仍需要行多中心、大样本量的研究。(2)本研究是回顾性研究,因客观原因所收集的数据并非最新数据,仍需要进一步完善相关前瞻性研究。(3)因数据限制及回访配合度,没有对合并症的严重程度、患病时间和患者详细死亡原因进一步分析。(4)术前CONUT评分可能会受到免疫状态、炎症、代谢性疾病和脱水等合并症的影响。例如在患有急性菌血症或某些血液病条件的患者中,淋巴细胞计数可能会更低。在这种情况下,高CONUT评分并不一定代表营养不良。(5)高龄、肌酐、陈旧性脑梗死等危险因素伴随的混杂变量可能较多,本研究设计不能排除其混杂,所以未考虑将其构建预测模型。下一步将收集更详实的数据,排除混杂,开发一种多指标联合诊断预测模型,进而提高预测价值。总之,老年髋部骨折预后差,术后死亡率高,如何降低该病的死亡率是临床所面临的一项挑战,老年髋部骨折术前应充分评估患者身体功能和营养状况,医护人员对于高危患者需要特殊关注,采取合适治疗方式,尽可能减少患者痛苦,提高患者预后生存率。
综上所述,年龄、陈旧性脑梗死、肌酐、术前CONUT评分、NLR是老年髋部骨折患者术后1年死亡的影响因素。术前CONUT评分与老年髋部骨折患者术后1年死亡独立相关,术前CONUT评分有助于评估患者术后的营养状况和死亡风险,其计算简单、数据客观、获取方便,可用于髋部骨折患者术后风险评估。
作者贡献:孟衍蓉负责数据收集分析、统计学处理、论文撰写及文章修改;刘利民提出研究思路,负责研究的设计、组织、实施及数据整理工作,并对文章监督管理,整体负责。
本文无利益冲突。

