2型糖尿病合并慢性肾脏病患者多重用药安全中国专家共识
中华医学会临床药学分会
1 方法
1.1 共识的制订步骤及标准 本共识的制定主要基于以下标准:2011年美国医学研究所发布的关于临床实践指南的定义,通过系统综述生成的证据以及对各种备选干预方式的利弊评价之后提出的最优指导意见;2013年世界卫生组织(WHO)发布的《世界卫生组织指南制订手册》[1];2016年中华医学会发布的《制订/修订<临床诊疗指南>的基本方法及程序》[2]。并将按照卫生保健实践指南的报告条目[3]制作指南计划书和正式指南文件。
1.2 临床问题、证据检索依据及推荐意见形成
1.2.1 临床问题 临床问题来源于临床实践及相关文献预检索,对2型糖尿病(type 2 diabetes,T2DM)合并慢性肾脏病(chronic kidney disease,CKD)诊疗经验丰富的一线临床医师、临床药师进行2轮问卷征集、访谈,并通过对参与本共识撰写的专家开展线上调研和讨论座谈,纳入本共识的临床问题以及对目前诊疗方法的归纳总结。
1.2.2 指南检索和临床证据检索 系统检索PubMed、EMBase、Cochrane Library、 中 国 知 网(CNKI)、万方数据知识服务平台和中国生物医学文献数据库(CBM),以及指南发布网站〔包括英国国家临床优化研究所(National Institute for Health and Clinical Excellence,NICE)、苏格兰院际指南网络(Scottish Intercollegiate Guidelines Network,SIGN)、WHO官网(https://www.who.int/)和中华人民共和国国家卫生健康委员会官网(https://www.nhc.gov.cn/)〕。临床证据检索时间为建库至2022-05-08,限定语种为英文或中文,以“2型糖尿病,Type 2 Diabetes,肾病,nephropathy,nephrosis,nephroma,the kidney disease,肾功能不全,联用,联合用药,combination,多重用药,Polypharmacy”为检索词。检索纳入包含 T2DM合并CKD患者,其中年龄>65岁界定为老年患者。检索结果获得去重后中英文文献2 262篇,精筛后获得安全性相关文献76篇。明确文献的检索策略和纳入、排除标准后,两组共识专家组成员按照题目、摘要和全文的逐级顺序独立进行文献筛选,然后根据预先设计的资料提取表对纳入的文献进行信息提取。存在分歧时通过咨询第三方循证方法学专家的意见,讨论解决。
1.2.3 证据等级评价 共识专家组对证据进行评价,评价工具为牛津循证医学中心临床证据水平分级和推荐级别(OCEBM)[3]。本共识推荐建议的等级依据OCEBM和GRADE推荐强度分级情况,根据证据质量、利弊权衡、患者意愿、价值观、干预的成本和可及的资源等综合考量形成推荐强度,分为A、B、C、D级。纳入的参考文献共76篇,其中推荐级别Ⅰ级的参考文献为70篇(92.11%),推荐级别Ⅱ级的参考文献为6篇(7.89%),详见表1[4-79]。

表1 本共识推荐建议的等级依据牛津循证医学中心临床证据水平分级和推荐级别(OCEBM)Table 1 The level of evidence graded by the OCEBM recommended in the Chinese Expert Consensus on Medication Safety in Polypharmacy in Type 2 Diabetics with Chronic Kidney Disease
1.2.4 共识推荐意见的形成 证据评价组负责证据评价、起草证据总结。证据质量基于OCEBM证据等级评价。指南共识专家组成员通过德尔菲法对推荐意见达成共识后,最终由指南指导委员会审定通过。同行评审主要包括:问题的审核、审核证据表和完整的推荐意见方案(指南小组会议方式进行),秘书组负责记录对意见的反馈和所有的改动。
1.2.5 共识注册 本专家共识已在国际实践指南注册平台(Global Practice Guidelines Registry Platform,http://www.guidelines-registry.cn/国内版)进行注册(注册号:IPGRP-2021CN261)。
2 T2DM合并CKD概况
2.1 流行病学 糖尿病已成为一个严重的全球公共卫生问题,2019年全球糖尿病患病率约为9.3%(4.63亿人),预计2045年将增加至10.9%(7亿人)[80]。持续的高血糖水平会导致全身血管损伤,影响心脏、眼睛、肾脏和神经,并导致各种并发症。其中,CKD是糖尿病严重的伴发症,糖尿病肾病(diabetic kidney disease,DKD)最为常见[81]。CKD是以肾脏结构和/或肾功能持续异常为特点的临床综合征,全球CKD发病率为8% ~16%[82-83]。超过40%的糖尿病患者可能会发展为CKD,患者大多数为早期CKD(CKD 1 ~2期);有些患者将进展为需要透析和/或移植的终末期肾脏病[80]。根据年龄分层分析发现,≥65岁的T2DM患者的CKD患病率高达58.7%,且分期更晚[84]。
2.2 T2DM合并CKD多重用药的国内外指南或共识现状 目前国内外未见较为全面的T2DM合并CKD患者的临床多重用药安全指南,已颁布的部分指南只考虑了一种共病,对于如何管理多病共存患者的具体建议有限。国内外发布的有关老年人潜在不适当用药(potentially inappropriate medications,PIM)的判断标准共15个,但只有Beers老年人潜在性不适当用药规范[84](AGSBeers Criteria®)中涉及少部分不良的药物-药物相互作用(adverse drug-drug interactions,ADI)内容。因此,T2DM合并CKD患者临床多重用药安全共识亟待制订、颁布,以避免或减少多药联用时ADI带来的损害,提高安全用药水平。
2.3 糖尿病合并CKD的治疗目标和策略 糖尿病合并CKD患者应采用综合治疗策略,以降低心血管疾病的风险和肾脏疾病进展为主要治疗目标,并需要严格控制心血管危险因素包括高血压、高血糖、血脂异常、吸烟、肥胖等,有效缓解蛋白尿、避免使用肾毒性药物和调整药物剂量,以延缓CKD进展[85]。
肾小球滤过率(GFR)是评价肾脏功能的重要指标之一,根据估算肾小球滤过率(eGFR)来进行CKD的肾功能分期。经研究发现尿白蛋白/肌酐比值(UACR)和eGFR下降均为终末期肾脏病和心血管死亡的独立危险因素,且二者具有协同作用[86]。肾功能分期参考改善全球肾脏病预后组织(KDIGO)制订的2012年版临床实践指南分期标准,详见表2[87]。

表2 糖尿病合并CKD的肾功能分期特征Table 2 Characteristics of stages of CKD in type 2 diabetes
2.3.1 降糖治疗 血糖控制可延缓CKD的进展,对于以预防并发症为主要目标的患者,糖化血红蛋白(HbA1c)控制推荐目标值可适当放宽,推荐目标值:HbA1c<6.5%或 HbA1c<7.0%;对于有多种合并症或低血糖风险高的患者,HbA1c可在较高的推荐目标值, 如:HbA1c<7.5% 或 HbA1c<8.0%[80]。 降 糖 达 标可缓解蛋白尿加重或进展以及减少发展为CKD 3期患者的比例,且对于已有大量蛋白尿的患者,可逆转其为微量蛋白尿或正常蛋白尿[88-89]。降血糖药物主要包括胰岛素、双胍类、磺脲类、格列奈类、α糖苷酶抑制剂、噻唑烷二酮(TZD)类、二肽基肽酶 4(DPP-4)抑制剂、钠-葡萄糖协同转运蛋白 2抑制剂(SGLT2i)和胰高血糖素样肽1受体激动剂(GLP-1RA)等药物。1型糖尿病(T1DM)患者需要胰岛素治疗,而对于T2DM患者,有许多治疗选择和组合。由于CKD患者的胰岛素和其他药物的清除率降低,因此这类人群更易发生低血糖,降糖药物种类和剂量可能需要随着肾功能水平而调整。
2.3.2 降压治疗 控制CKD患者的高血压不仅可以减缓肾损伤的进展,还可以降低心血管疾病的风险。糖尿病合并CKD的降压治疗,在尿白蛋白排泄率(AER)<30 mg/24 h时,降压目标值为收缩压(SBP)≤140 mm Hg(1 mm Hg=0.133 kPa),舒张压(DBP)≤90 mm Hg;在AER>30 mg/24 h时,降压目标值为SBP≤ 130 mm Hg,DBP≤ 80 mm Hg[90]。无蛋白尿的CKD高血压患者,可选用血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)、钙离子通道阻滞剂(CCB)、噻嗪类利尿药中的1种或2种治疗,若不能控制可继续联合α-受体阻滞剂、β-受体阻滞剂、盐皮质激素受体拮抗剂(MRA)等;有蛋白尿的CKD高血压患者,首选ACEI或ARB联合或不联合CCB,若不能控制,可在此基础上联合α-受体阻滞剂、β-受体阻滞剂、噻嗪类利尿剂、MRA等;严重高血压患者可选择2种或2种以上的降压药物联合治疗[91]。
2.3.3 调脂治疗 血脂异常与糖尿病合并CKD患者风险之间存在关联,通过他汀类药物调节血脂可降低心血管疾病事件和死亡率[92]。研究表明他汀类药物在CKD末期和移植后的调脂及预防心血管疾病(CVD) 事件方面是安全有效的[93]。
2.3.4 降尿酸治疗 高尿酸血症是CKD发展的危险因素,且与CKD的全因死亡率相关,降低血尿酸水平可改善肾损伤[94]。别嘌醇在肾功能不全时易在体内蓄积,增加中毒风险,禁用于CKD 5期患者;非布司他在轻度至中度肾功能不全甚至终末期 CKD 的患者中无需调整剂量,其可以减缓CKD 3期和CKD 4期无症状高尿酸血症患者的eGFR下降[95]。苯溴马隆不推荐CKD 4期及以上患者使用,禁用于有肾结石的患者。为避免肾功能受损影响药物代谢和排泄导致药物蓄积中毒,应根据肾功能分期合理选择降尿酸药物[96]。
3 糖尿病合并CKD患者联合用药风险和监测建议
3.1 糖尿病合并CKD患者使用降糖药的风险和监测建议 临床研究结果显示降糖达标可使早期糖尿病患者或早期CKD患者主要肾脏终点事件发生率降低20%,且对于已有大量蛋白尿的患者,可逆转其为微量蛋白尿或正常蛋白尿[97]。T2DM合并CKD患者宜根据肾功能情况个体化选择口服降糖药并根据肾脏损害程度调整剂量,详见表3[98-109]。

表3 糖尿病合并CKD患者单独使用降糖药的风险和监测建议Table 3 Risk and monitoring suggestions of taking hypoglycemic drugs alone in patients with diabetic CKD
3.2 糖尿病合并CKD患者联合使用降糖药的风险和监测建议 联合多种降糖药物同时治疗时,可能增加低血糖风险,主要药物包括胰岛素、磺脲类和非磺脲类胰岛素促泌剂等。临床上常用降糖药物联用的风险和监测建议详见表4[110-120]。

表4 糖尿病合并CKD患者部分常用降糖药物联用的风险和监测建议Table 4 Risks and monitoring suggestions of some commonly used hypoglycemic drugs in diabetic CKD patients
3.3 糖尿病合并CKD患者降糖药与降压药、调脂药联用的风险及监测建议 糖尿病合并CKD患者降糖药物与其他药物联用不可避免而且非常普遍,多药联用可能增加ADI风险,部分会导致严重的后果。鉴于此,关注这类患者多重用药的风险,并提出管理措施,以避免或减少多药联合治疗时药物相互作用带来的损害。
血压、血脂异常与糖尿病合并CKD患者心血管疾病事件和死亡率之间存在关联[94]。对于有蛋白尿的CKD高血压患者,ACEI/ARB可作为首选降压药物,但使用时需注意其与降糖药物之间的联合用药风险;例如吉非罗齐可用于糖尿病合并CKD患者的调脂治疗,对CYP2C8具有不可逆的抑制作用,易与其他药物发生药物相互作用,详见表5[121-124]。
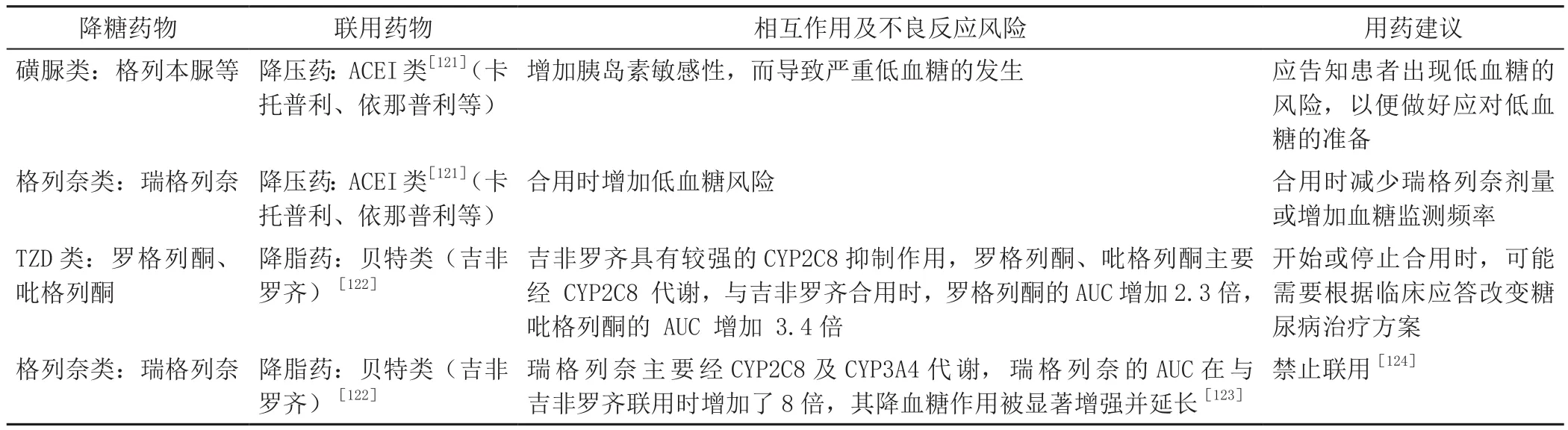
表5 降糖药与降压、降脂药联用的风险及监测建议Table 5 Risks and monitoring suggestions of the use of hypoglycemic drugs with antihypertensive and lipid-lowering drugs
3.4 糖尿病合并CKD患者降糖药与其他药物联用的风险及监测建议 糖尿病合并CKD患者除严格控制血糖、血压、血脂等心血管以及肾脏病进展高危因素外,还会合并其他慢性疾病,包括心力衰竭、血栓栓塞、感染等,需要警惕CKD患者使用其他药物及多药联用的用药风险,详见表6 ~9[125-130]。
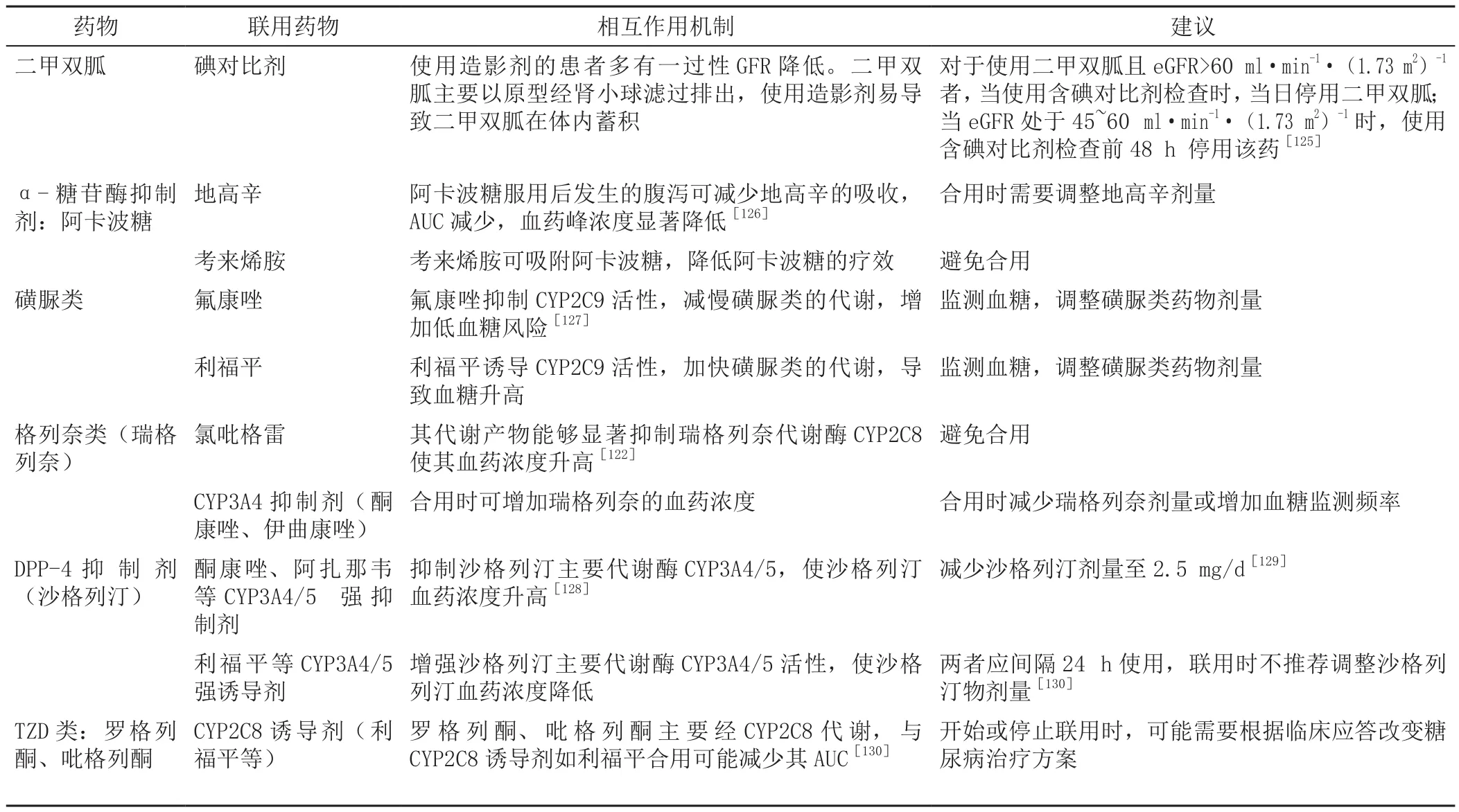
表6 降糖药与其他相关药物联用的风险及监测建议Table 6 Risks and monitoring suggestions of the use of hypoglycemic drugs with other related drugs
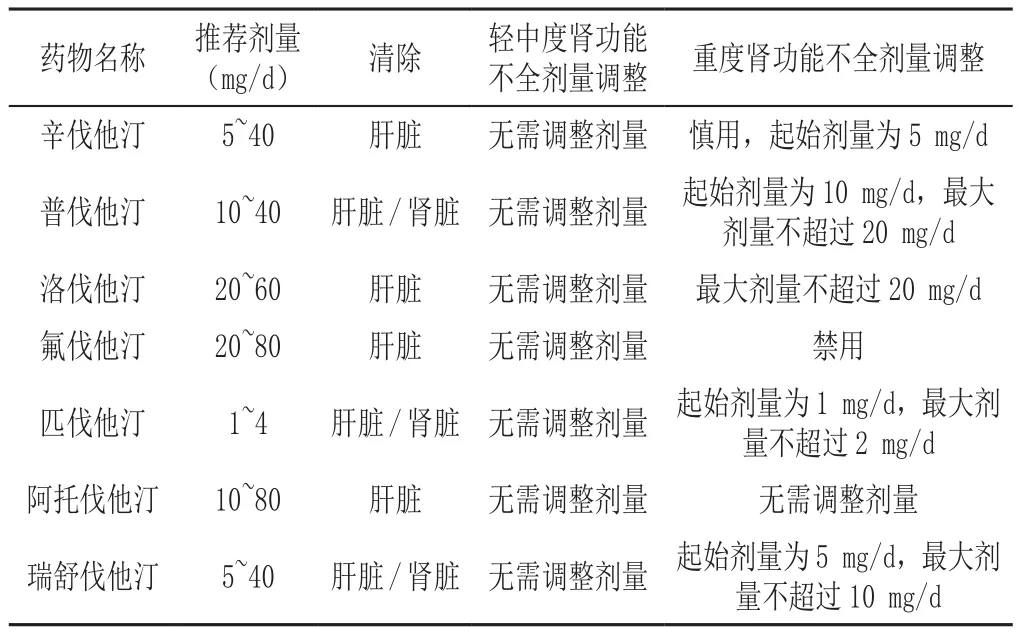
表7 他汀类药物在CKD患者中的推荐剂量Table 7 Recommended dose of statins in T2DM patients with CKD
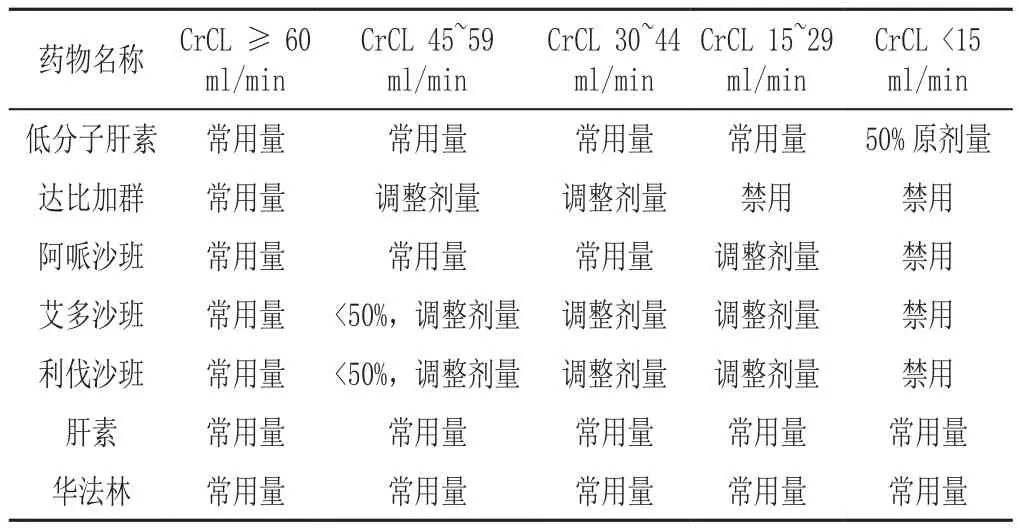
表8 老年患者肾功能受损时的抗凝药物使用Table 8 Use of anticoagulants in elderly T2DM patients with impaired renal function
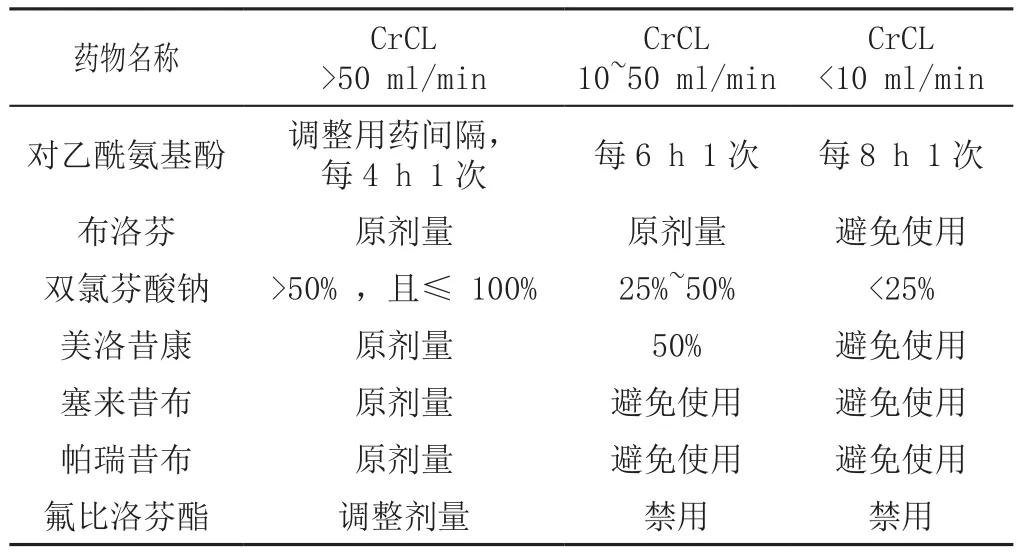
表9 老年患者肾功能受损时非甾体类抗炎药的剂量调整Table 9 Dose adjustment of nonsteroidal anti-inflammatory drugs in elderly T2DM patients with impaired renal function
4 老年患者药物治疗特征及多因素风险管控
4.1 老年糖尿病合并CKD患者药物治疗特征 基于老年人生理特征和糖尿病合并CKD患者多重用药特点,老年糖尿病合并CKD患者还存在以下的用药风险。
4.1.1 糖尿病合并CKD老年患者,血清白蛋白的显著减少会改变药物的分布容积并影响其清除率,多药并用时更易引起不良反应[131]。
4.1.2 老年糖尿病患者血糖控制目标与其他人群不同,更需要注意避免低血糖。根据《中国成人2型糖尿病患者糖化血红蛋白控制目标及达标策略专家共识》[5]以及《中国老年糖尿病诊疗指南(2021年版)》[132],对于年龄较大的患者,HbA1c目标值较为宽松时可能实现获益。如合并CKD 1 ~3a期的老年糖尿病患者HbA1c目标值宜<7.5%,3b期及以上患者HbA1c目标值宜<8.0%,不合并其他终末期慢性疾病的老年糖尿病透析患者HbA1c目标值宜<8.5%[133]。对于使用低血糖风险较高的药物(如胰岛素、磺脲类药物、格列奈类药物等)的患者需特别警惕低血糖风险。
4.1.3 老年糖尿病合并CKD患者还通常合并有心血管疾病以及认知功能障碍等,因此老年糖尿病合并CKD患者的预后较单纯 T2DM或单纯CKD患者更差。
4.1.4 老年糖尿病合并CKD患者应注意急性肾损伤(AKI)的风险。很多药物具有肾损伤的风险,如某些抗菌药物、非甾体类抗炎药、某些中草药等。合并心血管疾病、脓毒血症及急性高血糖和酮症酸中毒等,亦可诱发急性肾损伤。使用时应严格掌握用药剂量及疗程,同时加强肾功能监测。
4.2 老年糖尿病合并CKD患者药物治疗多因素风险管控 糖尿病合并CKD的老年患者在使用降糖药物合并用药期间存在多因素风险,应仔细回顾、整理、评估并列出管控规划。
4.2.1 做好疾病进展风险评估与管理,制定多重用药风险管控规划。
4.2.2 根据老年患者生理特点、药物代谢特征、用药依从性等情况,评估用药方案合理性与安全性风险[134-135]。
4.2.3 制定个体化治疗目标,对患者用药进行分层管理。指导患者正确服药,并建立有效沟通与反馈。
4.3 老年糖尿病合并CKD患者常用药物风险管理
4.3.1 老年患者机体对β-受体阻滞剂敏感性降低,且该类药物本身的内在拟交感活性对糖代谢产生不利影响,建议使用选择性β1-受体阻滞剂或兼有α1-受体阻断作用的β-受体阻滞剂。同时定期评估、管理血压及心率。为了避免掩盖低血糖症状,有反复低血糖发作史的患者应慎用β-受体阻滞剂[136]。
4.3.2 合并缺血性心脏病者,推荐抗凝和抗血小板聚集治疗,并可酌情选用新型降糖药物。
4.3.3 合并CKD 3期的心力衰竭患者,可酌情使用ACEI、ARB、β-受体阻滞剂;若症状不缓解,加用MRA。当患者合并射血分数下降时,可选用沙库巴曲缬沙坦替换ACEI/ARB,或使用新型MRA 如Finerenone 等[137]。
4.3.4 糖尿病合并CKD患者,如使用ACEI/ARB类肾素-血管紧张素系统阻滞剂,当血清肌酐小幅增加,但与基线水平相比增幅<30%,且血容量充足时,仍可继续使用[138]。
4.3.5 对合并高血压的老年糖尿病肾病患者或肾功能已受损者,降低血压应避免联合使用非甾体类抗炎药、抗高血压药中的利尿剂、ACEI和ARB,以减少高钾血症、AKI等不良事件发生[139]。
4.3.6 T2DM肾功能正常或伴有轻度肾功能损伤的患者,常规补充维生素D或ω-3脂肪酸,并不能降低CKD发病率或延缓eGFR下降,因此不建议常规补充维生素D或ω-3脂肪酸[140]。
4.3.7 CKD患者出现贫血,血红蛋白(Hb)<100 g/L时,建议使用促红细胞生成素或联合铁剂治疗。
4.3.8 当CKD-G3b级患者需要使用对比剂进行影像学诊断时,可进行预防性水化治疗,造影剂前3 ~4 h至造影剂后4 ~6 h:每小时静脉滴注0.9%氯化钠溶液1 ml/kg。应用过程中严密观察,避免心力衰竭[141]。
5 糖尿病合并CKD患者特殊合并用药的临床常见问题及推荐建议
5.1 糖尿病合并CKD患者,使用阿司匹林对出血风险的影响?
【推荐意见】
(1)糖尿病合并CKD患者建议谨慎使用阿司匹林[6-8,46-47,74]。(1a,A)
(2)阿司匹林对糖尿病伴CKD患者心血管疾病的一级预防,获益是否大于出血风险,尚无明确的结论[10-12]。(1a,A)
(3)不推荐非老年糖尿病患者常规使用阿司匹林进行心血管事件一级预防[12-13]。(1a,A)
(4)针对老年糖尿病患者心血管疾病的预防,建议从小剂量阿司匹林开始使用,并做好个体化评估[14-16,48,132]。(1a,A)
证据:一项Meta分析表明,在CKD患者中预防性使用低剂量阿司匹林可一定程度上预防CKD心血管事件的发生,但会使 CKD 患者的出血风险增加1倍以上,相似结果在多项RCT研究也有所展现[6-8,46-47,74]。因此,存在较高出血风险的CKD患者应谨慎使用低剂量阿司匹林。2011年一项Meta评价显示,阿司匹林降低了无心血管疾病的糖尿病患者发生主要不良心血管事件(MACE)的风险,同时也存在出血和胃肠道并发症发生率升高的趋势[10]。而2019年[11]和2022年[9]的两项Meta评价似乎得出相反的结论,在评估了CKD患者使用阿司匹林一级预防CVD的风险和收益后,发现患者的心血管疾病大出血事件的风险增加约50%,小出血事件增加了1倍以上,而在获益方面没有明显证据优势。对于阿司匹林一级预防的推荐为年龄≥50岁且合并至少1项主要危险因素,且无出血高风险,不推荐心血管低危患者使用阿司匹林[12-13]。2019年一项Meta分析[14]结果显示,在60岁以上亚组中,降低了9%的MACE发生风险,但增加了24%的大出血风险,因此建议使用小剂量阿司匹林作为糖尿病患者CVD的首要预防策略。多个RCT研究也认为,对于年龄>70岁的老年人(伴或不伴有糖尿病)使用阿司匹林作为一级预防出血风险大于获益,老年患者是否应用阿司匹林作为一级预防还需要临床具体评估[15-16,48,132]。
5.2 T2DM合并CKD患者,二甲双胍联用SGLT2i,是否影响肾功能?
【推荐意见】
(1)二甲双胍联用SGLT2i对肾脏存在获益[45,49-50,75]。(1b,B)
(2) 轻 至 中 度 CKD〔eGFR 30 ~60 ml·min-1·(1.73 m2)-1〕的T2DM患者,推荐使用二甲双胍和SGLT2i 双重治疗,以减少肾脏不良结局发生率[49-50]。(1b,B)
(3)eGFR 30 ~90 ml·min-1·(1.73 m2)-1并伴白蛋白尿的T2DM患者,推荐使用二甲双胍和SGLT2i 双重治疗,以减轻肾功能丧失、预防终末期肾脏病、降低肾病死亡率[45]。(1b,B)
注意:SGLT2i在美国食品药品监督管理局(FDA)说明书中指出,在eGFR<30 ml·min-1·(1.73 m2)-1〔其中达格列净 eGFR<45 ml·min-1·(1.73 m2)-1〕的成人T2DM患者中不建议使用该类药物改善血糖控制水平,但可继续用于降低eGFR和减少终末期肾脏疾病的发生风险,透析患者除外。中华人民共和国国家食品和药品监督管理局(SFDA)规定二甲双胍在 eGFR<45 ml·min-1·(1.73 m2)-1患者中禁用,而 FDA 规定 eGFR<30 ml·min-1·(1.73 m2)-1患者禁用。
证据:多项Meta分析表示,与二甲双胍单药治疗相比,SGLT2i 联合二甲双胍的额外治疗明显且持续降低 T2DM患者的HbA1c[17-24],未 增加 严重不良事件的发生风险[25]。2021年一项Meta分析中提到,SGLT2i 明显降低肾脏事件的发生风险[26],相似结论也出现在几项大型队列研究和RCT中[4,51-52,76]。在 2021 年一项回顾性研究中提到联用二甲双胍可以消除对SGLT2i 使用后的eGFR水平下降,因此两药联用对肾脏存在获益[75]。2018年一项关于 T2DM伴肾功能损害患者的2/3 期临床研究的事后分析表明,达格列净可用于治疗 CKD 3a 期患者〔eGFR ≥ 45 ml·min-1·(1.73 m2)-1且 < 60 ml·min-1·(1.73 m2)-1〕[53]。 另 外 EMPA-REG研 究[45]、DECLARE-TIMI 研 究[49]、CREDENCE研究[50]和 SCORED研究[54]中 50%以上患者均为二甲双胍与SGLT2i联用治疗,各研究在减轻肾功能丧失、预防终末期肾脏病、降低肾病死亡率方面展示出明显获益,并可将SGLT2i适用范围降低至eGFR ≥30 ml·min-1·(1.73 m2)-1范围内。
5.3 T2DM合并CKD患者,使用二甲双胍为基础用药时,联用SGLT2i与二甲双胍单药相比,是否增加泌尿、生殖系统感染的风险?
【推荐意见】
(1)T2DM患者单用SGLT2i或联用二甲双胍时,均应重视生殖系统感染风险,应谨慎选用[27-28,77](1a)。女性患者应用恩格列净时,生殖系统感染风险明显增加,建议谨慎选择和使用[77],必要时可考虑换用其他品种。(1a,A)
(2)T2DM合并CKD患者选用SGLT2i时需要关注生殖系统感染高风险。(B)
(3)SGLT2i引起尿道感染的风险尚有争论[21,25],选用时应权衡利弊。(B)
证据:目前关于SGLT2i与二甲双胍联用是否会增加泌尿、生殖系统感染的风险尚存争议。多项Meta分析研究提示,与单用二甲双胍相比,SGLT2i会增加尿道感染和生殖系统感染的风险[17-18,21];相似结论也出现在2022年一项回顾性队列研究中,与 DPP-4 抑制剂、SU 类降糖药和二甲双胍联用TZD相比,SGLT2i作为二甲双胍的辅助用药,生殖系统和尿道感染的风险更高[77]。但也有几项Meta分析提示,SGLT2i与二甲双胍联用的尿道感染的发生率与单用二甲双胍相似,但两者联合治疗组生殖系统感染略高[19-20,22]。国内一项纳入9项RCT研究、3 422例患者的Meta分析表明,与单用二甲双胍相比,联用SGLT2i可增加 T2DM患者治疗期间发生生殖系统感染的风险,但泌尿系统感染风险不存在明显差异[24]。2017年一项纳入3项RCT的Meta分析表明,SGLT2i联合二甲双胍治疗与单用二甲双胍相比,尿道感染和生殖系统感染的相对风险无统计学差异[20]。而2019年一项纳入4项RCT、3 749例患者的Meta分析结果显示,与二甲双胍单药治疗和SGLT2i两组单药治疗相比,联合治疗的尿道感染RR(95%CI)分别为1.12(0.77,1.61)和0.97 (0.69,1.37)。与二甲双胍单药治疗和SGLT2i单药治疗相比,联合治疗的生殖系统感染RR(95%CI)分别为2.22(1.33,3.72)和0.69(0.50,0.96)。这一结果提示尿道和生殖系统的感染风险增加主要源于SGLT2i[18]。一篇关于恩格列净剂量与安全性的Meta分析提示服用恩格列净的女性患者生殖系统和尿道感染发生率显著高于男性患者[27]。相反2020年一项纳入51项RCT,24 371例患者的Meta分析显示SGLT2i会显著增加T2DM患者的生殖器感染的风险,但风险与剂量高低无关[28]。随后2021年该团队进一步探索不同剂量对 T2DM患者的总体疗效,结果显示与低剂量SGLT2i相比,高剂量SGLT2i更容易达到血糖控制目标,同时在血压和体质量方面控制更好[29]。目前针对肾功能不全的 T2DM患者使用SGLT2i与二甲双胍联合治疗的尿道及生殖器感染风险尚无报道。
5.4 ACEI联合ARB在DKD人群中,是否增加高钾血症和AKI的风险?
【推荐意见】
(1)建议临床首选ACEI或ARB单药治疗,逐渐加量至最大剂量后,再加用/换用其他药物以达到所需治疗目标,不推荐联用[32]。(1a,A)
(2)两药联用可通过双重阻断肾素-血管紧张素-醛固酮系统(RAAS)来减少DKD的蛋白尿,但临床获益仅限于降低蛋白尿,对GFR的益处尚不明确。同时存在一定高钾血症和AKI的风险[31-35]。(1a,A)
证据:ACEI 和ARB属于RAAS抑制剂,单药使用可有效控制血压并降低尿蛋白水平。多项Meta分析[31-33]表明,两药联用可明显降低糖尿病患者的蛋白尿水平,但不改善终末期肾脏病进展,对全因死亡率和心血管死亡率也无改善[31-33]。有研究发现,在DKD患者中,氯沙坦联合赖诺普利会增加高钾血症和AKI的风险,提示两药联用会增加不良事件风险[34]。血钾方面,5项 Meta分析[31-33]均报道了ARB与ACEI联用会导致血钾显著升高,但有1项中文Meta分析[56]表示ARB与ACEI联用并未增加高钾血症的风险。JENNINGS等[32]在10项RCT的Meta分析结果中提到,RAAS双重阻断会引起血钾平均升高0.2 mmol/L。另外,1项纳入42篇RCT的Meta分析发现,大量蛋白尿(>300 mg/d)的DKD患者较微量蛋白尿(30 ~300 mg/d)患者的高钾血症风险更高[31]。一项纳入32项RCT的Meta分析同样表明,DKD重度患者(GFR<60 ml/min或UACR>1 000 mg/g)在联合治疗后高钾血症和AKI的发生率较高,而轻度(GFR>60 ml/min或UACR≤1 000 mg/g)患者的高钾血症和AKI 患病率与单药治疗相似[33]。
5.5 T2DM合并CKD患者TZD类药物治疗后,是否增加水肿的发生率?
【推荐意见】
(1)二甲双胍联合TZD类药物治疗较单用二甲双胍会增加水肿发生风险[36-39]。(1a,A)
(2)建议水肿高风险患者,加用TZD联合二甲双胍治疗时,以小剂量(如吡格列酮7.5 mg/d)作为起始治疗剂量,以减少水肿发生风险[57,78]。(2a,C)
证据:二甲双胍和TZD类药物是常用的 T2DM口服治疗药物。临床常在单用二甲双胍未达到理想降糖效果情况下,考虑联合用药以达到更好的降糖效果。目前有2项国内Meta分析[36-37]和1项国外的系统评价[38]一致表明两种药物联合治疗能更有效地降低血糖和HbA1c,同时改善血脂代谢和胰岛素抵抗,但同时水肿发生率明显高于二甲双胍单用组。水肿是一种已知的与TZD类药物相关的不良反应,其单药治疗和二甲双胍联合治疗均报道水肿发生率较高,达11.7%。另有2018年一项研究口服降糖药与黄斑水肿的风险相关的Meta分析[39]共纳入13项研究,该研究提示口服降糖药可能与黄斑水肿的发生率无关〔OR(95%CI)=1.77(0.93,3.37)〕。 但 TZD类〔OR(95%CI)=2.19(1.49,3.21)〕是黄斑水肿的危险因素,使用罗格列酮〔OR(95%CI)=3.12(1.30,7.49)〕会增加黄斑水肿的风险。针对TZD类发生水肿风险的影响因素,2018年一项基于常规临床数据和个体试验数据(n=22 379)进行分层评估的临床研究提示女性及肥胖可能是水肿风险的影响因素之一[78]。TZD类用药剂量作为水肿风险的另一影响因素在一项关于剂量-效应的RCT[57]被提及:与标准和高剂量治疗相比,低剂量吡格列酮在保证降低血糖、调节脂代谢、改善胰岛素抵抗的同时,低剂量(7.5 mg/d)吡格列酮组的外周水肿发生率明显低于标准剂量组(15 mg/d)(3.7% 与26.8%,P=0.001 4)。
5.6 糖尿病伴肾功能不全患者,在ACEI/ARB基础上添加使用盐皮质激素受体拮抗剂(MRA)是否增加高钾血症发生风险?
【推荐意见】
(1)建议中低剂量的新型MRA与ACEI/ARB联用,可减少糖尿病伴肾功能不全患者的蛋白尿,较少引起高钾血症[58]。(1a,C)
(2)糖尿病伴肾功能不全患者,MRA联用ACEI/ARB时,使用噻嗪类或袢利尿剂,可降低高钾血症风险[59]。(1a,C)
(3)糖尿病伴肾功能不全患者,存在高血钾风险时,要进行血钾管理,推荐ACEI/ARB联用Finerenone,同时可常规血钾监测[60-61]。(1a,C)
证据:(1)多项RCT研究均表明MRA联合ACEI/ARB可明显降低DKD患者的蛋白尿水平,有效减缓 DKD 的进展[40-41,58,62]。在长期接受 ACEI/ARB治疗的持续微量白蛋白尿患者中,加入MRA存在明显的肾脏益处[63]。联合使用会增加患者高钾血症的风险,导致停药或剂量减少[62,64,79]。但对大多数患者来说,血钾的增加在可预测和可控制的范围。多数高钾血症是无症状的,不伴有心电图变化,可通过饮食咨询和短期使用钠钾交换树脂(a sodiumpotassium exchange resin)进行管理[59]。因高钾血症退出研究的患者,血钾可在停用MRA后逐渐恢复基线水平[41,63]。
(2)多项研究提示,中低剂量MRA作为RAAS抑制剂的附加疗法,在降低血压、减少尿蛋白并带来心血管益处的同时并未观察到高钾血症或由此导致参与者退出试验[58,65-67],原因很可能是对患者进行了谨慎地选择,如排除有高钾血症病史的患者,密切随访,根据需要自由使用袢类或噻嗪类利尿剂,以及研究持续时间相对较短。类似的低发病率可能不会被普通临床医生在常规使用这种治疗中看到[68]。
(3)Finerenone在我国尚未获批。开始治疗前应测量血清钾水平和eGFR。在欧盟和FDA的说明书中,若血清钾≤4.8 mmol/L,可启动Finerenone治疗。如血清钾>4.8 ~5.0 mmol/L,可考虑开始Finerenone治疗,并根据患者特点和血清钾水平在前4周内进行额外的血清钾监测。如果血钾> 5.0 mmol/L,则不应开始治疗。Finerenone起始剂量根据患者肾功能不同有所差异,eGFR≥60 ml·min-1·(1.73 m2)-1者,起始剂量20 mg/次,1次/d,eGFR≥25 ml·min-1·(1.73 m2)-1且 <60 ml·min-1·(1.73 m2)-1者,起始剂量 10 mg/次,1次 /d,eGFR<25 ml·min-1·(1.73 m2)-1者不推荐。
(4)FIGARO-DKD等国际大型研究表明,在患有DKD和eGFR> 25 ml·min-1·(1.73 m2)-1的患者中,已经使用RAAS抑制剂,添加Finerenone可进一步改善复合肾脏和心血管结局。蛋白尿减少;收缩压也有小幅下降。CKD和T2DM患者的常规钾监测被认为适合管理高钾血症的风险,能够最大限度地减少高钾血症的影响。使用利尿剂或SGLT2i可降低风险。新出现的数据表明,更新的钾结合剂可能会降低这种风险[60,69]。
5.7 糖尿病合并CKD患者,出现高钾血症时如何选用钾结合剂进行降血钾治疗?
【推荐意见】
(1)糖尿病合并CKD患者高钾血症,可以选用钾结合物进行降钾治疗[42]。(1a,A)
(2)聚苯乙烯磺酸盐(PS)类钾结合物治疗糖尿病合并CKD患者高钾血症,特别是在联合噻嗪类利尿剂使用时,推荐使用聚苯乙烯磺酸钙(CPS)[42]。(1a,A)
(3)急性高钾血症患者中(血钾<6 mmol/L时),环硅酸锆钠(SZC)是可选药物[43]。(1a,A)
(4)Patiromer能降低T2DM合并CKD高血钾患者的血清钾,且不受胰岛素使用的影响[70]。(1b,C)
(5)联用ACEI/ARB时,有条件时可推荐使用Patiromer中、低剂量降血钾治疗[71]。(1b,C)
证据:一项关于钾结合剂治疗CKD高钾血症的Cochrane系统评价提示,CPS组与聚二硫二丙烷磺酸钠(SPS)组血清钾、SBP、DBP水平变化比较均没有统计学差异[42]。在与噻嗪类利尿剂联用时,与CPS相比,SPS增加了恶心的风险[72]。急性高钾血症患者中,SZC是首选药物,因为其能更快地降低血清钾水平,推荐起始剂量 10 g,3次/d,口服给药,用药最长不超过 48 h[43]。而在慢性高钾血症患者中,Patiromer似乎是首选药物[44]。在一项回顾性研究中,Patiromer能降低T2DM合并CKD高血钾患者的血清钾,且不受胰岛素使用的影响[70]。在AMETHYST-DN(NCT01371747) 研 究[71]中,DKD患者使用ACEI/ARB单用或联合用药,添加或不添加螺内酯的情况下,使用Patiromer结果显示:(1)轻度高血钾(>5.0 ~5.5 mmol/L)时中等剂量Patiromer(18.6 g/d)可能引起血清钾变化;(2)中度高血钾时(>5.5 ~<6.0 mmol/L)时低剂量(8.4 g/d)和中等剂量Patiromer可引起血清钾变化;(3)Patiromer在糖尿病合并CKD患者高钾血症应用时,低剂量和中等剂量Patiromer不影响血糖。在AMETHYST-DN研究的长期疗效和安全性随访也发现:在DKD的心力衰竭患者伴ACEI/ARB引起的高钾血症,使用Patiromer耐受性良好,且疗效显著[73]。共识专家组(按姓氏汉语拼音排序):
卞晓岚(上海交通大学医学院附属瑞金医院)、陈万生〔海军军医大学第二附属医院(上海长征医院)〕、陈孝(中山大学附属第一医院)、陈成群(郑州大学第一附属医院)、戴海斌(浙江大学医学院附属第二医院)、董艳(上海交通大学医学院附属新华医院)、段俊丽(上海交通大学医学院附属新华医院)、范国荣(上海交通大学医学院附属第一人民医院)、费爱华(上海交通大学医学院附属新华医院)、高成金(上海交通大学医学院附属新华医院)、高申〔海军军医大学第一附属医院(上海长海医院)〕、葛卫红(南京大学医学院附属鼓楼医院)、顾智淳(上海交通大学医学院附属仁济医院)、郭澄(上海交通大学医学院附属第六人民医院)、郭代红(中国人民解放军总医院)、姜玲〔中国科学技术大学附属第一医院(安徽省立医院)〕、蒋更如(上海交通大学医学院附属新华医院)、金鹏飞(北京医院)、李朋梅(中日友好医院)、李晓宇(复旦大学附属中山医院)、廖赟(上海交通大学医学院附属同仁医院)、刘皋林(上海交通大学医学院附属第一人民医院)、刘雅丽(首都医科大学附属北京儿童医院)、刘振国(上海交通大学医学院附属新华医院)、缪丽燕(苏州大学附属第一医院)、邱峰(重庆医科大学附属第一医院)、苏青(上海交通大学医学院附属新华医院)、孙新(上海交通大学医学院附属新华医院)、孙洲亮〔厦门大学附属第一医院同安院区(厦门市第三医院)〕、童荣生(电子科技大学附属医院·四川省人民医院)、王海峰(吉林大学第一医院)、王靖雯(空军军医大学西京医院)、王卓〔海军军医大学第一附属医院(上海长海医院)〕、文爱东(空军军医大学西京医院)、夏雨(北京大学人民医院)、徐阿晶(上海交通大学医学院附属新华医院)、杨勇(电子科技大学附属医院·四川省人民医院)、余自成〔同济大学附属杨浦医院(上海市杨浦区中心医院)〕、原永芳(上海交通大学医学院附属第九人民医院)、张健(上海交通大学医学院附属新华医院)、张伶俐(四川大学华西第二医院)、张晓坚(郑州大学第一附属医院)、张玉(华中科技大学同济医学院附属协和医院)、赵青威(浙江大学医学院附属第一医院)、赵荣生(北京大学第三医院)、郑英丽(中国医学科学院阜外医院)、周玉冰(郑州大学第一附属医院)、祝德秋(上海同济医院)、左笑丛(中南大学湘雅三医院)
共识编写组:
卜书红、陈霁晖、简蔚霞、李莉霞、李敏、刘艳、马婧、祁佳、王芳、魏昕、徐阿晶、姚慧娟、杨锐、张健、张春、张洪梅(上海交通大学医学院附属新华医院),何霞、朱昶宇(电子科技大学附属医院·四川省人民医院),梅童霖、王丽霜(北京诺道认知医学科技有限公司),施芳红(上海交通大学医学院附属仁济医院),黄金路、张剑萍(上海交通大学医学院附属第六人民医院)
本文无利益冲突。

