穴位埋线干预绝经后骨质疏松症大鼠代谢组学机制研究
石 娜,张楚穹,欧阳钢
(1.临沂市人民医院,山东 临沂 276003;2.南京中医药大学附属淮安市中医院,江苏 淮安 223001; 3.江苏省老年病医院,江苏 南京 210024)
绝经后骨质疏松症(Post-menopausal osteoporosis,PMOP)在绝经后女性的发病率大约为25%~50%,多发生在55~70岁或绝经后5~10年内,以60~65岁为发病高峰期[1]。患者可出现全身乏力、骨痛等症状,且易发生骨折[2],严重影响患者的生活质量。目前西医治疗本病的方法主要是应用激素替代疗法,但这种治疗方法不良反应多,且有致癌的风险[3]。穴位埋线对PMOP的防治有确切的疗效,治疗机制多集中于提高骨密度、提高雌激素水平及改善骨代谢生化指标等方面[4-6],而对信号通路及分子层面的研究较少。代谢组学是一门定量测量生物样品中所有代谢产物组成及其在内外刺激[7]下动态变化的科学,代谢产物水平的高低与机体发育、生理和病理状态有关[8]。笔者拟使用代谢组学观察与PMOP相关的代谢产物及代谢通路,并初步探讨穴位埋线治疗PMOP的靶代谢产物及代谢通路,为临床应用提供理论依据。
1 材料与方法
1.1 实验动物
健康雌性3月龄SD大鼠32只,体质量180~200 g,未曾交配,购于浙江省实验动物中心[SPF级,许可证号:SCXK(浙):2014-0001]。在南京中医药大学实验动物中心(屏障环境)喂养,环境温度21~25 ℃,湿度40%~60%,光照时间每日12 h,饲养期间大鼠自由摄食饮水。动物喂养及实验方案通过南京中医药大学伦理审查(No.201812A023)。
1.2 造模与分组
大鼠适应性饲养1周后,将其随机分为A空白组、B假手术组、C模型组及D埋线组,每组各8只。用3 %戊巴比妥钠(按0.1 mL/100 g)腹腔注射麻醉大鼠后,局部去毛,取背侧改良切口,切口位于最下肋下缘一横指,腰椎旁开一个半横指位置,二者交点为切口中心,纵行切开0.8~1 cm,于深部脂肪层中可发现粉红色卵巢,在子宫角处结扎后切除卵巢。假手术组仅切除卵巢周围少量脂肪组织,逐层缝合。为防止抗菌药物对实验结果的影响,术后不予注射或局部应用任何抗菌药物。大鼠术后自由摄食、饮水。
1.3 干预方法
1.3.1 空白组、假手术组及模型组 正常喂养,不做任何处理。
1.3.2 埋线组 选取大鼠“肾俞”“后三里”进行埋线干预。按《实验针灸学》[9]大鼠常用针灸穴位中的定位方法选取“肾俞”“后三里”。“肾俞”:第2腰椎下两旁;“后三里”:膝关节后外侧,在腓骨头下约5 mm处。用7号埋线针(高冠牌,生产许可证:苏食药监械生产许2001-0244号),3/0的长约5 mm胶原蛋白线(龙腾生物公司,生产许可证:赣食药监械生产许可证:20160099)进行埋线。由助手帮忙固定住大鼠,并将穴位局部皮肤绷紧,术者右手持针,斜面端朝上,使针尖快速刺透皮肤,刺入到穴位肌肉层时放置胶原蛋白线,然后将埋线针退出,当针体退到皮下时快速出针并按压针孔,保证线体置于穴位下的肌肉内,皮肤外面不能露出线头。每次选取单侧“肾俞”“后三里”埋线,双侧穴位交替,每周埋线1次,连续治疗12周。
1.4 标本收集
收集标本前1天晚上8点开始禁食,不禁水。第2天使用3 %戊巴比妥钠(按0.1 mL/100 g)将大鼠进行腹部麻醉后,置于无菌操作台上,腹主动脉取血后离心血清,置于-20 ℃冰箱保存。戴一次性无菌手套,用无菌镊子收集大鼠肠管粪便,-80 ℃低温冰箱保存。大鼠放血致死后,剥离大鼠右侧股骨及胫骨,彻底去除肌肉及肌腱等组织,用生理盐水纱布包裹后放入EP管中,置于-20 ℃冰箱保存。
1.5 主要仪器和试剂
1.5.1 仪器 MEDIX90双能X线骨密度检测仪(法国奥斯托公司);雷勃尔离心机(北京雷勃尔离心机有限公司);Thermo QE质谱仪、Thermo Vanquish UHPLC液相色谱、Thermo Hyperil Gold column色谱柱、Thermo ST16R低温离心机和RT-6000酶标仪(深圳雷杜公司)。
1.5.2 试剂 戊巴比妥钠(德国默克公司,中国上海分装);甲醇、甲酸等(美国Thermo公司);ELISA试剂盒(上海酶联生物公司)。
1.6 检测指标及方法
1.6.1 骨密度的检测 将大鼠离体股骨和胫骨自冰箱中取出,室温下静置30 min后,使用MEDIX90双能X线骨密度检测仪进行骨密度检测,进行数据分析,得出骨密度值。
1.6.2 血液指标的检测 使用酶联免疫法测定雌激素含量。按照说明书设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL。分别设定空白孔和待测样品孔,在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL。将样品加于酶标板孔底部,不能触及孔壁,轻轻晃匀,除空白孔外每孔加入酶标试剂100 μL,用封板膜封板后放至37 ℃温育60 min;揭掉封板膜,弃去液体,甩干,每个孔内加满洗涤液,静置30 s后弃去,重复5次,最后拍干;每个孔内先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37 ℃避光显色15 min;每个孔内加终止液50 μL,终止反应;在加终止液后15 min以内测定,以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。
权头真上火,不就结个婚吗,怎么弄得跟电视剧似的,今天他想,明天她不想,还有完吗:“你是现在不想,还是就想跟他吹了?”
1.6.3 代谢组学 (1)样本处理:①取100 mg大鼠粪便经液氮研磨后置于EP管中;②加入500 μL含0.1%甲酸的80%甲醇水溶液,涡旋震荡;③冰浴下静置5 min;④4 ℃ 15 000 rpm离心10 min;⑤取上清加质谱级水将甲醇含量稀释至60 %;⑥稀释后的溶液置于带有0.22 μm滤膜的离心管中;⑦4 ℃ 15 000 rpm离心10 min;⑧收集滤液,进行LC-MS分析。从每个实验样本中取等体积样本混合均匀作为QC样本;Blank样本为含有0.1%甲酸的60%甲醇溶液,处理过程与实验样本相同。(2)色谱条件:色谱柱:Hyperil gold column(C18);柱温:40 ℃,流速:0.2 mL/min。正模式:流动相A:0.1%甲酸;流动相B:甲醇。负模式:流动相A:5 mM醋酸铵,pH 9.0;流动相B:甲醇。(3)质谱条件:扫描范围选择m/z 70~1050;ESI源:Spray Voltage:3.2 kV;Sheath gas flow rate:35 arb;Aux Gas flow rate:10 arb;Capillary Temp:320 ℃。Polarity:positive;negative;MS/MS二级扫描为data-dependent scans。(4)代谢物的鉴定:①将下机数据文件导入CD搜库软件中,进行保留时间、质荷比等参数的简单筛选;②对不同样品根据保留时间偏差0.2 min和质量偏差5 ppm进行峰对齐;③设置信息:质量偏差5 ppm、信号强度偏差30 %、信噪比3和最小信号强度100 000;④进行峰提取,对峰面积进行定量,整合目标离子;⑤通过分子离子峰与碎片离子预测物质分子式;⑥与mzCloud和Chemspider数据库进行对比,用Blank样本去除背景离子;⑦归化定量结果。
1.7 统计学处理
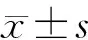
2 结果
2.1 各组骨密度、雌激素比较
表1中可见,经干预12周后,模型组大鼠股骨、胫骨骨密度较空白组及假手术组明显降低,差异具有统计学意义(P<0.05),埋线组与模型组比较,骨密度出现一定水平的升高,差异具有统计学意义(P<0.05)。模型组血清雌激素水平与空白组及假手术组比较明显下降,差异具有统计学意义(P<0.05或P<0.01);埋线组与模型组对比雌激素水平出现一定水平的升高,差异具有统计学意义(P<0.05)。
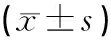
表1 各组骨密度及雌激素对比
2.2 代谢组学结果
对干预后鉴定到的粪便代谢物进行功能和分类注释,经HMDB(Human Metabolome Database)分析,发现粪便脂质、有机酸、糖类和多酮类化合物、有机氧化合物、苯型化合物、核苷、核苷酸、生物碱及其衍生品等物质含量较高。与脂质图谱比对,发现粪便代谢物中所含的脂质主要包括脂肪酸(FA)、聚酮类(PK)、甘油酯(GL)、甘油磷脂(GP)及固醇脂(ST)等。
图1~4 PLS-DA得分散点图中,横纵坐标分别代表样本在第一、第二主成分上的得分。R2Y表示模型的解释率,Q2Y用于评价PLS-DA模型的预测能力,上述4图中可见R2Y均>Q2Y,表示模型建立良好。图1~4中,可见在正负离子模式下,干预后CD两组样本主成分的得分较BD两组更为接近。说明模型组与埋线组大鼠去卵巢后代谢物的种类及数量发生了的变化,埋线可干预这一过程。采用PLS-DA模型第一主成分的变量投影重要度值、差异倍数并结合T-test的P值可以找到不同组别之间的差异代谢物。
图5在负离子模式下,DBC 3组之间共有的差异代谢物有48个,埋线组与假手术组之间共有184个差异代谢物,其中显著上调的代谢物有28个,下调的有156个;埋线组与模型组共有136个差异代谢物,其中显著上调的代谢物有7个,下调的有129个。图6在正离子模式下,DBC 3组之间共有的差异代谢物有12个,埋线组与假手术组之间有94个差异代谢物,其中显著上调的代谢物有68个,下调的有26个;埋线组与模型组之间有58个差异代谢物,其中显著上调的代谢物有8个,下调的有50个。可见无论是正离子模式还是负离子模式下,DB两组之间共有的差异代谢物数量都高于DC两组,说明大鼠去卵巢是干预代谢物变化的主要原因,埋线可对代谢物的变化有一定影响。
对检测到的差异代谢物继续进行KEGG富集分析,可以确定不同组之间的差异代谢物行使的主要生物学功能。在KEGG富集气泡图中,X坐标为X/Y(对应代谢途径中不同代谢产物的数量/该代谢途径中所识别出的代谢产物总数)。值越高说明不同代谢物在途径中的富集程度越高。点的颜色表示超几何检验的P值,值越小,检验越可靠,统计意义越显著。点的大小表示对应通路中差异代谢物的数量,点越大表示通路中差异代谢物越多。
图7正离子模式下,DB两组之间差异代谢物富集的KEGG通路主要包括类固醇激素生物合成、皮质醇合成与分泌及库欣综合征,差异具有统计学意义(P<0.05);另外,色氨酸代谢、卵巢类固醇生成、醛固酮合成与分泌、卟啉与叶绿素代谢、刺激神经的配体与受体相互作用和胆汁分泌等KEGG通路中也有一定富集(P>0.05)。D组与B组相比,粪便孕烯醇酮、色氨酸和胆红素等差异代谢物显著上调,而尿皮质醇、黄尿酸和3-hydroxy-5-pregnan-20-one则出现下调。
图8负离子模式下,DB两组之间差异代谢物显著富集的KEGG通路包括糖酵解/糖异生、磷酸戊糖通路和维生素B6代谢通路,差异具有统计学意义(P<0.05)。另外,果糖和甘露糖代谢、磷酸肌醇代谢、硫胺素代谢及半乳糖代谢、半乳糖代谢等通路也出现富集,但这些通路富集结果差异无统计学意义(P>0.05)。D组与B组相比,粪便3-磷酸甘油醛、熊果苷、D-核酮糖-5-磷酸盐、NPC、前列腺素G2、胞嘧啶核苷、7α-25-二羟基胆固醇和二高-γ-亚麻酸盐等差异代谢物出现下调。
图9正离子模式下,DC两组之间差异代谢物富集的KEGG通路包括色氨酸代谢和类固醇激素生物合成,但差异无统计学意义(P>0.05)。D组与C组相比,无上调的差异代谢物,粪便黄尿酸和苯胆碱酮出现下调。图10负离子模式下,DC两组之间差异代谢物显著富集的KEGG通路主要包括血小板活化、亚油酸代谢和5-羟色胺能突触等,差异具有统计学意义(P<0.05)。而花生四烯酸代谢、α亚麻酸代谢、丙酸盐代谢、视黄醇代谢、硫中继系统、AMPK信号通路、坏死性凋亡、血管平滑肌收缩、Fcγ-R介导的吞噬作用、长时程抑制、GnRH信号通路、卵巢类固醇生成和不饱和脂肪酸的生物合成等通路也出现富集,但差异无统计学意义(P>0.05)。D组与C组相比,粪便花生四烯酸、前列腺素G2、二高γ亚麻酸、丁二酸、维生素A、腺苷甲硫氨酸和黄连素等差异代谢物出现显著下调。
3 讨论
绝经后卵巢功能下降和雌激素水平降低是引起PMOP[10]的主要原因。雌激素水平降低可刺激炎症因子的释放,从而增加破骨细胞的活性,导致骨质疏松[11]。此外,雌激素水平的下降还会降低骨对机械刺激的敏感性,导致类似[12]废用性骨丢失的病理改变。
穴位埋线是一种集穴位封闭、针刺、刺血和组织治疗[13]等多种疗效于一体的复合治疗方法。胶原蛋白线在体内被软化、分解和吸收的过程对穴位起了缓慢的“长效针感”效应[14],也有学者认为其是一种局部炎症反应刺激效应[15]。这种刺激可促进肌肉合成代谢,降低分解代谢,使肌蛋白、糖类合成增高而乳酸和肌酸分解代谢降低[16],还可以在大脑皮层功能区建立新的兴奋点,从而调整神经-内分泌和胃肠系统,加速新陈代谢[16-17]。有研究表明穴位埋线可明显改善PMOP患者的临床症状,调节激素水平,增加骨密度[18-20]。这与本研究中埋线组大鼠的血清雌激素水平及骨密度均较模型组明显升高相符,说明埋线对PMOP有明确的治疗作用。
代谢组学技术是近年来发展起来的一种能够全面、快速和简捷地反映体内代谢总体变化的技术手段,它注重人体内部的有机联系以及人体与外在环境的统一,强调用动态观点来研究生物体,从而达到了解病变过程及机体内物质的代谢途径和代谢状况的目的[21]。PMOP作为一种代谢性疾病,必然会导致生物体内的代谢物类型和浓度及代谢通路的改变[22-24]。
笔者发现,大鼠去卵巢后粪便脂质、有机酸、糖类和多酮类等化合物含量较多,这与文献报道的高血糖、高血脂等糖脂代谢紊乱会对骨密度产生负面影响[25]相符。
研究表明[26-28],类固醇激素生物合成、卵巢类固醇生成通路与骨质疏松症的发生密切相关,雌激素及雄激素水平的降低均会增加罹患骨质疏松症的风险。孕烯醇酮是大多数类固醇激素的主要前体,已被认为是一种新的抗骨质疏松剂。SUN X等[29]应用孕烯醇酮治疗卵巢切除术引起的骨丢失,证明孕烯醇酮可预防卵巢切除引起的骨质疏松症。库欣综合征等疾病会导致皮质醇增多,增多的皮质醇会促进蛋白分解,从而使骨基质减少,影响钙的沉着,最终导致骨质疏松症发生。FERRAF等[30]发现库欣综合征患者骨髓肥厚,认为这可能是高皮质激素诱发的骨骼脆弱的标志。
在本实验中发现,埋线组大鼠与假手术组相比,主要在类固醇激素生物合成、皮质醇合成与分泌、库欣综合征、糖酵解和糖异生、磷酸戊糖途径及维生素B6代谢等通路发生了显著变化,说明去卵巢大鼠之所以发生骨质疏松与以上通路密切相关。粪便中孕烯醇酮、色氨酸和胆红素等物质含量显著上调,而尿皮质醇、黄尿酸、3-hydroxy-5-pregnan-20-one、3-磷酸甘油醛及5-磷酸核酮糖等则出现下调。这些代谢物主要通过参与上述代谢通路,导致了PMOP的发生。
埋线组与模型组相比,发生显著变化的通路主要包括色氨酸代谢、类固醇激素生物合成、血小板活化、亚油酸代谢和5-羟色胺能突触等,证明这是通过埋线干预PMOP的主要通路,其主要代谢产物包括花生四烯酸和前列腺素。游离的花生四烯酸经环氧合酶途径可被催化成前列腺素和血栓素,经脂氧合酶途径可被催化成白三烯和脂氧素[31]。前列腺素和白三烯作为重要的炎性介质,可诱导激活炎症反应相关的转录因子如NF-KВ等,从而刺激破骨细胞分化形成,对骨代谢和骨折愈合产生副作用[32]。另外,花生四烯酸还可诱导成骨细胞膜上RANKL表达,通过与破骨细胞上RANK的结合而促进破骨细胞成熟、分化和激活,还可通过抑制OPG分泌而增加破骨细胞作用[33]。可见,花生四烯酸通过多种途径直接或间接地影响骨代谢,促进骨质疏松的发生。
本研究中,埋线组大鼠粪便中的花生四烯酸、前列腺素G2等代谢物含量较模型组均出现显著下调,可见穴位埋线可通过降低花生四烯酸及前列腺素等物质的含量以减少或抑制炎症反应,最终达到治疗骨质疏松的目的。
综上所述,穴位埋线可显著提高去卵巢大鼠的雌激素水平及骨密度,这种作用可能主要通过干预色氨酸代谢、类固醇激素生物合成、血小板活化、亚油酸代谢和5-羟色胺能突触等通路来实现。穴位埋线可有效纠正去卵巢大鼠的激素代谢紊乱、糖脂代谢紊乱及色氨酸代谢紊乱等情况,并可通过降低花生四烯酸及前列腺素的含量以减少或抑制炎症反应,最终达到治疗骨质疏松的目的。因而,笔者认为穴位埋线可通过干预多条代谢通路、多种途径对绝经后骨质疏松症起到预防及治疗作用,这为临床应用提供了一定的理论基础。而穴位埋线治疗PMOP的最佳时间间隔及疗程如何,则需要继续深入研究。

