虾肝肠胞虫(Enterocytozoon hepatopenaei)的研究进展
李浩澜,沈辉,顾伟,孟庆国,万夕和,乔毅,范贤平,蒋葛,李吉云
(1.江苏省海洋水产研究所,江苏 南通 226007;2.南京师范大学海洋科学与工程学院,江苏 南京 210046)
虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)是一种专性细胞内寄生的微孢子虫,属于真菌界(Fungi)微孢子虫门(Microsporidia)单倍期纲(Haplophasea)壶孢目(Chytridiopsida)肠胞虫科(Enterocytozoonidae)肠胞虫属(Enterocytozoon),是导致斑节对虾(Penaeus monodon)和南美白对虾(Litopenaeus vannamei)肝胰腺微孢子虫病(Hepatopancreatic Microsporidiosis,HPM)的病原。患病虾主要表现出白便综合症(White Feces Syndrome,WFS)及生长迟缓综合症(Monodon Slow Growth Syndrome,MSGS)等症状。该病1989 年首见于马来西亚地区半咸水土池斑节对虾养殖中,患病斑节对虾产量低下,组织学观察发现一种未知病原存在于病虾肝胰腺小管开口近端管腔[1]。2004 年Chayaburakul 等[2]在研究泰国土池养殖斑节对虾生长缓慢原因的过程中,在生长迟缓的斑节对虾肝胰腺小管上皮细胞中再次发现了该种病原,认为这是一种微孢子虫,但并不认为其与生长缓慢具有显著相关性。直到2009年Tourtip 等[3]对患生长迟缓综合症的斑节对虾进行细胞病理、组织病理及病原分子生物学研究后,首次将该未知微孢子虫鉴定为一微孢子虫新种,命名为Enterocytozoon hepatopenaei sp.Nov.,中文译为虾肝肠胞虫,简称EHP。之后全球多个对虾养殖国家和地区相继报道了该种微孢子虫。Ha 等[4]报道了越南养殖的斑节对虾感染EHP 后,生长缓慢,还伴有白便症状。Flegel 等[5]发现了与Ha 等[4]报导的相同现象,认为泰国和越南养殖的斑节对虾及南美白对虾的白便症状与一种类似EHP 的病原具有一定的关系。Tangprastittipap 等[6]报道,在泰国养殖的患白便症状以及生长迟缓的南美白对虾感染了EHP。随后,Tang 等[7]开发了快速检测EHP 技术,序列比对分析的结果显示:在泰国、越南以及中国发现的微孢子虫的18s rRNA 基因序列与先前Tourtip 等[3]上传到GeneBank 的EHP 相应序列具有96%~100%的相似性,表明这些不同地区发现的微孢子虫分子聚类上都为EHP。由此推测,在该研究前EHP 已经广泛存在于亚洲多个国家和地区。自2013年起,我国浙江省舟山地区的大棚养殖南美白对虾普遍出现生长缓慢、养殖成功率低的现象。施慧等[8]调查发现,EHP 感染率高达85.19%,经研究后初步认为EHP 就是致病原。本实验室于2016 年,在江苏省20 个南美白对虾温室养殖点共取样360 头,检测发现EHP 的感染率高达54.40%,且与生长迟缓有显著的相关性[9]。目前,EHP 已在我国、马来西亚、泰国、越南、印度尼西亚及印度等亚洲国家广泛流行并呈一定的爆发态势,尽管它不会引起较高的死亡率,但感染导致的生长迟缓造成的经济损失极其严重,因此该疾病的防治成了亟需解决的重要问题。本文简要综述了EHP 的最新相关研究成果,以期为EHP 的深入研究和防治提供参考。
1 病原学
1.1 病原分类学地位
2009 年,Tourtip 等[3]在对病原组织分布观察、超微形态观察及小亚基序列(GenBank FJ496356)比对结果的基础上,将EHP 归类为肠胞虫属中的一个新种,命名为Enterocytozoon hepatopenaei sp.Nov.。2013 年Tangprasittipa 等[6]在对表现出白便症状的南美白对虾进行病原检测过程中提交了一段核糖体小亚基序列(KF362130)与Tourtip 等[3]提交的序列相似性达99%。随后,GenBank 公布了来自越南(KP759285)和中国(KP027539)[7]EHP 的核糖体小亚基序列,同源性达96%~100%,表明目前分离到的EHP 为同一物种。
1.2 形态结构
Tourtip 等[3]将生长迟缓的对虾的肝胰腺进行涂片,H&E 染色后,在光学显微镜下清晰可见孢子(图1)。EHP 孢子为专性细胞内寄生,长径0.9~1.3 μm,短径0.4~0.8 μm。在透射电显镜下可观察到其孢子壁由3 层结构组成,由外向内依次为:电子致密的孢子外壁(2 nm)、电子透明的孢子内壁(10 nm)以及原生质膜,原生质膜将孢子壁与孢原质隔开。成熟的孢子外形呈椭圆形或梨形,包含一个核,5~6 圈盘绕的极丝,一个后极泡及锚定盘,锚定盘与极丝相连(图2)。

图1 斑节对虾肝小管上皮细胞中肝肠孢虫的显微图像[3]Fig.1 Photomicrographs of parasite Enterocytozoon hepatopenaei in tubule epithelial cells of the hepatopancreas of tiger shrimp Penaeus monodon
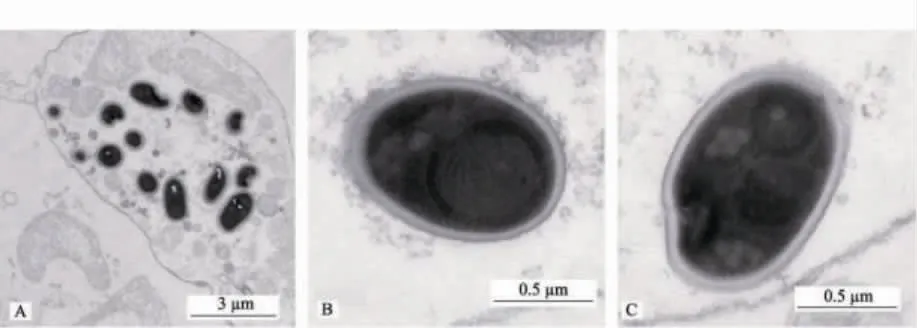
图2 EHP 孢子透射电镜观察结果[10]Fig.2 Transmission electron microscopy of EHP spores
2 流行病学
2.1 研究历史和地理分布
1989 年马来西亚首次报道了虾生长迟缓症,尽管在该报道中未明确该病症的致病原,但在对肝胰腺组织病理学研究中发现了一种具有典型厚壁特征的单细胞微孢子,疑似微孢子虫[1]。21 世纪初,泰国斑节对虾养殖业因对虾生长迟缓综合症的大面积爆发遭受了严重的经济损失。泰国学者Chayaburakul 等[2]在表现出生长迟缓症状的对虾体内发现了多种病原,包括病毒、细菌以及该种未知孢子,但并未讨论其与生长迟缓之间的关系,认为该病仍然是某种未知的、潜在的病原造成。直至2009 年Tourtip 等[3]对引起泰国斑节对虾生长迟缓的病原进行分类鉴定,初步揭开了EHP 感染引起对虾生长缓慢的病理学及病原学机制。随后,越南、印度和中国相继报导了EHP 感染引起的斑节对虾或南美白对虾的生长迟缓现象[4,7,11]。刘珍等[12]对实验室保存的样品进行EHP 检测,发现日本囊对虾(Penaeus japonicus)、南美白对虾以及罗氏沼虾(Macrobrachium rosenbergii)样品中均检测出该病原,由此推测EHP 在更早的时期就已在我国出现并传播。
有研究表明,造成EHP 在东南亚对虾主要养殖国家流行的主要原因有以下几点:首先,全球对虾亲体、苗种和成虾的贸易日趋频繁,造成了病原传播与感染,在亚洲对虾主要养殖国家和地区尤为突出[13];其次,对虾的高密度养殖模式增加了EHP 传染机率;再者,EHP 的典型结构孢子壁抗逆性强,能在一环境条件下休眠和萌发,具有长期传播与流行的能力[14]。目前已研究报道的感染地区、感染品种及主要表观现象如表1。

表1 EHP 流行情况的研究报道Tab.1 The reporting of prevalence of EHP
2.2 主要宿主
早期研究表明,EHP 主要感染斑节对虾,引起对虾生长迟缓症,严重冲击了泰国斑节对虾养殖业。一度在原有池塘条件下改养南美白对虾,虽在当年取得了成功,但随后发现南美白对虾同样会感染EHP,导致生长缓慢。随后开展了关于EHP 宿主的研究,发现除了斑节对虾、南美白对虾以及细角滨对虾(Litopenaeus stylirostris)[7]外,一些如多毛类、软体类以及卤虫等活体饵料中也检测出了EHP[7,13]。刘珍等[12]用PCR 法在实验室保存的其他对虾样本中也检测出EHP 阳性,但EHP 阳性的物种仅是携带EHP 孢子,还是作为宿主被其感染目前仍不明确。因此,EHP 最主要感染胁迫宿主为斑节对虾与南美白对虾,这一观点目前被业界广泛接受。
2.3 流行季节及传播途径
EHP 的孢子壁结构使其对环境胁迫具有很强的耐受能力,即使离开了宿主进入环境中也能够存活相当长的一段时间。有报道称,某些微孢子虫的孢子在不同温度条件下,在盐度30 的人造海水中仍能保持感染力,最短2 周,最长可达12 周[14]。当环境条件适宜,如养分、温度、pH、离子浓度的变化等,强光照或者过氧化物等极端的理化条件均可促使孢子萌发而具感染性[17]。本实验室对江苏南美白对虾主要养殖地区的实地考察(图3)发现,在一年两季,甚至因具备供暖条件而发展出的一年三季的养殖周期中,均存在EHP 流行,即春夏、秋冬过渡以及隆冬时节。因此,可以初步推断,EHP 在一年中的任何季节均可爆发、流行。
图3 江苏地区部分南美白对虾养殖区域分布[18]Fig.3 Partial cultivation areas distribution of Litopenaeus vannamei in Jiangsu province
自EHP 被发现以来,对其传播方式开展了大量的研究。Tang 等[7]在EHP 原位杂交与PCR 检测技术过程中,感染虾的粪便与水样均出现阳性结果;将阳性虾的肝胰腺组织投喂健康虾以及将感染虾与健康虾共栖,投喂及共栖后,健康虾的检测结果都呈阳性。由此表明,EHP 能够经过口饲与共栖进行水平传播[15]。Salachan 等[19]对共栖实验进行了一定的设计与优化,利用塑料网箱将EHP 阳性虾与健康虾物理隔离,经过一段时间的共栖,健康虾转为阳性,由此进一步证实EHP 可以水平传播,初步推测病虾通过粪便从消化道将EHP 的孢子排出体外,进入水环境,健康虾通过摄入环境中的孢子而被感染。在垂直传播研究中,Vu-Khac 等[20]设计了亲虾共栖感染实验,发现与感染EHP 亲虾共栖的健康亲虾及其产出的虾苗,PCR 检测均呈阳性,证实了EHP 能够水平传播的同时,也能够进行亲代、子代间的垂直传播。这种传播特性给EHP 的防控提出了更高的要求,对其监测不能仅局限于养殖环节,还需要覆盖到苗种生产环节。
微孢子虫的发育大致历经三个阶段:感染期、裂殖增殖期以及孢子增殖期,只有成熟孢子阶段才具备感染能力[21]。关于包括EHP 在内的微孢子虫可能的侵染机制,目前主要有两种假设:其一,微孢子虫孢子萌发,极丝弹出穿刺宿主细胞质膜后成为极管,将孢原质注入宿主细胞中完成感染;其二,微孢子虫孢子萌发后,将孢原质经过萌发而成的极管排出孢子外,孢原质被宿主细胞吞噬完成感染。然而微孢子虫的感染无论是以何种方式进行,都必须首先完成孢子与宿主细胞的识别与结合,或是孢壁蛋白与宿主细胞质膜的互作,又或是极管蛋白与宿主细胞质膜的互作,这也是当下微孢子虫研究的热点。目前,在微孢子虫研究领域,已完成了包括兔脑炎微孢子虫(Encephalitozoon cuniculi)、肠道脑炎微孢子虫(Encephalitozoon intestinalis)、海伦脑炎微孢子虫(Encephalitozoon hellem)以及家蚕微孢子虫(Nosema bombycis)在内的多种微孢子虫的多种孢壁蛋白以及极管蛋白的鉴定[22]。目前已在EHP 中鉴定出一种孢壁蛋白EhSWP1[23]。上述这些已鉴定的孢壁蛋白与极管蛋白,其中一部分的大致结构和功能已经确定,但是包括EhSWP1 在内的新近鉴定的孢壁蛋白、极管蛋白在微孢子虫的侵染过程中的作用机制还不清楚,还有待于进一步研究与探索。
3 病理学
3.1 发病症状与潜伏感染
对虾感染EHP 后不会引起明显的死亡,患病对虾消化吸收功能受阻,摄食减少,甚至停止摄食,终致生长迟缓甚至停滞,甲壳软化,品质远低于正常对虾。EHP 感染还会导致对虾免疫力下降而继发感染其他病原。如感染EHP 的对虾更容易感染杆菌、弧菌等病原及对虾急性肝胰腺坏死病(Acute hepatopancreatic necrosis disease,AHPND)、败血性肝胰腺坏死病(Septic hepatopancreatic necrosis,SHPN)等疾病[3,24,25]。Ha 等[4]在研究南美白对虾感染EHP 时发现,对虾出现白便现象。随后,Tangprastittipap等[6]从排白便的南美白对虾中也检测出EHP,但通过巢式PCR 及原位杂交实验分析发现,两者之间并没有显著的相关性。Sriurairatana 等[26]研究发现,患急性肝胰腺坏死综合症(AHPND)的南美白对虾同样也会出现白便症状,即白便并不是EHP 感染的特有症状。光学及电子显微镜观察发现,白便细微结构呈蠕虫状,是肝胰腺小管上皮微绒毛脱落、折叠并聚集之后形成的。EHP 同其他细胞内寄生病原一样,繁殖过程中会导致宿主靶细胞裂解,靶组织坏死脱落,脱落的肝小管上皮细胞进入消化道随粪便排出体外,外观呈白色,其主要组分实际是坏死脱落的细胞与组织。EHP 的感染还具有潜伏性。本实验室于2015—2017 年对江苏近3 000 份南美白对虾苗种样品进行EHP 的检测后发现,其感染率约为18.90%,表明南美白对虾苗种阶段已达到较高的EHP 感染率(尚未发表)。养殖初始,EHP 阳性的虾苗未表现出明显症状,25 d 后开始厌食、肝胰腺颜色变浅、健康状态恶化以及生长缓慢[7],表明EHP的感染具有一定的潜伏期。
3.2 病理变化
Tourtip 等[3]首次研究了感染EHP 斑节对虾的组织学及细胞病理学,发现EHP 孢子呈嗜酸性结构且限定在肝胰腺小管上皮中的R、B 及E 细胞的细胞质中,包括孢原质、裂殖体、孢子母细胞及成熟孢子这几个不同的发育阶段。同属肠孢虫属的毕氏肠孢虫(Enterocytozoon bieneusi)为感染寄生人类等脊椎动物消化道上皮细胞的微孢子虫,能引起宿主的严重腹泻,与EHP 的孢子一样,均存在于细胞质中并与之直接接触,导致上皮细胞坏死脱落,影响宿主消化吸收,造成宿主营养不良、生长缓慢、消瘦等病症[9,27]。EHP 的寄生表现出一定的组织特异性,目前大多数研究报道称仅在肝胰腺中发现。但Tang等[15]通过组织病理学研究发现,南美白对虾的中肠上皮细胞也可被EHP 感染,是EHP 首次感染非肝胰腺组织的报道。骆云慧等[28]利用分子生物学方法在患病对虾的肝胰腺及肠道中检测到EHP 阳性。Santhoshkumar 等[29]利用分子生物学方法在感染了EHP 并表现出明显生长迟缓的南美白对虾肝胰腺、心脏与肠道中检测出了明显的阳性条带,在血淋巴与鳃中有轻微的条带,在腹部与尾部的肌肉中有非常模糊的条带,但组织病理学分析只在肝胰腺与肠道中发现了EHP 孢子,孢子在上皮细胞的细胞质中呈现出嗜碱性结构以及不同的发育阶段。Biju 等[30]研究了印度感染EHP 的斑节对虾的组织病理学,发现孢子同样呈现嗜酸性结构且限定在细胞液泡内,但在中肠或后肠的上皮细胞中未发现孢子。
EHP 主要感染南美白对虾肝胰腺,在肝小管上皮细胞中呈嗜碱性结构。这些结构主要分布在肝胰腺远端的肝小管内,呈现出孢原质、裂殖体、孢子母细胞及成熟孢子等发育阶段及形态[7],且此区域内的小管上皮细胞基底膜分离,血窦增大。在多数情况下,感染EHP 早期,对虾组织及细胞不表现出明显的病理变化,甚至在分子生物学检测为严重感染的情况下,病虾的肝胰腺组织也未出现显著的病理变化。EHP 的病原变化特征与寄生于三疣梭子蟹(Portunus trituberculatus)肌细胞中的梭子蟹肌孢虫(Ameson portunus)的病理变化差异明显,随感染时间的延长,梭子蟹肌细胞白浊变化肉眼可辨,且伴随着白色点状病灶的出现[31]。
4 检测
4.1 组织病理学
EHP 寄生的靶组织为肝胰腺,在相差显微镜下涂片可以直接观察到EHP 孢子[3]。为了更直观地观察孢子,涂片后可进行H&E、吉姆萨或甲苯胺蓝等染色。乔毅等[10]使用荧光增白剂染色,能快速、清晰地辨别涂片样本中是否存在孢子。组织病理学检测可以观察到EHP 孢原质体、裂殖体、成孢子母细胞、成熟孢子等各个发育阶段的形态,可以直观地展示出EHP 侵染及组织病理变化。Gao 等[32]使用荧光增白剂及吖啶橙双染色,能够显著区分不同发育阶段的EHP,在孢子染色过程中吖啶橙呈橙红色还能表明此阶段的孢子细胞具有转录活性。Salachan 等[19]研究发现,核酸扩增或原位杂交检测为强阳性时,组织病理学观察却未发现明显的变化或未见孢子感染。这主要是因为组织病理学的操作过程繁琐、操作周期长且检测灵敏度低,容易出现漏检,目前仅作为基础性的检测手段。
4.2 分子生物学
聚合酶链式反应(Polymerase chain reaction,PCR)应用范围广泛,灵敏度和特异性良好。该技术及其延伸技术是病原检测的常用手段。自Tourtip 等[3]以毕氏肠胞虫核糖小亚基序列设计了一对引物,扩增出一段848 bp 的序列片段并提交至Genbank(FJ496356)以来,研究者们相继设计了一系列的引物来扩增EHP 的目的基因(表2)。Tangprasittipap等[6]研究发现,原位杂交显示为轻度感染的情况下,巢式PCR 表现出更强的检测灵敏性。现已报道的分子检测方法中,主要以SSU 18S rRNA 基因为目的基因设计引物。Jaroonlak 等[33]研究发现,针对SSU 18S rRNA 基因设计的引物容易与其他能够感染水生动物且与EHP 亲缘关系较近的微孢子虫的DNA发生交叉反应,造成假阳性,因此提出了以EHP 的孢壁蛋白(SWP)为模板设计的巢式PCR 引物,具有更高的灵敏度与更好的特异性。Han 等[34]根据生物进化过程中极具保守性的β 微管蛋白设计的EHP-β-tubulin 巢式PCR 引物,同样比SSU 巢式PCR 具有更高的灵敏度与特异性。

表2 扩增EHP 目的基因的引物序列Tab.2 The primer sequence for amplifying EHP target genes
为了进一步探索EHP 与生长缓慢之间的拟合关系,进行了EHP 基因的定量技术研发。刘珍等[12]建立了SYBR Green I 实时荧光定量PCR 检测方法,其检测灵敏度比巢式PCR 高4 倍以上。还发现EHP 的载量与对虾生长速率呈显著负相关性,初步证实了EHP 的感染确实会导致对虾生长缓慢。骆云慧等[28]建立了TaqMan 实时荧光定量PCR 的检测方法,其灵敏度与特异性表现较优于SYBR Green I实时荧光定量PCR。
近年来,基于快速、低成本,简便易操作性的原则,也开发了多种检测手段,如环介导等温扩增(Loop-mediated isothermal amplification,LAMP)。孙妍等[35]根据EHP SSU 18S rRNA 基因基因序列设计了6 对引物,成功建立了EHP-LAMP 检测方法。该方法最低检测限度为3.71 个质粒拷贝/μL,不会与对虾其他常见病原发生交叉反应,表现出良好的灵敏度与特异性。陈进会等[36]根据EHP SSU 18S rRNA基因保守序列设计了4 对引物,建立了LAPM检测方法,再不与其他对虾病原交叉反应的同时最低可检测出10 fg/μL 的质粒DNA,同样具有良好的灵敏度与特异性,反应装置要求低,操作与结果观察简单,非常适合生产一线使用。在此基础之上,也有其他研究者建立了各有特色的LAMP 技术。Suebsing 等[37]将LAMP 与纳米金颗粒结合增强了反应结果的可视化特性,仅通过肉眼观察颜色的变化即可判断检测的结果。Kumar 等[38]将LAMP 与SYBR Green I 荧光染料结合,在紫外光照下可散发出荧光,增加特异性的同时也兼顾了结果的可视性。
重组酶介导核酸扩增(Recombinase-aid-amplification,RAA)也是近年来新兴的一种检测手段,在能保证良好的灵敏度与特异性基础上,除了具有的操作简单快速、成本低廉的特点外,节能、便携是其亮点。黄纪徽等[39]根据EHP SSU 18S rRNA 基因保守序列设计并合成了引物和探针,建立了在37℃下快速检测EHP 的RAA 恒温荧光检测方法,不需要高温循环,检测的最低限为10 个质粒拷贝/μL,且不与其他虾病病原交叉互反,灵敏度与特异性表现良好。
4.3 原位杂交
原位杂交(In situ hybridization,ISH)在EHP 研究中常为一种辅助手段,以进一步确认组织切片和PCR 检测的结果。Tangprasittipap 等[6]研发了地高辛标记探针检测EHP 的方法,在具有白便症状的对虾肝胰腺常规组织病理检测未显示孢子的情况下,利用地高辛标记的探针检测发现了大量EHP 孢子,表明该方法具有更好的灵敏度。Tang 等[7]应用地高辛标记探针处理感染EHP 的南美白对虾、细角滨对虾和患有“棉花虾病”的斑节对虾的组织切片行。结果表明该探针不与引起棉花虾病的微孢子虫发生反应,也不与一些水生动物的基因组DNA 反应,特异性表现不俗。Biju 等[30]及Rajendran 等[11]以ENF 779F/ENF779R 为引物探针,检测了PCR 阳性样品的组织切片,该引物探针同样表现出较好的灵敏度与特异性。Ahmed 等[41]利用原位杂交技术成功检测出了以往难以发现和确诊的金头鲷(Sparus aurata)肠道粘孢子虫(Enterospora nucleophila),结合卡尔科弗卢尔荧光增白剂(Calcofluor White Stain),清晰地显示了肠道粘孢子虫的发育阶段与侵染组织,说明原位杂交技术良好的灵敏度与特异性能够在组织层面直观展示病原感染的位置与程度,也能揭示出病原侵染的具体路径。截止目前,研究EHP 感染的组织分布主要都集中在对虾肝胰腺,EHP 在对虾体内其他组织是否也有分布,或是否存在一个具体的感染路径,相关研究还较为缺乏,甚至还未见有报道。
5 防治措施
EHP 具有几丁质的孢子壁,抗逆性较强,常规药物很难穿透孢子壁杀灭孢子,截止目前未见有明确药物可杀灭EHP 的报道。Tang 等[15]发现对控制微孢子虫有一定作用的烟曲霉素无法消除或削弱EHP 感染。目前,主要从增强免疫调控、环境等角度来探索EHP 的防治措施。Palanikumar 等[42]利用从柠檬、大蒜、生姜、糖棕以及黑吉豆等植物中提取的物质如维生素C、蒜素、生姜素、棕榈糖及黑吉豆粉以辅助强化南美白对虾的体质,增强其消化吸收、抗氧化、抗菌、抗炎症能力,在一定程度上抵消EHP感染带来的不利影响。徐胜威等[43,44]发现,当氨氮浓度在9 mg/L 时,相较于空白对照组以及实验组6 mg/L,对虾增长率最高,小虾比例明显下降;亚硝酸盐浓度在10 mg/L 时,相较于空白对照组以及实验组20 mg/L,感染对虾的生长率有所增加,EHP 携带量显著降低,表明一定浓度的氨氮与亚硝酸盐的胁迫,能抑制EHP 的感染,推测是EHP 孢子生长发育所需ATP 直接来源于对虾肝胰腺组织细胞,氨氮与亚硝酸盐的胁迫在一定程度上损伤对虾肝胰腺,减少EHP 孢子生长发育所需ATP 的获得量,一定程度上抑制了其感染与传播。
在养殖生产中,无论是添加植物提取物佐剂,还是采用环境胁迫的方式,虽然能产生一定的效果,但是仍然无法完全排除对虾养殖系统中EHP 感染的影响,治标不治本。鉴于目前尚无有效的治疗药物及手段,EHP 的防治措施重心将长期偏向防控,而病原检疫则是防控的关键。检疫能够尽早发现EHP,最大限度减少EHP 感染造成的损失,检测对象应包括亲虾、虾苗、饲料以及养殖环境。从整个产业链条来看,首先,从源头进行把控,应选择无特定病原(Specific pathogen free,SPF)亲虾,防止EHP垂直传染给苗种。其次,做好苗种检疫,苗种检疫以确保无EHP 携带防止水平传播[13]。再者,切断传播途径,对养殖环境消毒与检测,包括养殖设施、养殖用具、养殖水等,以防止环境中EHP 孢子残留造成的水平传播。而后,还不能忽视饵料可能存在的问题。有报道指出,从养殖用的如卤虫、多毛类、软体类等生物饵料中检出EHP[7,13,15],因此使用前应做好病原检测,避免使用EHP 感染或污染的生物饵料。EHP 的孢子会随虾的粪便排出体外,进入水体并沉积到养殖池底质中[15],需要有效清理、消毒和检测养殖水、底质,养殖尾水同样需要消毒后检测以确保其安全无污染才可进行排放。本实验室于2019年调查研究了江苏主要养殖地区EHP 的发生,发现温室养殖模式对EHP 传播的限制作用强于传统的土池养殖模式。温室养殖单独成棚的特性在一定程度上限制了EHP 的水平传播,且能单独配给水源,管理用水循环,模块化的养殖特点也避免了病原感染一损俱损的恶性局面[18]。
EHP 的灭活长期以来一直是生产实践中的难题,常规手段效果有限。Aldama-Cano 等[17]在研究理化因素对EHP 活力影响的过程中,发现EHP 孢子对极端低温非常敏感,-20℃冷冻2 h 以上可完全抑制EHP 孢子的萌发;使用40 mg/L 65%的活性氯、15 mg/L KMnO4以及20%的乙醇分别处理15 min 以上均可100%抑制EHP 的活性。上述条件在生产实践中具有非常好的应用前景,可以用来消毒具有化学惰性表面的养殖设施及用具。低温冷冻则可以用于鲜活饵料的EHP 灭活,采用-20℃以下且持续24 h 以上的冷冻处理鲜活饵料可以灭活包括EHP在内的大部分病原[17,45]。还可以将饵料冷冻后进行放射性射线照射杀灭病原,这更适用于大规模的现代化养殖[13]。最后,由于EHP 在感染对虾前是否存在其他中间宿主目前仍不清楚,参考引起斑节对虾“棉花虾”病的对虾八孢虫(Agmaosma penaei)的应对方式,应避免对虾与其他水生动物混养,从根本上排除这个可能性[13]。
6 展望
目前EHP 生理结构、组织病理、传播机制以及检测防控技术等已有一定的研究,但是,对EHP 生活史、详细侵染机制等还未作详细阐释。后续的研究焦点应主要集中在以下方面:(一)EHP 生活史,阐释其发育生理学特点;(二)EHP 侵染的分子机制,探索其孢壁蛋白、极管蛋白与宿主细胞识别相关的作用机制;(三)EHP 与关键环境因子之间的互作关系,以期发现其重要作用因子,为EHP 的防治提供技术支撑。

