CaCO3@SiO2的制备及其壳层SiO2生长动力学分析
朱天孝,徐林冲,朱 勇,白丽娟,袁爱群,黄增尉
(1. 广西民族大学 化学化工学院,广西 南宁 530006;2. 广西华纳新材料科技有限公司,广西 南宁 530103)
碳酸钙(CaCO3)是一种物美价廉的填料,可用于塑料、橡胶、造纸、涂料、油墨等行业。随着材料多样化需求的增多,超细化、纳米化CaCO3具备了良好的流变性、触变性以及优异的机械性能;通过CaCO3的表面进行改性则可以改善其分散性,提高吸油值等指标[1-2];复合改性形成的CaCO3复合物更加稳定,更能突出材料的增韧、补强性能,拓宽了CaCO3的应用[3-6]。
无论是CaCO3还是超细或纳米CaCO3,其耐酸性均较差,易溶解在稀硝酸、稀盐酸或醋酸中,致使其无法适用于特殊条件下的涂料和造纸行业,从而限制了CaCO3的应用。
一些专利技术采用铝盐、硅酸盐、磷酸盐、钡盐等对CaCO3进行表面处理,以解决CaCO3耐酸性较差的问题[7-8]。丁士育等[9]以硬脂酸改性纳米CaCO3,在颗粒表面形成有机包覆层,从而改善了CaCO3的耐酸性。余宽亮[10]以苯乙烯-丙烯酸为包覆剂,制备出在强酸性(pH为2)环境中耐酸率可达到65%的CaCO3-SAA微胶囊。
近年来以核-壳包覆技术形成的CaCO3核-壳材料不仅改善了耐酸性,还改善了吸油值、白度等指标。盛野[11]以钛酸四丁酯、硅酸钠作为壳层原料对CaCO3进行表面包覆,制备了CaCO3@SiO2和CaCO3@TiO2核-壳材料,提高了CaCO3的耐酸性、白度。马翠翠等[12]在纳米CaCO3的制备过程中加入硅酸钠,获得了耐酸性的核-壳结构CaCO3@SiO2复合粒子。赵兴等[13]采用溶胶-凝胶法以正硅酸乙酯为原料,在CaCO3颗粒表面包覆SiO2,得到CaCO3@SiO2复合粒子,其酸溶率仅为未包覆的1/4。Li 等[14]在CaCO3表面包覆TiO2,测试结果表明材料的热稳定性和耐酸性能均优于未包覆的CaCO3。
迄今为止,市场上国产的耐酸型CaCO3产品尚未见有售,其工业化进程仍有很多问题尚未解决。虽然已经有些文献报道了改进CaCO3耐酸性的办法,但是对于产物的耐酸性指标(比如酸溶率)均在25%以上,因此,需要通过优化工艺条件来降低产品酸溶率,并深入研究核-壳结构中的壳层生成过程。
本文中以重质CaCO3为核,以硅酸钠为壳层硅源,以并流法制备CaCO3@SiO2核-壳结构材料,采用单因素控制实验法探究反应温度、反应时间、pH、CaCO3初始质量浓度、SiO2质量分数、陈化时间、搅拌速率7个因素对核-壳结构耐酸性的影响,对工艺参数进行优化,降低产品的酸溶率,提高CaCO3耐酸性能;探究不同pH条件下SiO2壳层的生长规律,为耐酸型CaCO3材料的研究和推广应用提供参考。
1 实验
1.1 材料及仪器
CaCO3为工业级重钙产品,六偏磷酸钠、硅酸钠、稀硫酸、邻苯二甲酸氢钾、氢氧化钠为分析纯试剂。
仪器:Smartlab型XRD衍射仪(日本理学公司)、SUPRA 55 Sapphire型场发射扫描电子显微镜(德国卡尔蔡司公司)、OXFORD X-MAX N 51-XMX1004型能谱仪(德国卡尔蔡司公司)、JEM-2100F透射电子显微镜(日本电子株式会社公司)、ESCALAB 250Xi型X射线光电子能谱仪(美国赛默飞世尔科技有限公司)和Magna-FT-IR550Ⅱ型傅里叶变换红外光谱仪(美国尼高力仪器公司)。
1.2 方法
将CaCO3加入去离子水中打浆;加入含CaCO3质量分数为0.3%的六偏磷酸钠;加热至设定温度,滴入硅酸钠溶液的同时滴入稀硫酸溶液(物质的量浓度均为0.1 mol/L),并保持pH在一定范围内;反应结束后,经陈化、过滤、洗涤,于150 ℃下干燥、研磨,得到核-壳结构CaCO3@SiO2产品。
1.3 酸溶率的测试
量取125 mL邻苯二甲酸氢钾、97 mL氢氧化钠溶液(浓度均为0.1 mol/L),定容至500 mL,配成缓冲溶液(pH为5~6),从中取出100 mL缓冲溶液,分别加入0.2 g的CaCO3@SiO2,每次间隔0.5 h取样4次,2 h后再以2 h为间隔取样2次,共6次,取样过滤后用滴定法测定滤液中Ca2+的质量浓度,计算出溶解CaCO3的质量,酸溶率Y的计算公式为
(1)
式中:M1为CaCO3溶解的质量,g;M0为溶解前CaCO3的质量,g。
2 结果与讨论
2.1 工艺参数对CaCO3@SiO2酸溶率的影响
2.1.1 pH
当CaCO3初始质量浓度为100 g/L、反应温度为70 ℃、反应时间为30 min、SiO2质量分数为3%、搅拌速率为250 r/min 、陈化时间为24 h时,不同pH条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线如图1所示。
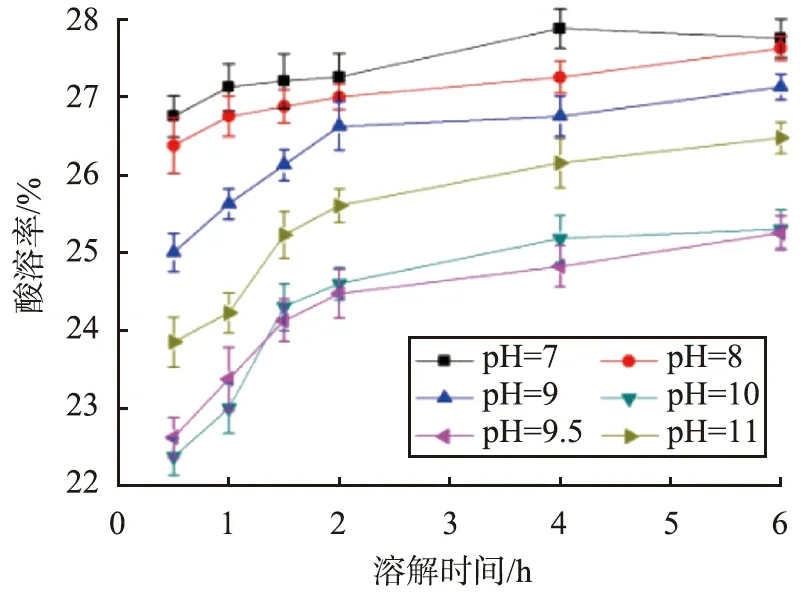
图1 不同pH条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线Fig.1 Relationship curves between acid solubility of CaCO3@SiO2 and dissolution time under different pH conditions
由图1可见,在同样的溶解时间条件下,当pH为9.5~10时,CaCO3@SiO2酸溶率最小。以CaCO3、硅酸钠为原料制备具有核-壳结构的CaCO3@SiO2发生的化学反应式为
Na2SiO3+H2SO4+(n-1)H2O= SiO2·nH2O↓+Na2SO4。
(2)
当pH小于9.5时,硅酸钠和硫酸反应生成原硅酸,易自相成核发生聚合,形成硅酸聚合物,与CaCO3颗粒表面键合后形成疏松的海绵状团聚物,致使壳层致密性、均匀性降低;当pH大于10时,生成的原硅酸易被中和,也会使得CaCO3表面壳层的致密性下降,导致CaCO3@SiO2酸溶率增大;而pH在9.5~10之间时,硅酸能稳定地与CaCO3表面作用形成一层均匀连续的壳层,因此,最佳pH为9.5~10。
2.1.2 反应温度
当pH为9.5、CaCO3初始质量浓度为100 g/L、SiO2质量分数为6%、反应时间为120 min、搅拌速率为250 r/min、陈化时间为36 h时,不同反应温度条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线如图2所示。
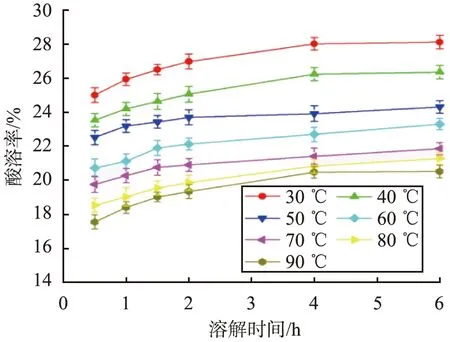
图2 不同反应温度条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线Fig.2 Relationship curves between acid solubility of CaCO3@SiO2 and dissolution time under different reaction temperature conditions
由图2可见,在同样的溶解时间条件下,CaCO3@SiO2酸溶率随着反应温度的升高而降低;反应温度为90 ℃时CaCO3@SiO2酸溶率最低。这是因为,反应温度较低时,硅酸钠与硫酸的反应速度慢,生成硅酸的速率慢,键合作用受到影响,易于形成多孔疏松的壳层;反应温度较高时,粒子之间的碰撞机会增加,布朗运动加快,缩短了壳层形成时间,使得壳层均匀、致密,CaCO3@SiO2酸溶率因而降低,因此,最佳反应温度为90 ℃。
2.1.3 CaCO3初始质量浓度
当反应温度为70 ℃、反应时间为30 min、pH为9.5、SiO2质量分数为3%、搅拌速率为250 r/min、陈化时间为24 h时,不同CaCO3初始质量浓度条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线如图3所示。
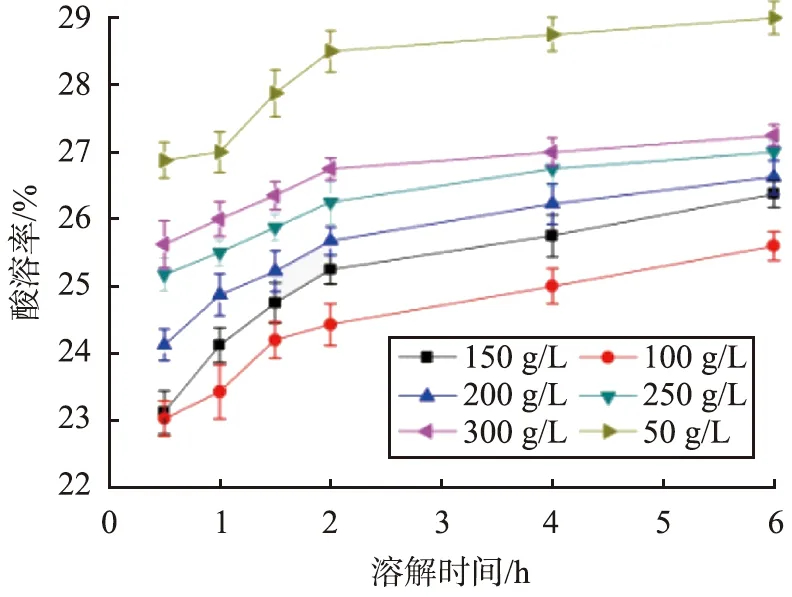
图3 不同CaCO3初始质量浓度条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线Fig.3 Relationship curves between acid solubility of CaCO3@SiO2 and dissolution time under different initial concentration of CaCO3 conditions
由图3可见,在同样的溶解时间条件下,当CaCO3初始质量浓度低至50 g/L时,CaCO3@SiO2酸溶率与CaCO3的较为接近,而CaCO3初始质量浓度增大至100 g/L时,CaCO3@SiO2酸溶率降低到最小值,之后CaCO3初始质量浓度继续增大时,CaCO3@SiO2酸溶率反而增大。这是因为,CaCO3初始质量浓度较低时,原硅酸生成的速率大于异相沉积速率,硅酸处于过饱和度状态,使得SiO2趋于自身成核,无法沉积到CaCO3表面,因此CaCO3@SiO2酸溶率较大;当质量浓度为100 g/L时,此时溶液黏度正好,硅酸与CaCO3粒子之间的碰撞机会增大,有利于沉积,CaCO3@SiO2酸溶率减小;继续增大CaCO3初始质量浓度,CaCO3浆液黏稠度增大,分散性变差,影响了硅酸与CaCO3的化学键合,进而无法形成连续、致密的壳层,使得CaCO3@ SiO2酸溶率增大,因此,CaCO3的最佳初始质量浓度为100 g/L。
2.1.4 反应时间
当CaCO3初始质量浓度为100 g/L、反应温度为70 ℃、pH为9.5、SiO2质量分数为6%、搅拌速率为250 r/min 、陈化时间为24 h时,不同反应时间条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线如图4所示。由图4可见,在同样的溶解时间条件下,随着反应时间的增加,CaCO3@SiO2酸溶率逐渐降低。这是因为,硅酸钠有充足的时间与硫酸反应,保证了原硅酸与CaCO3的化学键合,而反应时间较短时,容易自身成核,与CaCO3发生键合的时间不足,壳层不连续而导致酸溶率较差;随着时间增加,化学键合时间充分,壳层更均匀、紧密,CaCO3@SiO2酸溶率更低;当反应时间为120 min时,CaCO3@SiO2酸溶率最小,继续增加反应时间也变化不大。

图4 不同反应时间条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线Fig.4 Relationship curves between acid solubility of CaCO3@SiO2 and dissolution time under different reaction time conditions
2.1.5 SiO2质量分数
当反应温度为70 ℃、pH为9.5、CaCO3初始质量浓度为100 g/L、反应时间为30 min、搅拌速率为250 r/min、陈化时间为24 h时,不同SiO2质量分数条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线如图5所示。

图5 不同SiO2质量分数条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线Fig.5 Relationship curves between acid solubility of CaCO3@SiO2 and dissolution time under different mass fraction of SiO2 conditions
由图5可见,在同样的溶解时间条件下,随着SiO2质量分数的增大,CaCO3@ SiO2酸溶率逐渐减小。原因在于,SiO2与CaCO3颗粒表面之间除了简单的物理吸附作用以外,更多的是CaCO3颗粒表面存在的羟基易与硅酸化学键合成更为牢固的Si—O—Ca键,易于形成均匀、致密的壳层。当加入SiO2的质量分数逐渐增大时,生成的壳层越厚实,减小了颗粒裸露的面积,CaCO3@SiO2酸溶率随之降低,从壳层厚度综合考虑,SiO2最佳质量分数为6%。
2.1.6 搅拌速率
当反应温度为70 ℃、反应时间为30 min、pH为9.5、CaCO3初始质量浓度为100 g/L、SiO2质量分数为3%、陈化时间为24 h,不同搅拌速率条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线如图6所示。由图6可见,在同样的溶解时间条件下,搅拌速率较低时,原硅酸与CaCO3颗粒表面接触机会少,壳均匀性较差;当搅拌速率大于300 r/min时,CaCO3@SiO2酸溶率仍较差,这是因为搅拌速率过大会破坏原硅酸与CaCO3之间的键合力,硅酸不易在CaCO3颗粒表面形成致密层,CaCO3@SiO2酸溶率因而增大。当搅拌速率为250 r/min时,适合硅酸的扩散及键合作用,CaCO3@SiO2酸溶率最高,因此,最佳搅拌速率为250 r/min。

图6 不同搅拌速率条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线Fig.6 Relationship curves between acid solubility of CaCO3@SiO2 and dissolution time under different stirring speed conditions
2.1.7 陈化时间
当反应温度为70 ℃、反应时间为120 min、pH为9.5、CaCO3初始质量浓度为100 g/L、SiO2质量分数为6%、搅拌速率为250 r/min时,不同陈化时间条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线如图7所示。
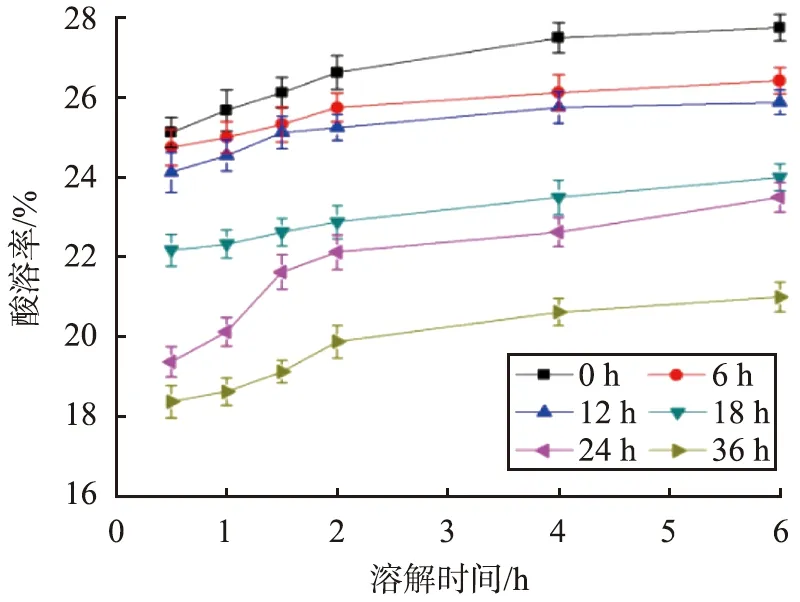
图7 不同陈化时间条件下CaCO3@SiO2酸溶率与溶解时间的关系曲线Fig.7 Relationship curves between acid solubility of CaCO3@SiO2 and dissolution time under different aging time conditions
由图7可见,在同样的溶解时间条件下,随着陈化时间的增加,CaCO3@SiO2酸溶率呈现减小趋势;当陈化时间增加至36 h时,CaCO3@SiO2酸溶率最低。这是因为,陈化时间较长时,硅酸与CaCO3化学键合的时间更充分,有利于SiO2粒子长大,使壳层更均匀、致密,酸溶率更低。综合考虑,最佳陈化时间为36 h。
2.1.8 平行实验
在单因素实验基础上,选取较优条件,设定反应温度为90 ℃、反应时间为120 min、CaCO3初始质量浓度为100 g/L、pH值为9.5~10、SiO2质量分数为6%、陈化时间为36 h、搅拌速率为250 r/min,进行5组平行实验,制备的CaCO3@SiO2酸溶率分别为17.56%、17.95%、18.05%、17.82%、18.21%,平均为17.92%。
2.2 CaCO3@SiO2的测试与表征
2.2.1 XRD分析
图8所示为CaCO3和CaCO3@SiO2的XRD谱图。经比对,CaCO3在2θ值为23.02°、29.40°、35.97°、39.40°、43.15°时的特征峰与JCPDS:26-0575方解石型CaCO3一致,分别对应着(012)、(104)、(110)、(113)、(202)晶面,而CaCO3@SiO2的衍射峰与CaCO3几乎相同,说明二者晶型相同,未看到SiO2的特征峰,说明壳层SiO2呈无定形且含量较少。
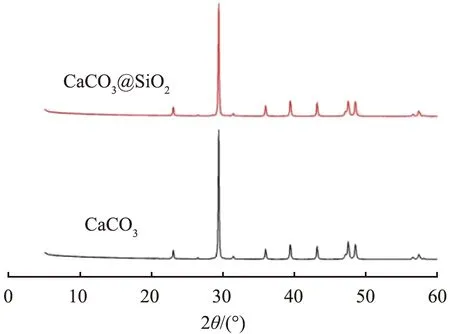
图8 CaCO3和CaCO3@SiO2的XRD谱图Fig.8 XRD spectra of CaCO3 and CaCO3@SiO2
2.2.2 SEM和EDS分析
图9所示为CaCO3和CaCO3@SiO2的SEM图像。从图可见,CaCO3颗粒表面光滑、轮廓清晰,未见有包覆物;而CaCO3@SiO2颗粒轮廓欠清晰,表面粗糙且有薄雾状包覆物,说明CaCO3@SiO2表面可能出现新的物质。

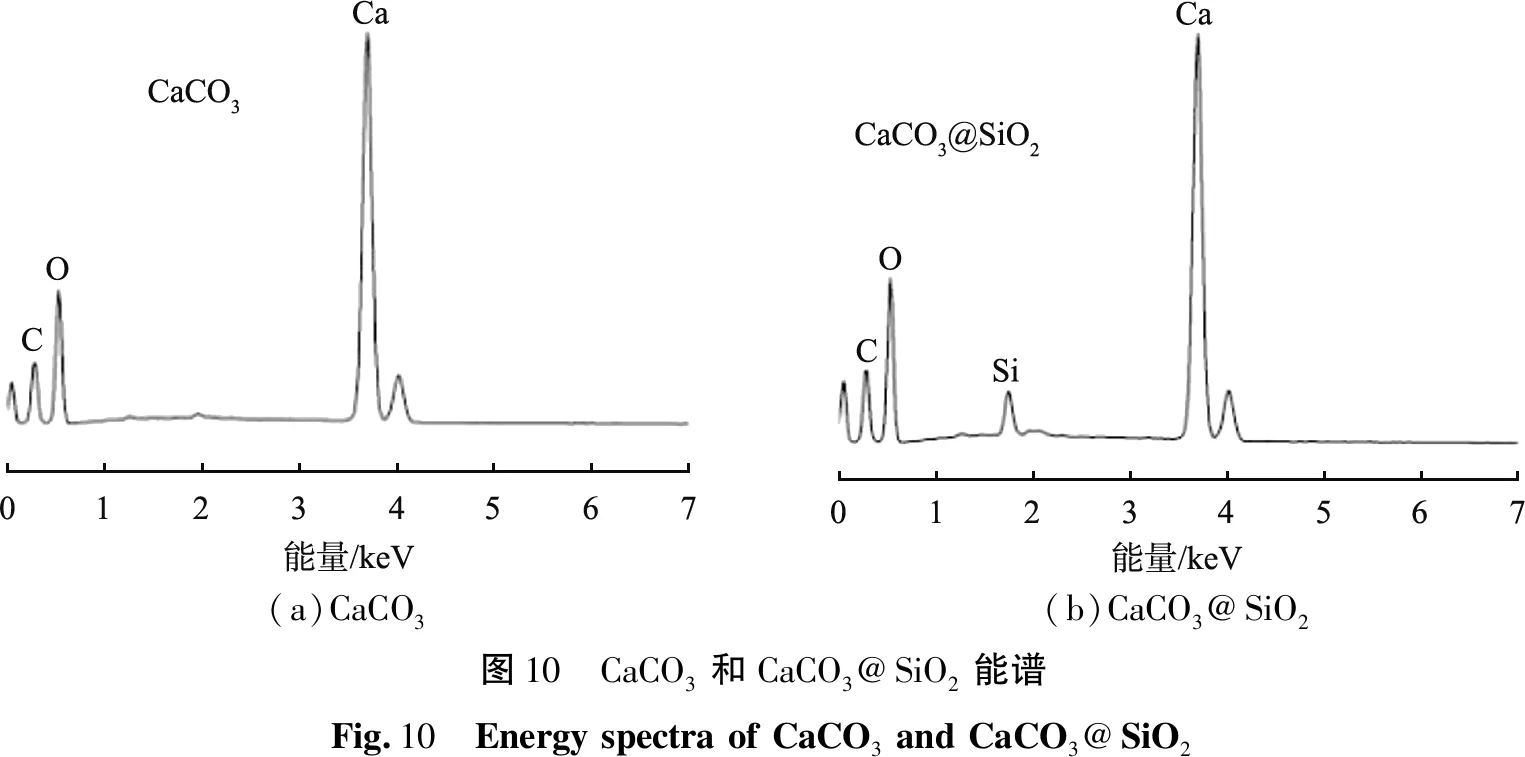
图10所示为CaCO3和CaCO3@SiO2的能谱图。由图10可见,CaCO3能谱只有C、O、Ca元素,未发现Si元素;而CaCO3@SiO2出现C、O、Ca及Si元素,说明CaCO3形成核-壳结构;由能谱半定量结果可知Ca、Si的原子比为1∶0.064,这与制备实验中SiO2质量分数为6%相一致。
2.2.3 TEM分析
图11所示为CaCO3和CaCO3@ SiO2的TEM图像。从图11(a)、(b)可见,CaCO3颗粒表面光滑,其局部放大图也未见包覆物;从图11(c)、(d)可见,CaCO3@SiO2颗粒可以看到清晰的核-壳结构,其局部放大图可看到颗粒有明显的核-壳结构,且壳层连续、致密、无晶格条纹,说明壳层为非晶态物质,与之前的XRD结果相一致。

2.2.4 FT-IR分析
图12所示为CaCO3和CaCO3@SiO2红外光谱图。
图12 CaCO3和CaCO3@SiO2的红外光谱图Fig.12 Infrared spectra of CaCO3 and CaCO3@SiO2

2.2.5 XPS分析
图13所示为CaCO3和CaCO3@SiO2的X射线光电子能谱图。由图可知,CaCO3的能谱图中只有Ca、O、C的特征峰,而CaCO3@SiO2的样品除了Ca、O、C的特征峰,还分别在150.5、103.4 eV处出现了Si 2s和Si 2p的特征峰,此外,与CaCO3相比,CaCO3@SiO2最外面的壳层SiO2还减弱了Ca 2p特征峰的强度。

图13 CaCO3和CaCO3@SiO2的X射线光电子能谱图Fig.13 X-ray photoelectron spectroscopies of CaCO3 and CaCO3@SiO2
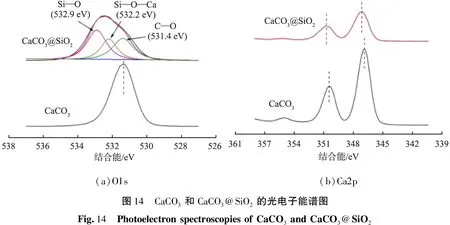
图14所示为CaCO3和CaCO3@SiO2的光电子拟合图。由图14(a)可知,531.2 eV是CaCO3的O 1s的结合能,而CaCO3@SiO2的O 1s结合能分别是532.9、532.2、531.4 eV,分别归属于Si—O、Si—O—Ca、C—O键;CaCO3@SiO2O 1s结合能531.4 eV比CaCO3的531.2 eV增大了0.2 eV,存在明显的化学位移;根据电荷势能模型,化学位移的主要原因是价电子转移使得势能改变;Si的电负性大于Ca,会吸引Ca的价电子,从而减小了Ca的电子密度,降低了屏蔽效应,增大了电子结合能,因此Si—O—Ca键的形成导致结合能的增大。由图14(b)可知,CaCO3的Ca 2p3/2和Ca 2p1/2结合能分别为347.0、350.5 eV,而CaCO3@SiO2的Ca 2p3/2和Ca 2p1/2的结合能分别为347.3、350.8 eV ,均比未形成核-壳结构的CaCO3的大0.3 eV;原因在于CaCO3表面化学键合上SiO2形成了Si—O—Ca键。
2.3 壳层SiO2的生长动力学分析
不同pH条件下CaCO3质量增量与硅酸钠滴加量的关系曲线如图15所示。从图15可见,当pH分别为10、7时,CaCO3质量增量Δm(g)与硅酸钠滴加量V(mL)之间的线性关系不同。经拟合后,pH分别为10、7时,Δm与V之间的线性方程分别为
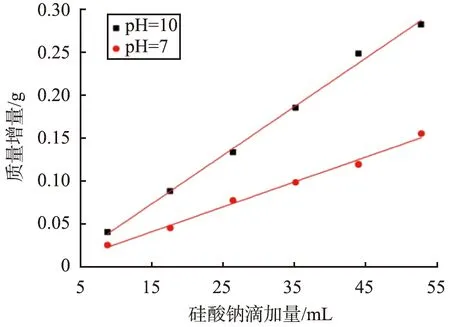
图15 不同pH条件下硅酸钠滴加量与CaCO3质量增量的关系曲线Fig.15 Relationship curves between drip dosage of NaSiO3 and mass increment of CaCO3 under deferent pH values conditions
Δm=0.005 6V-0.011 5,(pH=10),
(3)
Δm=0.002 9V-0.002 8,(pH=7)。
(4)
假设CaCO3核为球形,则壳层SiO2厚度(ds)的计算公式为
(5)
式中:mc为CaCO3的质量,g;Sc是CaCO3的比表面积,cm2/g;ρs为SiO2的密度,g/cm3,而Sc的计算公式为
(6)
式中:ρc为CaCO3的密度,g/cm3;dc为CaCO3的直径,cm。将式(6)代入式(5)中则有
(7)
将式(3)、(4)代入式(7)则有
ds=1.954V-4.014,
(8)
ds=1.012V-0.977 2。
(9)
实验中控制滴加硅酸钠为匀速过程,滴加速度始终为0.45 mL/min,则硅酸钠滴加量为
V=0.45t,
(10)
式中,t为时间,min。将式(10)分别代入式(8)、(9),可得
ds=0.879 3t-4.101 4,
(11)
ds=0.455 4t-0.977 2。
(12)
式(11)、(12)反应了不同pH下SiO2壳层厚度与硅酸钠的滴加时间呈现线性关系。2个式子中的常数项均为负值,说明在反应初期,生成非晶硅的量少,在成核初期核的大小尚未达到临界值时,核结构极不稳定,瞬间可能消失,所以成核需要一定时间孕育[16]。随着反应时间的进行,硅酸钠的量增加,核的尺寸达到并超过临界值,进入粒子生大阶段,线性关系中的斜率即为壳层SiO2的生长速率,可看到pH为10时的壳层生长速率为pH为7时的近2倍。
3 结论
1)以硅酸钠、硫酸为原料,在CaCO3颗粒表面生长SiO2壳层,形成CaCO3@SiO2核-壳结构。壳层SiO2是一无定形的纳米膜,且以Ca—O—Si键化学键合在CaCO3颗粒表面。
2)当反应温度为90 ℃、反应时间为120 min、CaCO3初始质量浓度为100 g/L、pH为9.5~10、SiO2质量分数为6%、搅拌速率为250 r/min、陈化时间为36 h时,CaCO3@SiO2酸溶率可降为17.92%。
3)pH值对壳层SiO2的生长影响较大,当pH为10、7时,前者壳层生长速率是后者的近2倍。

