FeOOH-MnO2修饰海泡石纤维及其对As(V)的吸附性能
甄 爽,杜玉成,王金淑,马延龙,李 杨,史默涵,林彭辉
(北京工业大学 材料与制造学部;新型功能材料教育部重点实验室,北京 100124)
重金属离子砷As(V)具有强烈的迁移性、易富集性和生物毒性,可以通过食物链在生物体内积累,不仅可以引起人体急性、慢性中毒,还具有致突变、致畸和致癌作用[1-2]。国内外处理含砷废水有较多方法,如膜分离法、电化学法、化学沉淀法和吸附法等。吸附法相对简单、经济、有效[3],吸附剂的性能(吸附容量、吸附速率和去除效率)是实际应用中的关键问题。
纳米结构材料是表面活性官能团最为丰富的材料,具有比表面积大、吸附效能以及氧化-还原化学反应活性高的特点,在吸附去除含砷废水中的相关报道中,纳米结构的MnO2和抗坏血酸包覆的Fe3O4纳米颗粒对As(V)的吸附容量分别为7.8、16.6 mg/g[4-5]。研究发现,Fe-Cu复合氧化物和Fe-Mn复合氧化物对As(V)的吸附容量分别为82.7、69.8 mg/g,复合金属氧化物对As(V)的吸附能力远高于单一金属氧化物的,2种金属之间存在协同效应,当金属氧化物的粒径减小到纳米级时,存在颗粒团聚严重(影响吸附效能)和吸附剂难于后续处理(固液分离困难)问题,限制其规模化应用[6-7],因此,开发廉价、吸附性能高、易与水分离、易于大规模生产的吸附剂具有重要意义。金属氧化物改性沸石、滑石、黏土具有天然有序的微-介孔结构和良好的吸附能力,其中,含有大量活性基团的海泡石是一种典型黏土矿物类吸附材料,是处理重金属离子废水最有前景的吸附材料之一。
海泡石是一种具有天然纤维结构的硅酸镁黏土矿物,自身结构中具有可用于交换的阳离子(例如K+、Na+和Mg2+),使得有机基团和无机离子能够结合到结构中去[8]。海泡石表面存在大量的Si—OH、Mg—OH等基团,极性强的阳离子(金属离子)可以取代海泡石表面的Mg2+。引入铁、锰金属离子,可以通过位于通道中或在矿物表面形成氧代或氢氧络合物来增加矿物的活性位点[9],同时能诱发强的表面酸性,易接受外来电子。海泡石表面的Si—O—Si键断裂生成Si—OH,需要质子或者羟基分子来补偿剩余电子,使得海泡石表面呈负电性,因此,需要对海泡石的带电表面进行改性,提高其对重金属离子的吸附能力。
高活性的纳米结构材料与天然矿物有机结合,在有效解决上述问题的同时,可显著提升矿物材料表面活性。基于以上分析,本文中拟以KMnO4、MnCl2和FeCl3为金属源,以尿素为沉淀剂,采用水热法制备羟基氧化铁-二氧化锰(FeOOH-MnO2)修饰的海泡石,并对重金属离子As(V)进行吸附性能实验研究,为海泡石在重金属污水净化领域中的应用提供技术借鉴。
1 实验
1.1 试剂
HR03海泡石纤维绒(粒径为45 μm的海泡石,质量分数大于95%,长径比大于20∶1,河北省易县宏光伟利海泡石厂);高锰酸钾(KMnO4)、氯化锰(MnCl2,天津市福晨化学试剂厂);氯化铁(FeCl3,国药集团化学试剂有限公司);十二烷基苯磺酸钠(SDBS)、尿素、无水乙醇、盐酸(HCl)、氢氧化钠(NaOH)、六偏磷酸钠((NaPO3)6,北京化学试剂厂);去离子水由实验室自制。
1.2 样品制备
海泡石前期处理:在400 mL烧杯中,放入20 g的海泡石,加入0.1 g的NaPO3)6,再加入250 mL浓度为1.6 mol/L的HCl溶液,常温搅拌2 h,抽滤、洗涤、烘干备用。
称取1.0 g上述处理过的海泡石,放入100 mL烧杯中,加入20 mL去离子水,常温搅拌10 min制得分散性良好的海泡石悬浮液,再依次加入0.12 g的SDBS、1.1 g的MnCl2、0.6 g的KMnO4、1.4 g的FeCl3,连续搅拌,再添加0.9 g的尿素;将混合水溶液倒入100 mL高压釜,180 ℃条件下在烘箱中反应若干时间。冷却至室温,抽滤、洗涤、烘干,制得FeOOH-MnO2-海泡石样品。
1.3 样品分析
采用D/MAX-II 型X射线衍射仪(具有Cu K1辐射和弯曲石墨晶体单色仪滤光片,在35 mA和35 kV下运行,扫描速度为4(°)/min,步长为0.02°;日立570型扫描电镜(SEM和EDS);日立H-9000 NAR TEM(TEM和HRTEM,工作电压为250 kV);ASAP 2020装置(表面积和孔径分布分别根据BET和BJH方法计算);ESCALAB 250Xi型X射线光电子能谱测试仪(以Al K为激发源,光子能量为1 486.6 eV的X射线为辐射源)。
1.4 吸附实验
将已知质量浓度的100 mL As(V)标准溶液添加到250 mL锥形瓶中,用浓度均为1 mol/L的HCl和NaOH溶液调节水溶液的pH,将0.04 g的海泡石和样品分别添加到上述溶液中,磁力搅拌不同的时间(5~90 min)。用直径为0.22 μm 的针头过滤器进行过滤。取滤液,随后采用电感耦合等离子体原子发射光谱(ICPAES,Shimazu ICPE-9000)技术测定滤液中的As(V)的质量浓度。过滤后的固体样品,烘干、研磨、压片,随后采用XPS技术分析吸附剂吸附As(V)后的各价键结构。
As(V)的去除率E和吸附量qe的计算公式为
E=(ρ0-ρe)/ρ0×100%,
(1)
qe= (ρ0-ρe)V/m,
(2)
式中:E为去除率,%;ρ0为初始As(V)质量浓度,mg/L;ρe为平衡As(V)质量浓度,mg/L;qe为平衡As(V)吸附容量,mg/g;V为溶液体积,L;m为吸附剂质量,g。
2 结果和讨论
2.1 样品的XRD分析
海泡石和不同反应时间获得样品的XRD谱图如图1所示。由图1可知,海泡石在2θ为10.487°、28.510°、26.325°处为阳起石相特征衍射峰,也存在少量杂峰;水热反应6~16 h样品中仍存在阳起石相的特征衍射峰,但强度减弱;不同反应时间样品均出现新的晶体衍射峰,且随反应时间的增加,特征衍射峰强度增大;在2θ为12.744°、18.061°、37.627 °处出现新的衍射峰,分别对应于α-MnO2的(110)、(200)、(121)晶面,晶格常数分别为a=b=9.815 0 Å和c=2.847 9 Å,与标准α-MnO2样品的值(JCPDS PDF#72-1982)吻合;在2θ为21.199°、36.630°、33.225°处出现了3个衍射峰,分别对应于FeOOH的(110)、(111)、(130)晶面,晶格常数为a=4.615 8 Å、b=9.954 5 Å和c=3.023 3 Å,与标准FeOOH样品(JCPDS PDF#81-0463)的衍射峰一致。结果表明,水热反应后的样品在保留了海泡石的结构特征外,增加了FeOOH和α-MnO2晶体特征,但FeOOH和α-MnO2相的衍射峰变宽,这可能是由于它们的低结晶度所致。α-MnO2相为2×2沟道晶体结构,晶型沿c轴叠加延伸。通过简单控制反应时间,很容易定向生长,形成纳米棒状结构,并使α-MnO2晶体更加完整[10],样品的SEM测试也表明这点。
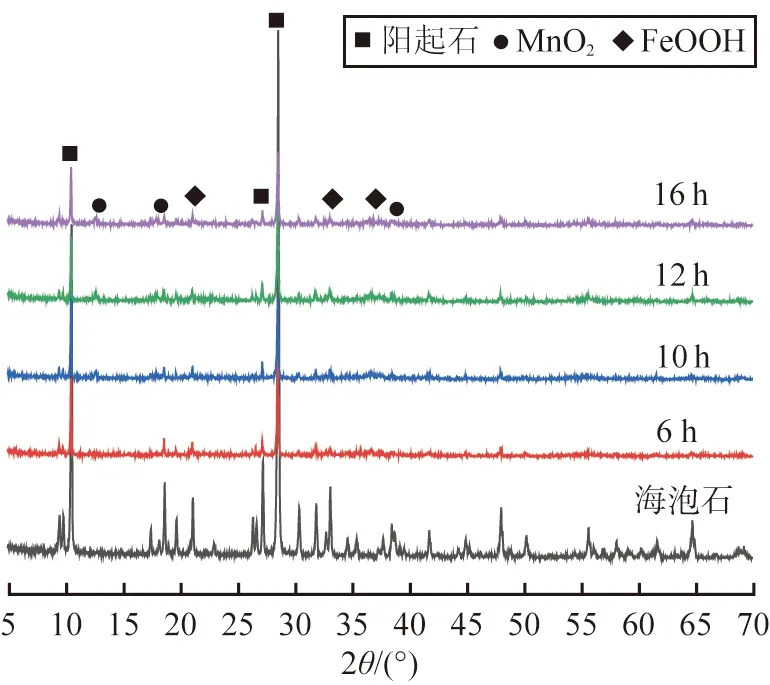
图1 海泡石和不同反应时间获得样品的XRD谱图Fig.1 XRD patterns of sepiolite and samples obtained under different reaction time
2.2 样品的SEM和TEM分析
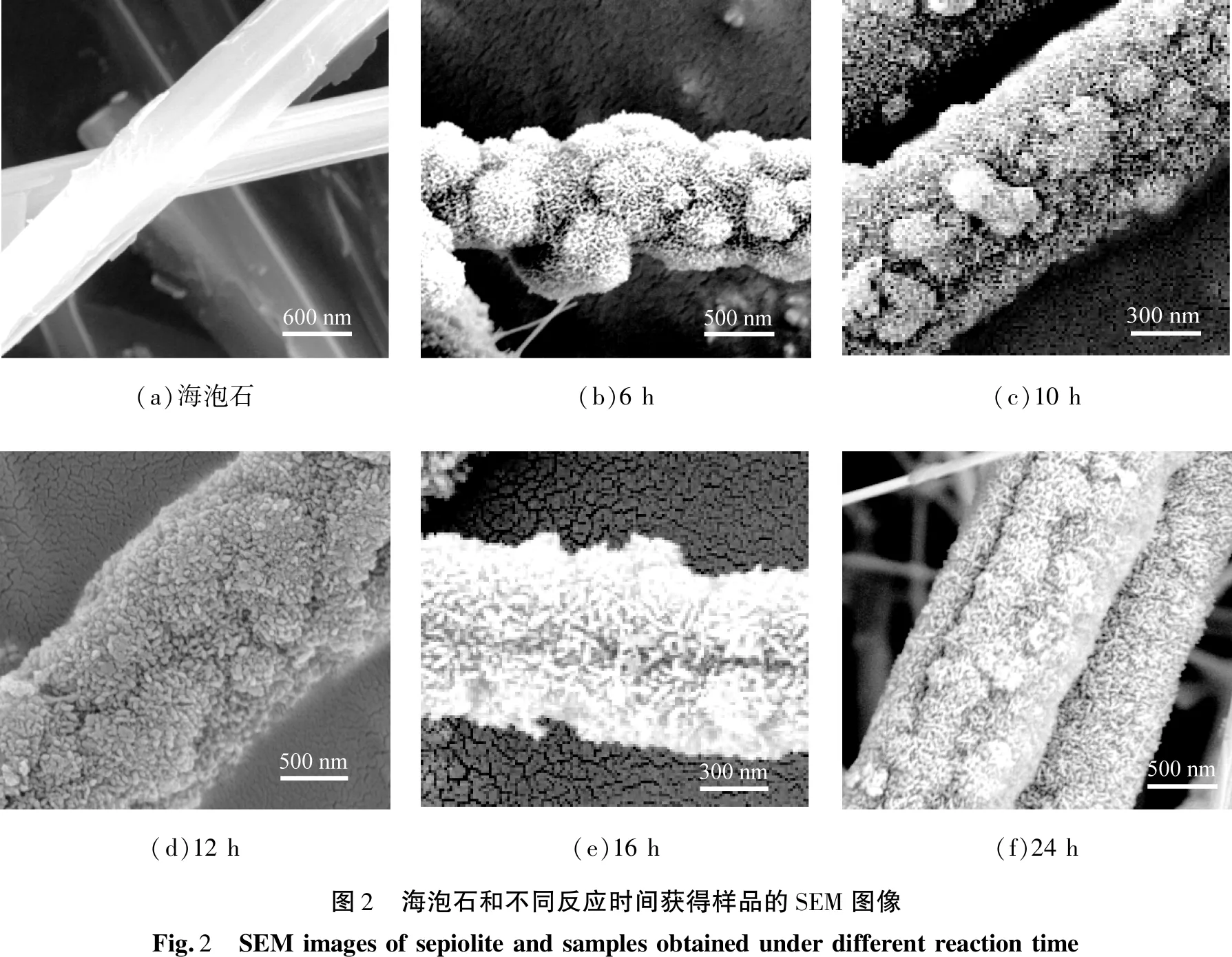
海泡石和不同反应时间获得样品的SEM图像如图2所示。由图2(a)可知,海泡石具有表面光滑的直棒状纤维结构,纤维相互粘附形成相对较大的致密束,直径为500~700 nm。由图2(b)—(f)可知,不同反应时间获得的样品,均存在纳米颗粒在海泡石纤维包裹特征,且纳米颗粒早期以纳米球状结构为主,后期以纳米棒状结构为主,表明随着反应时间的增加,包裹在海泡石纤维基体上的纳米颗粒呈现由纳米球叠加延伸生长为纳米棒组装过程;反应时间延长24 h后,样品中棒状结构的尺寸和厚度相对均匀,短棒状结构的直径从50 nm增加到150 nm,整体形貌没有改变。
在180 ℃条件下水热12 h样品的TEM、HRTEM和SAED图像如图3所示。由图3(a)可以看出,海泡石纤维边缘存在花状结构,并由大量纳米棒或纳米片组成。图3(b)的HRTEM图像,可清晰地看到晶格间距不等的衍射条纹,在选定区域进行晶格间距标定,所测得晶面间距(d值)为0.694 nm,与α-MnO2标准卡片(PDF#72-1982)的(110)晶面相符合。图3(c)为SAED图案中电子衍射呈环,表明α-MnO2为多晶结构。同时,通过EDS测试中Mn、Fe元素含量计算得知,样品中FeOOH、MnO2的质量分数分别为7.76%、11.42%,海泡石质量分数约为80%。按实验配比FeOOH-MnO2对包覆90%海泡石设计,仍有部分Mn、Fe氧化物游离于海泡石纤维之外。

2.3 样品的比表面积和孔径分析
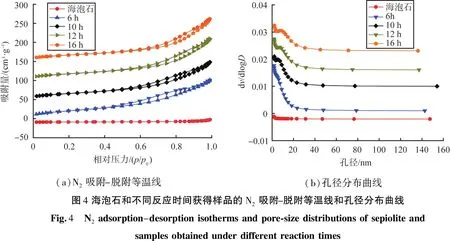
在180 ℃反应条件下,海泡石和不同反应时间获得的样品的氮气吸脱附曲线和孔径分布曲线如图4所示。由图4(a)可知,海泡石原矿N2吸脱附曲线类似为一直线,表明未经处理的海泡石纤维孔结构不明显,样品比表面积仅为12.6 m2/g;反应时间为6、10、12、16 h的样品,表现为类似Ⅳ型吸附等温线,样品存在介孔材料特征[12],结合海泡原矿吸脱附曲线,这种孔结构应该以堆积孔结构形式存在;样品在相对压力为0.4~1.0的范围内存在类似H3型、H4迟滞环,归因于狭缝状孔道,即孔结构是由层状颗粒累积而成[13]。由图4(b)孔径分布曲线可知,海泡石原矿没有孔径分布;反应后各样品存在0~20 nm的孔径分布,但很不规则,结果表明FeOOH和MnO2沉积后,样品存在介孔、大孔结构,这也是比表面积增加原因所在。
海泡石和不同反应时间获得样品的比表面积如表1所示,反应后样品比表面积增加明显,比表面积最大可达77.4 m2/g。
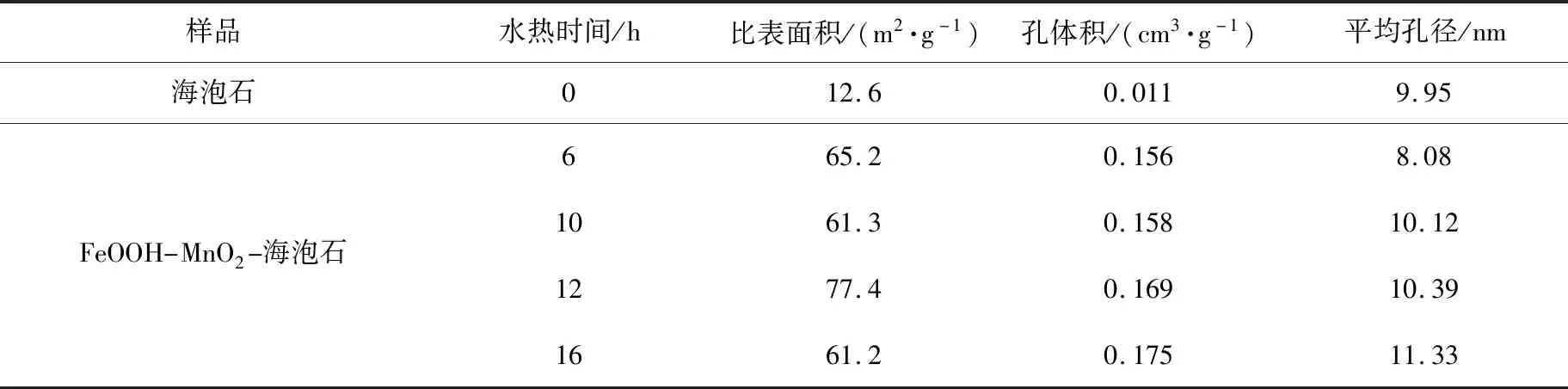
表1 海泡石和不同反应时间获得样品的比表面积Tab.1 Specific surface area of sepiolite and samples obtained under different reaction times
2.4 样品对砷的吸附性能
在室温、吸附时间为40 min、吸附剂用量为40 mg、As(V)初始质量浓度为20 mg/L、反应时间为12 h的条件下所得FeOOH-MnO2-海泡石样品,水溶液的pH值对样品吸附As(V)的去除率影响如图5所示。由图5可知,在pH小于3.5时,样品对As(V)吸附去除率随水溶液的pH增加而增大;在pH大于9.5时,去除率随pH增加而减小;pH为3.5~9.5时,去除率均大于96%,最大可达98%;pH分别为3.5和8.5时,样品对As(V)去除率有2个小峰值,这可能是由于pH的改变影响了海泡石基体表面的ξ电位,较有利于对As(V)的吸附。当溶液的pH大于基体等电点时,基体表面带负电荷,即ξ电位变为负;当溶液的pH小于基体的等电点时,基体表面带正电荷,即ξ电位变为正电位[3]。当基体表面带正电时,有利于As(V)的吸附,去除效率提高。当pH大于9时,基体表面带负电,可能阻碍As(V)的吸附;当pH小于3时,尽管基体表面带正电荷,但水溶液中高质量的H+与基体竞争吸附As(V),从而在一定程度上影响对As(V)的去除效率。
在室温、水溶液的pH为7、吸附剂用量为40 mg、As(V)初始质量浓度为20 mg/L、反应时间为12 h的条件下所得FeOOH-MnO2-海泡石样品,吸附时间对样品吸附As(V)的去除率的影响如图6所示。由图6可知,样品在初始吸附阶段(前20 min)快速吸附As(V)阴离子,对As(V)的去除效果显著;在50 min内达到稳定,吸附主要发生在样品的外表面和部分微孔上。随着As(V)阴离子吸附量的增加,吸附的As(V)物种间的排斥力增强,游离或As(V)在孔隙上的吸附受阻,因此As(V)的吸附量减小,去除率不再继续升高。
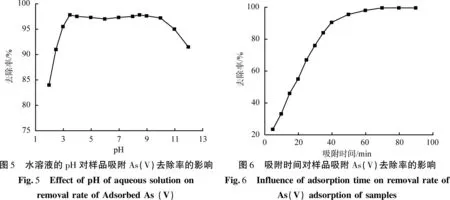
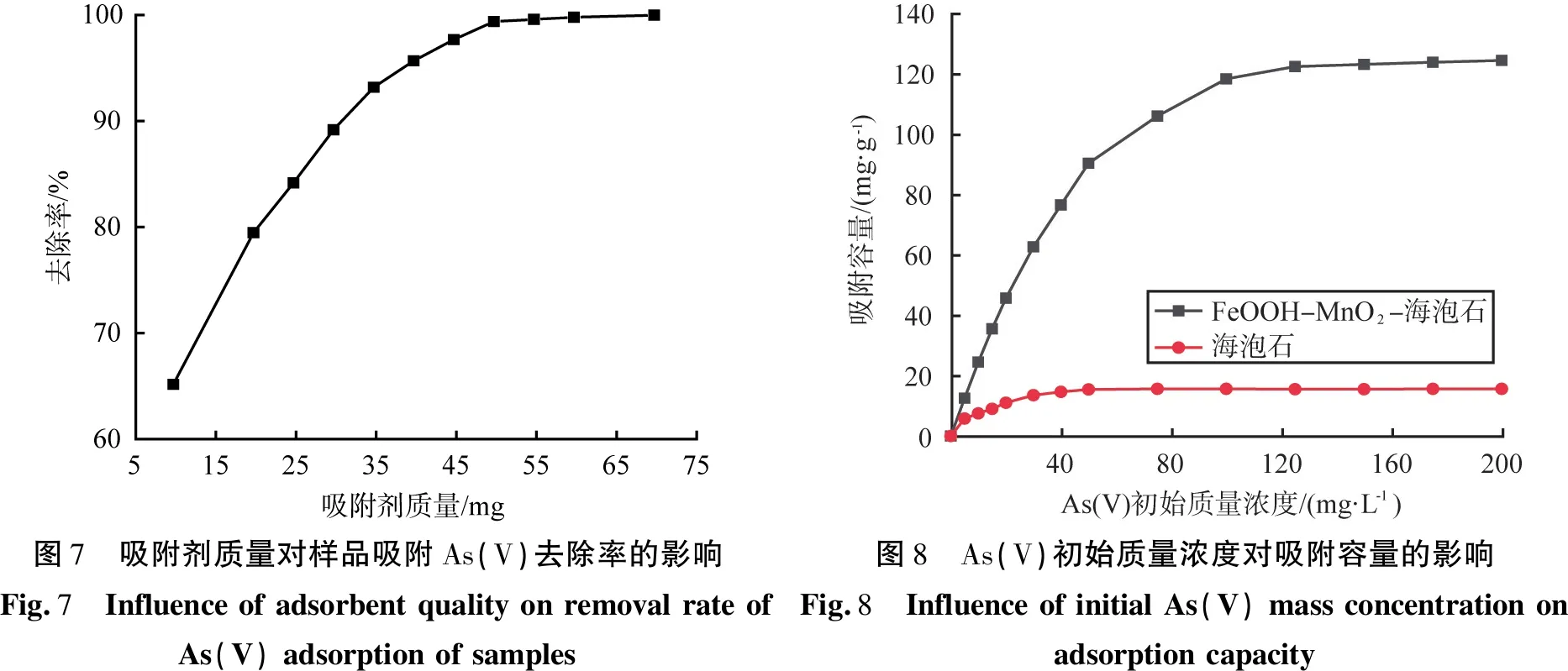
在室温、水溶液的pH为7、吸附时间为40 min、As(V)初始质量浓度为20 mg/L、反应时间为12 h的条件下所得FeOOH-MnO2-海泡石样品,吸附剂质量对样品吸附As(V)的去除率的影响如图7所示。由图7可以看出,吸附剂质量的增加导致早期As(V)去除效率的快速增加,吸附剂质量在达到45 mg后吸附饱和。
在室温、水溶液的pH为7、吸附时间为40 min、吸附剂用量为40 mg、反应时间为12 h的条件下所得FeOOH-MnO2-海泡石样品,As(V)初始质量浓度对样品吸附容量的影响如图8所示。由图8可知,随着As(V)质量浓度的增加,样品对As(V)吸附容量迅速增加;当As(V)初始质量浓度达到150 mg/L时,样品的饱和吸附容量为124.3 mg/g;海泡石原矿在As(V)质量浓度为15.6 mg/L时几乎达到饱和。
综上,在不同吸附参数条件下,样品对As(V)去除率可在98%以上,最佳条件下可达99.9%;对于初始质量浓度为20 mg/L的含As(V)废水,吸附后废水中As(V)残留量为0.4~0.02 mg/L。样品对该质量浓度的含As(V)废水,采用一次吸附可实现满足污水排放GB 18918—2002标准要求的目标,在最佳条件下可满足饮用水标准要求。
不同吸附剂对As(V)的吸附能力见表2。由表2可以看出,海泡石对As(V)的最大吸附容量为15.6 mg/g,在180 ℃水热处理12 h得到的FeOOH-MnO2-海泡石样品的最大As(V)吸附容量为124.3 mg/g,很明显,FeOOH-MnO2-海泡石比海泡石具有更强的As(V)吸附能力,这是因为,氧化铁对砷化合物具有很强的亲和力,As(V)可以被吸附沉淀在FeOOH上,形成无定形或难溶性Fe(II-III)-As化合物,氧化锰可以选择性地将As(III)氧化为As(V),同时用作氧化剂和吸附剂;Fe-Mn复合材料表面存在较多的微孔和活性中心,2种金属之间存在协同效应,可以提高高价含氧酸的吸附效率,例如,通过共沉淀法制备的Mn-Al复合氧化物[14]和Fe-Ti-Mn复合氧化物[15]在pH为7时的As(V)吸附容量分别为114.5、74.4 mg/g,但是,当金属氧化物的粒径减小到纳米级时容易团聚,严重影响其对重金属离子的吸附效率,将金属氧化物负载在大尺度基体上可以有效解决固液分离困难问题,例如,ZSM-5沸石负载硫化物纳米级零价铁(S-nZVI@ZSM-5)复合吸附剂的As(V)吸附容量为161.7 mg/g[16],改性木棉纤维(FRKF)的As(V)吸附容量为30.0 mg/g[17]。相比之下,生产成本更低的FeOOH-MnO2-海泡石样品在工业含砷(V)废水处理中具有更大的应用潜力。
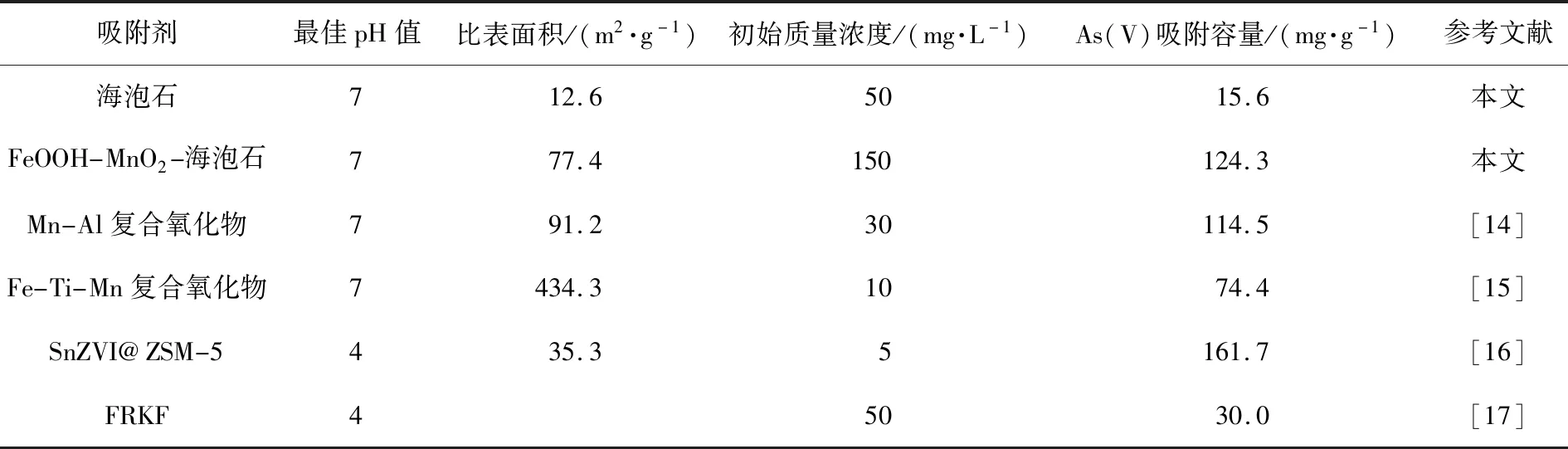
表2 不同吸附剂的对As(V)的吸附能力Tab.2 Adsorption capacity of different adsorbents for As(V)
2.5 样品的合成与吸附机理
2.5.1 样品的合成机理

(NH2)2CO+H2O→2NH3+CO2↑,
(3)
(4)
(5)
Fe3++3OH-→Fe(OH)3,
(6)
Fe(OH)3→FeOOH+H2O。
(7)
2.5.2 样品的吸附机理
为了探究样品对As(V)的吸附机理,采用XPS对水热12 h样品吸附As(V)前、后进行分析,XPS光谱如图9所示。
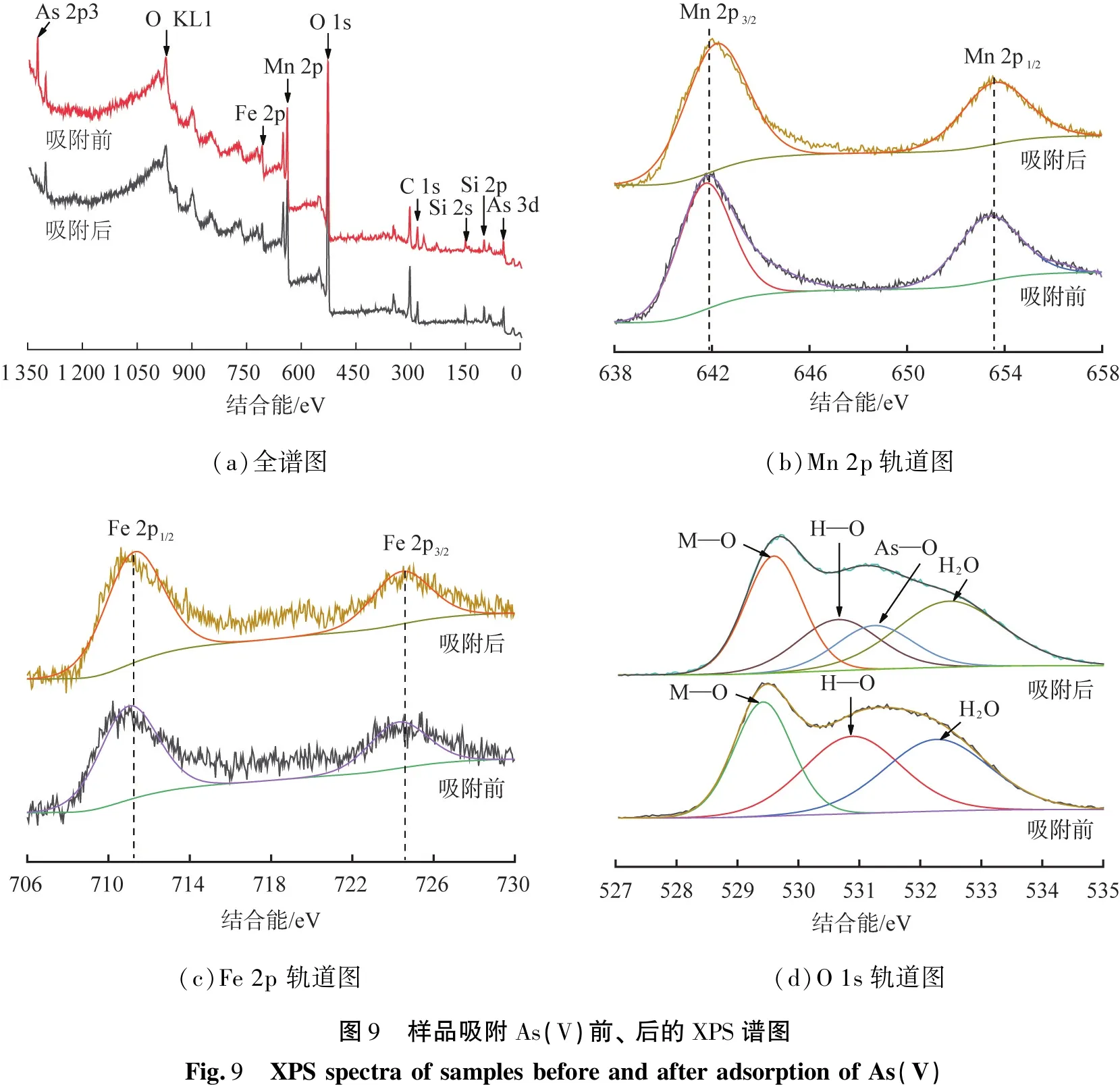
图9(d)为pH为7时吸附As(V)前、后的O 1s高分辨XPS谱图,吸附前的O 1s XPS图谱可以分为529.6、530.6、532.5 eV,3个峰分别对应与金属氧化物中的晶格氧(O以M—O形式结合)、金属氢氧化物中的吸附氧(M—OH,羟基与金属元素成键)及复合吸附剂中的吸附水(H2O)[20]。通过对比这些峰在吸附As(V)前、后的变化可知,吸附氧(M—OH)的峰值强度在吸附后明显降低,晶格氧(M—O)的峰值强度有所提高,这可能是由于As(V)与吸附剂表面的Si—OH(Mg—OH)形成化学键,形成了As—O(或As—O—Mn或As—O—Fe)导致的,从而提高了该组分的结合能,从吸附后O 1s轨道也能观察到新峰的出现,位于结合能531.1 eV处,可归结于AS—O键[20]。基于以上XPS分析可以说明,经过纳米结构FeOOH和MnO2复合氧化物改性的海泡石复合吸附剂对As(V)进行了有效地化学吸附。
根据以上对As(V)吸附前、后样品的XPS分析可知,As(V)的吸附主要是化学吸附。表面络合反应可以很好地解释As(V)的吸附机理。含As(V)的阴离子通过配体交换取代吸附剂表面的羟基,形成内球面络合物,从而达到去除As(V)的目的。
Langmuir和Freundlich等温吸附方程可以描述As(V)在样品上的吸附行为。Langmuir和Freundlich等温线方程分别为
ρe/qe=1/(qmKL)+ρe/qm,
(8)
(9)
式中:qm为最大吸附容量,mg/g;KL为Langmuir常数;n和KF为Freundlich常数。通过重新组织方程式(8)、(9),可以得到如下等式:
1/qe=1/(ρeqmKL)+1/qm,
(10)
lgqe=lgKF+(1/n)lgρe。
(11)
在对Langmuir和Freundlich方程进行拟合分析后,样品吸附As(V)的等温方程线性拟合曲线如图10所示。由图10可知,样品上As(V)吸附的相关系数R2值分别为0.949 5、0.973 5,表明样品的等温As(V)吸附模型更符合Freundlich方程。

根据式(10)和(11),可以获得KL、n、KF和R2的数据,样品吸附As(V)时Langmuir和Freundlich方程的等温常数如表3所示。根据Freundlich等温吸附模型计算的1/n值小于1,表明样品吸附As(V)过程较容易发生,对As(V)是优先级吸附,即对砷的吸附具有选择性,而且以化学吸附为主。
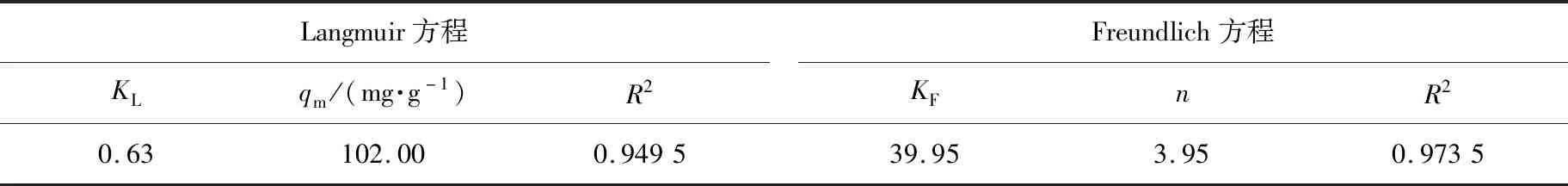
表3 样品吸附As(V)时Langmuir和Freundlich方程的等温常数Tab.3 Isothermal constants of Langmuir and Freundlich equations for adsorption of As(V) to samples
采用质量分数为8%的HCl溶液进行洗脱,吸附后固体样品和洗脱液加入到150 mL玻璃锥形瓶内,恒温水浴往复振荡60 min,解吸吸附剂表面上吸附的As(V),混合溶液移至100 mL离心管中,以3 000 r/min的转速进行离心处理10 min,将固体样品取出后烘干,进行再次吸附实验。循环次数对样品去除As(V)的影响如图11所示。由图11可知,4次循环样品对As(V)去除率仍在90%以上,第5次循环后降至85%,第7次循环后降至73.4%,表明样品对废水中的As(V)吸附具有较好循环性。在第7次循环后As(V)去除率降低的主要原因在于,解吸后样品的活性位点有抑制固体表面吸附活性趋向,同时,在样品进行解吸时,会有少量Mn溶出,导致有效组分降低。

图11 循环次数对样品吸附As(V)去除率的影响Fig.11 Effects of cycle number on removal rate of adsorption of As(V) to samples
3 结论
高活性的纳米结构FeOOH-MnO2与天然海泡石有机结合,可显著提升海泡石吸附性能。以KMnO4、MnCl2和FeCl3为金属源,尿素为沉淀剂,采用水热法制备FeOOH-MnO2复合金属氧化物修饰的海泡石,合成工艺简单,吸附性能优异,是一种很有前途的废水除砷吸附剂。
1)FeOOH-MnO2呈短棒状均匀负载在海泡石纤维上。
2)采用水热法180 ℃水热12 h制备的FeOOH-MnO2-海泡石样品,具有较大的比表面积(77.4 m2/g)。
3)当水溶液的pH为7、室温条件下,对As(V)的最大吸附容量为124.3 mg/g,对As(V)具有良好吸附性能。
4)FeOOH-MnO2-海泡石对As(V)的吸附为化学吸附,符合Freundlich等温吸附模型,即通过样品表面羟基与As(V)之间的离子交换。
5)FeOOH-MnO2-海泡石吸附剂表现出良好的吸附循环性能,在第5次循环后As(V)去除率保持在90%左右。

